
了解川崎病休克综合征(KDSS)的临床特征,比较KDSS患儿与无休克川崎病(KD)患儿的临床和实验室特点。
收集2015年1月1日至12月31日南京医科大学附属儿童医院收治的72例KD患儿,其中并发休克KD患儿11例(KDSS组),无休克KD患儿61例(无休克KD组)。比较2组患儿人口学资料、临床和实验室数据之间的差异,采用Logistic回归方法筛选出KDSS的相关因素。
在72例KD患儿中,男童多见[占77.8%(56/72例)],其中11例(15.3%,11/72例)符合KDSS的定义,患儿均接受了液体复苏及血管活性药物治疗,2例(18.2%,2/11例)出现丙种球蛋白抵抗。入院时,KDSS组中不完全KD 2例(18.2%,2/11例);在无休克KD组中,不完全KD的相对频率为16.4%(10/61例)。KDSS患儿中有90.9% (10/11例)出现超声心动图异常(以冠状动脉扩张及二尖瓣反流多见),而无休克KD患儿中18.0%(11/61例)出现超声心动图异常,2组比较差异有统计学意义(P=0.000)。KDSS患儿急性期胃肠道出血占18.2%(2/11例),无休克KD患儿占0(0/61例),2组比较差异有统计学意义(P=0.001);KDSS组呕吐患儿明显多于无休克KD组[54.5%(6/11例)比16.4%(10/61例)],差异有统计学意义(P=0.005)。KDSS组患儿血钠浓度[(131.91±3.86) mmol/L]低于无休克KD组[(136.02±4.23) mmol/L],差异有统计学意义(P=0.000);KDSS组患儿B型钠尿肽水平[(834.91±1 411.48) ng/L]高于无休克KD组[(128.28±98.92) ng/L],差异有统计学意义(P=0.000);KDSS组患儿肌钙蛋白I水平[(0.72±2.19) μg/L]高于无休克KD组[(0.00±0.01) μg/L],差异有统计学意义(P=0.010);KDSS组患儿降钙素原(PCT)水平[(25.44±34.06) μg/L]高于无休克KD组[(1.18±1.97) μg/L],差异有统计学意义(P=0.000)。KDSS组患儿CD3+T淋巴细胞[(44.39±11.86)%]低于无休克KD组[(59.69±10.86)%],差异有统计学意义(P=0.000);KDSS组患儿CD4+ T淋巴细胞[(25.17±8.78)%]低于无休克KD组[(35.77±11.24)%],差异有统计学意义(P=0.005);KDSS组患儿自然杀伤(NK)细胞[(9.93±5.63)%]高于无休克KD组[(5.41±3.63)%],差异有统计学意义(P=0.000);KDSS组患儿B淋巴细胞高于无休克KD组[(40.93±13.74)%比(29.18±9.53)%],差异有统计学意义(P=0.000)。Logistic多因素分析结果显示肌钙蛋白I[比值比(OR)=4.173,Wald=56.967,P<0.001]、PCT(OR=0.378,Wald=14.738,P=0.007)、NK细胞(OR=0.053,Wald=6.656,P=0.008)与KDSS相关。
KDSS患儿的胃肠道表现及超声心动图的异常均较无休克KD患儿增加。虽然多因素分析结果仅显示肌钙蛋白I、PCT、NK细胞为KDSS的相关因素,但临床上如遇到低钠血症、B型钠尿肽异常升高、细胞免疫功能紊乱时仍需警惕KDSS。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
川崎病(KD)是一种急性系统性血管炎,表现为发热≥5 d、结膜炎、皮疹、口唇和四肢远端变化及颈部淋巴结病,病因不明。未经治疗的患者中,约有30%的患者出现冠状动脉异常,但经静脉注射免疫球蛋白(IVIG)和阿司匹林治疗后,心脏后遗症的发生率可明显降低[1]。在KD患者中,10%~20%的患者未对初始的IVIG治疗作出反应,而这些患者冠状动脉异常的发生率较高[2]。近年来,越来越多的研究认为,在儿科收治的与IVIG输注无关的血流动力学不稳定性KD的严重形式被描述为川崎病休克综合征(KDSS)[1,3,4],部分患者甚至需转入重症监护室管理。国外关于KDSS发病率的文献报道各不相同(1.9%~7.0%)[2,5,6]。据报道,在美国一项涉及3 115例KD患者的大型研究中,西班牙裔族群与冠状动脉粥样便化性心脏病的发生有很大关系[7]。目前我国对KD这种并发症的数据及特征尚缺乏了解,本研究回顾性收集2015年南京医科大学附属儿童医院收治的KD患儿的临床资料,分析KDSS的临床特征,比较KDSS患儿与无休克KD患儿的差异,以寻找相关危险因素。
选取2015年1月1日至12月31日南京医科大学附属儿童医院收治的KD患儿72例。其中男56例(77.8%),女16例(22.2%);年龄(3.37±2.25)岁(1个月22 d~13岁)。根据病程中是否合并休克分为2组:KDSS组11例(15.3%,11/72例),男8例(72.7%),女3例(27.3%);年龄(4.41±3.62)岁(2个月10 d~13岁)。无休克KD组61例(84.7%,61/72例),男48例(78.7%),女13例(21.3%);年龄(3.17±1.74)岁(1个月22 d~8.75岁)。该项研究已通过医院医学伦理委员会审查(批准文号:201501001-1),患儿监护人均知情同意。
KD分为2种类型:即典型KD和不完全KD。患儿均符合其中1种。具体诊断标准如下,典型KD:下述6条中至少5条,其中发热必备:(1)不明原因发热≥5 d;(2)双侧结膜充血(非化脓性的);(3)口腔及咽部黏膜弥散充血,口唇发红及干裂,并呈杨梅舌;(4)发病初期手足硬肿和掌跖发红,以及恢复期指趾端出现膜状脱皮;(5)躯干部多形红斑,但无水疱及结痂;(6)颈部淋巴结的非化脓性肿胀,其直径达1.5 cm或更大。但如二维超声心动图或冠状动脉造影查出冠状动脉瘤或扩张,4条主要症状阳性即可确诊[8]。不完全KD的定义[9]:发热≥5 d且仅有上诉典型KD诊断标准(2)~(6)中的2项或3项临床标准,另外同时具有以下实验室指标中3条:(1)无菌性脓尿;(2)根据年龄段的贫血;(3)病程7 d左右血小板>450×109/L;(4)白细胞>15×109/L;(5)转氨酶升高;(6)低清蛋白血症,但需要除外中毒休克综合征、EB病毒感染、猩红热、Stevens-Johnson综合征等发热性疾病。
(1)KD的诊断不明确;(2)有其他可代替的诊断;(3)在使用IVIG过程中出现低血压需排除在KDSS组之外。KDSS被定义为在病程中出现血流动力学不稳定的KD,即在诊断KD的基础上,患儿收缩压持续低于该年龄儿童正常收缩压低值的20%或20%以上,或并组织低灌注的临床体征,需扩容处理或依靠血管活性药物才能将血压维持在正常范围的KD。低血压的定义为年龄在1~12个月的儿童收缩压<70 mmHg(1 mmHg= 0.133 kPa)或1~12岁儿童收缩压<70+[2×年龄(年)] mmHg[10],低血压均于治疗前或IVIG治疗完成8 h后获得。超声心动图评估在诊断时进行,在发病后2~6周再次进行;但在严重并发症患儿中,超声心动图评估更为频繁。当冠状动脉内径超过正常但未形成动脉瘤时,被认为冠状动脉扩张。根据日本的标准,冠状动脉瘤分为小(内径<5 mm),中(内径5~8 mm),或巨大(内径>8 mm)[10]。丙种球蛋白抵抗定义为在最初的丙种球蛋白输注完成36 h后患儿仍持续或反复的发热(>38 ℃)[11]。
从医疗记录中获取人口学资料(性别、年龄等)、临床资料[KD类型(典型或不完全)]、临床表现、心脏并发症(心包积液、冠状动脉异常、二尖瓣反流、左心室功能不全)、胃肠道表现等,入院时的实验室数据(C反应蛋白和肝转氨酶等),及治疗情况(丙种球蛋白抵抗、液体复苏、血管活性药物及类固醇类药物的应用等)。在静脉注射前抽血进行各项实验室检查。获得的超声心动图数据包括二尖瓣反流(不包括微量或微小)、心包积液(不包括微量)、冠状动脉扩张、左心室功能障碍(LVD)(射血分数< 54%)。
应用SPSS 18.0软件对数据进行处理。计量资料采用 ±s表示,组间比较采用t检验;计数资料用百分比表示,组间比较采用χ2检验。并建立Logistic回归模型,筛选出与KDSS相关的危险因素。P<0.05为差异有统计学意义。
±s表示,组间比较采用t检验;计数资料用百分比表示,组间比较采用χ2检验。并建立Logistic回归模型,筛选出与KDSS相关的危险因素。P<0.05为差异有统计学意义。
KDSS组中不完全KD 2例(18.2%,2/11例),无休克KD组中不完全KD的相对频率为16.4%(10/61例),2组比较差异无统计学意义(P>0.05)。入院后5~7 d,不典型KD患儿逐渐呈现出该疾病的症状特征。KDSS组患儿胃肠道受累明显,腹痛的比例高于无休克KD组[36.4%(4/11例)比13.1%(8/61例)],但差异无统计学意义(P>0.05);呕吐患儿也明显多于无休克KD组[54.5%(6/11例)比16.4%(10/61例)],差异有统计学意义(P<0.05);2例患儿出现胃肠道出血,而无休克KD组无一例出现胃肠道出血,差异有统计学意义(P<0.01);2组发生腹泻患儿比较差异无统计学意义(P>0.05)(表1)。在KDSS组中1例不典型KD患儿病初曾误诊为阑尾炎(根据其临床和放射学特征)和感染性休克,术后发现不符合。KDSS组中2例(18.2%)出现神经系统受累症状,3例(27.3%)并腮腺肿大。所有患儿中2例(2.8%,2/72例)在卡介苗接种部位出现红斑,其中1例同时有会阴红斑。2组患儿在年龄、性别、发热时间、发病至诊断时间及特征性的临床表现等方面差异均无统计学意义,见表1。
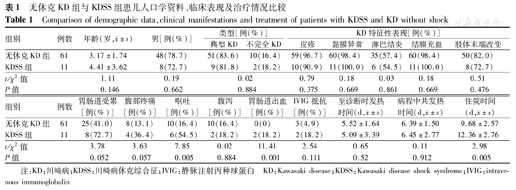
无休克KD组与KDSS组患儿人口学资料、临床表现及治疗情况比较
Comparison of demographic data,clinical manifestations and treatment of patients with KDSS and KD without shock
无休克KD组与KDSS组患儿人口学资料、临床表现及治疗情况比较
Comparison of demographic data,clinical manifestations and treatment of patients with KDSS and KD without shock
| 组别 | 例数 | 年龄(岁, ±s) ±s) | 男[例(%)] | 类型[例(%)] | KD特征性表现[例(%)] | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 典型KD | 不完全KD | 皮疹 | 黏膜异常 | 淋巴结炎 | 结膜充血 | 肢体末端改变 | ||||
| 无休克KD组 | 61 | 3.17±1.74 | 48(78.7) | 51(83.6) | 10(16.4) | 59(96.7) | 60(98.4) | 35(57.4) | 60(98.4) | 50(82.0) |
| KDSS组 | 11 | 4.41±3.62 | 8(72.7) | 9(81.8) | 2(18.2) | 10(90.9) | 11(100.0) | 6 (54.5) | 11(100.0) | 8(72.7) |
| t/χ2值 | 1.11 | 0.19 | 0.02 | 0.79 | 0.18 | 0.03 | 0.18 | 0.51 | ||
| P值 | 0.146 | 0.662 | 0.884 | 0.375 | 0.669 | 0.861 | 0.669 | 0.476 | ||
| 组别 | 例数 | 胃肠道受累[例(%)] | 腹部疼痛[例(%)] | 呕吐[例(%)] | 腹泻[例(%)] | 胃肠道出血[例(%)] | IVIG抵抗[例(%)] | 至诊断时发热时间(d, ±s) ±s) | 病程中共发热时间(d, ±s) ±s) | 住院时间(d, ±s) ±s) |
|---|---|---|---|---|---|---|---|---|---|---|
| 无休克KD组 | 61 | 25(41.0) | 8(13.1) | 10(16.4) | 10(16.4) | 0(0) | 3(4.9) | 5.52±1.64 | 6.39±1.50 | 9.68±2.57 |
| KDSS组 | 11 | 8(72.7) | 4(36.4) | 6(54.5) | 2(18.2) | 2(18.2) | 2(18.2) | 5.09±3.39 | 6.45±2.77 | 12.36±2.76 |
| t/χ2值 | 3.78 | 3.63 | 7.85 | 0.02 | 11.41 | 2.54 | 0.65 | 0.11 | 2.98 | |
| P值 | 0.052 | 0.057 | 0.005 | 0.884 | 0.001 | 0.111 | 0.52 | 0.912 | 0.005 |
注:KD:川崎病;KDSS:川崎病休克综合征;IVIG:静脉注射丙种球蛋白 KD:Kawasaki disease;KDSS:Kawasaki disease shock syndrome;IVIG:intravenous immunoglobulin
所有KD患儿中超声心动图异常共21例(29.2%)。其中冠状动脉扩张15例(20.8%)、二尖瓣反流8例(11.1%)、心包积液3例(4.2%)、左心室功能不全2例(2.8%)。KDSS组超声心动图异常例数高于无休克KD组中,2组比较差异有统计学意义(P<0.01)。患儿均未发现冠状动脉瘤。冠状动脉扩张在KDSS组中出现5例(45.5%),无休克KD组中10例(16.4%),差异有统计学意义(P<0.05)。KDSS组中二尖瓣反流及左心室功能不全所占比例明显高于无休克KD组,差异均有统计学意义(均P<0.05),但在心包积液方面,2组比较无明显差异,见表2。
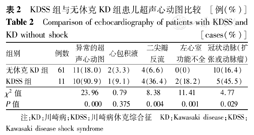
KDSS组与无休克KD组患儿超声心动图比较[例(%)]
Comparison of echocardiography of patients with KDSS and KD without shock[cases(%)]
KDSS组与无休克KD组患儿超声心动图比较[例(%)]
Comparison of echocardiography of patients with KDSS and KD without shock[cases(%)]
| 组别 | 例数 | 异常的超声心动图 | 心包积液 | 二尖瓣反流 | 左心室功能不全 | 冠状动脉(扩张或动脉瘤) |
|---|---|---|---|---|---|---|
| 无休克KD组 | 61 | 11(18.0) | 2(3.3) | 4(6.6) | 0(0) | 10(16.4) |
| KDSS组 | 11 | 10(90.9) | 1(9.1) | 4(36.4) | 2(18.2) | 5(45.5) |
| χ2值 | 23.96 | 0.79 | 8.38 | 11.41 | 4.77 | |
| P值 | 0.000 | 0.375 | 0.004 | 0.001 | 0.029 |
注:KD:川崎病;KDSS:川崎病休克综合征 KD:Kawasaki disease;KDSS:Kawasaki disease shock syndrome
KDSS组中72.7%(8/11例)患儿出现低钠血症(血钠<135 mmol/L),45.5%(5/11例)出现低清蛋白血症(血清蛋白<35 g/L),63.6%(7/11例)转氨酶升高,54.5% (6/11例)胆红素轻度升高,90.9%(10/11例)B型钠尿肽(BNP)高于正常,63.6%(7/11例)肌钙蛋白I(cTnI)明显升高,63.6%(7/11例)乳酸脱氢酶轻度增高,D-二聚体和降钙素原(PCT)均明显升高(表3)。KDSS组白细胞计数、中性粒细胞绝对值、血红蛋白、血小板、红细胞沉降率、转氨酶等与无休克KD组比较差异均无统计学意义(表4)。KDSS组中血钠水平低于无休克KD组,差异有统计学意义(P=0.000);BNP水平高于无休克KD组,差异有统计学意义(P=0.000);cTnI水平高于无休克KD组,差异有统计学意义(P=0.010);PCT水平高于无休克KD组,差异有统计学意义(P=0.000),见表4。免疫功能方面、体液免疫无明显差异,细胞免疫则差异明显,主要表现在CD3+T淋巴细胞、CD4+ T淋巴细胞、自然杀伤(NK)细胞、B淋巴细胞,差异均有统计学意义,见表4。
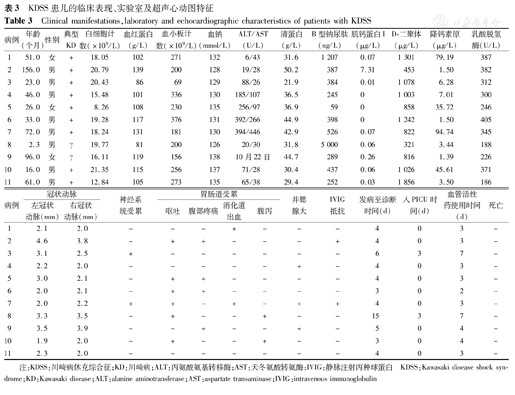
KDSS患儿的临床表现、实验室及超声心动图特征
Clinical manifestations,laboratory and echocardiographic characteristics of patients with KDSS
KDSS患儿的临床表现、实验室及超声心动图特征
Clinical manifestations,laboratory and echocardiographic characteristics of patients with KDSS
| 病例 | 年龄(个月) | 性别 | 典型KD | 白细胞计数(×109/L) | 血红蛋白(g/L) | 血小板计数(×109/L) | 血钠(mmol/L) | ALT/AST(U/L) | 清蛋白(g/L) | B型钠尿肽(ng/L) | 肌钙蛋白I(μg/L) | D-二聚体(μg/L) | 降钙素原(μg/L) | 乳酸脱氢酶(U/L) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 51.0 | 女 | + | 18.05 | 102 | 271 | 132 | 6/43 | 31.6 | 1 207 | 0.07 | 1 301 | 79.19 | 387 |
| 2 | 156.0 | 男 | + | 20.79 | 139 | 200 | 128 | 19/28 | 50.2 | 387 | 7.31 | 453 | 1.50 | 382 |
| 3 | 23.0 | 男 | + | 20.43 | 86 | 69 | 129 | 88/26 | 21.9 | 384 | 0.01 | 1 078 | 6.28 | 312 |
| 4 | 46.0 | 男 | + | 15.48 | 101 | 336 | 130 | 185/107 | 36.5 | 245 | 0 | 1 003 | 7.01 | 300 |
| 5 | 26.0 | 女 | + | 8.26 | 108 | 230 | 135 | 256/97 | 36.9 | 59 | 0 | 858 | 35.72 | 246 |
| 6 | 33.0 | 男 | + | 19.28 | 117 | 376 | 131 | 392/266 | 44.9 | 398 | 0 | 1 242 | 1.50 | 405 |
| 7 | 72.0 | 男 | + | 18.24 | 131 | 181 | 130 | 394/446 | 42.9 | 526 | 0.07 | 822 | 94.74 | 345 |
| 8 | 2.3 | 男 | ? | 19.77 | 81 | 200 | 126 | 20/30 | 31.8 | 5 000 | 0.06 | 321 | 3.44 | 188 |
| 9 | 96.0 | 女 | ? | 16.11 | 119 | 156 | 138 | 10月22日 | 44.7 | 289 | 0.26 | 816 | 1.39 | 226 |
| 10 | 16.0 | 男 | + | 21.35 | 115 | 256 | 137 | 71/28 | 30.4 | 437 | 0.06 | 1 026 | 45.61 | 371 |
| 11 | 61.0 | 男 | + | 12.84 | 105 | 273 | 135 | 65/38 | 29.4 | 252 | 0.03 | 1 856 | 3.50 | 186 |
| 病例 | 冠状动脉 | 神经系统受累 | 胃肠道受累 | 并腮腺大 | IVIG抵抗 | 发病至诊断时间(d) | 入PICU时间(d) | 血管活性药使用时间(d) | 死亡 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 左冠状动脉(mm) | 右冠状动脉(mm) | 呕吐 | 腹部疼痛 | 消化道出血 | 腹泻 | ||||||||
| 1 | 2.1 | 2.0 | - | - | - | + | - | - | - | 4 | 0 | 3 | - |
| 2 | 4.6 | 3.8 | - | + | + | - | - | - | + | 4 | 0 | 3 | - |
| 3 | 3.1 | 2.5 | + | - | - | - | - | - | - | 6 | 3 | 7 | - |
| 4 | 2.2 | 2.0 | - | - | - | - | - | + | - | 4 | 0 | 3 | - |
| 5 | 3.0 | 2.1 | - | + | + | - | - | - | - | 4 | 0 | 3 | - |
| 6 | 2.0 | 2.1 | - | + | + | - | - | - | - | 3 | 0 | 2 | - |
| 7 | 2.0 | 2.2 | + | + | - | + | - | + | + | 4 | 0 | 3 | - |
| 8 | 3.3 | 3.5 | - | + | - | - | + | - | - | 15 | 3 | 7 | - |
| 9 | 3.5 | 3.9 | - | - | + | - | - | + | - | 5 | 0 | 4 | - |
| 10 | 1.9 | 2.0 | - | + | - | - | + | - | - | 3 | 0 | 4 | - |
| 11 | 2.3 | 2.0 | - | - | - | - | - | - | - | 4 | 0 | 3 | - |
注:KDSS:川崎病休克综合征;KD:川崎病;ALT:丙氨酸氨基转移酶;AST:天冬氨酸转氨酶;IVIG:静脉注射丙种球蛋白 KDSS:Kawasaki disease shock syndrome;KD:Kawasaki disease;ALT:alanine aminotransferase;AST:aspartate transaminase;IVIG:intravenous immunoglobulin
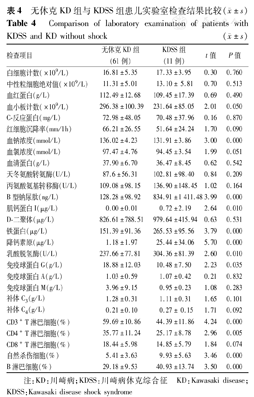
无休克KD组与KDSS组患儿实验室检查结果比较( ±s)
±s)
Comparison of laboratory examination of patients with KDSS and KD without shock( ±s)
±s)
无休克KD组与KDSS组患儿实验室检查结果比较( ±s)
±s)
Comparison of laboratory examination of patients with KDSS and KD without shock( ±s)
±s)
| 检查项目 | 无休克KD组 | |||
|---|---|---|---|---|
| (61例) | KDSS组 | |||
| (11例) | t值 | P值 | ||
| 白细胞计数(×109/L) | 16.81±5.35 | 17.33±3.95 | 0.30 | 0.760 |
| 中性粒细胞绝对值(×109/L) | 11.31±5.01 | 13.10± 5.81 | 0.70 | 0.513 |
| 血红蛋白(g/L) | 112.49±12.68 | 109.45±17.39 | 0.69 | 0.490 |
| 血小板计数(×109/L) | 296.38±100.39 | 231.64±85.05 | 2.01 | 0.050 |
| C-反应蛋白(mg/L) | 72.98±48.05 | 70.48±37.96 | 0.16 | 0.870 |
| 红细胞沉降率(mm/1h) | 66.21±26.55 | 51.64±24.24 | 1.70 | 0.090 |
| 血钠浓度(mmol/L) | 136.02±4.23 | 131.91±3.86 | 3.00 | 0.000 |
| 血氯浓度(mmol/L) | 97.47±4.76 | 94.45±3.54 | 1.99 | 0.051 |
| 血清蛋白(g/L) | 37.90±6.70 | 36.47±8.45 | 0.62 | 0.542 |
| 天冬氨酸转氨酶(U/L) | 87.6±56.31 | 102.81±98.40 | 0.84 | 0.209 |
| 丙氨酸氨基转移酶(U/L) | 109.08±98.15 | 136.90±148.45 | 1.02 | 0.164 |
| B型钠尿肽(ng/L) | 128.28±98.92 | 834.91±1 411.48 | 3.99 | 0.000 |
| 肌钙蛋白I(μg/L) | 0.00±0.01 | 0.72±2.19 | 2.64 | 0.010 |
| D-二聚体(μg/L) | 826.61±788.51 | 979.64±415.94 | 0.63 | 0.531 |
| 铁蛋白(μg/L) | 151.39±91.36 | 265.53±95.56 | 3.79 | 0.000 |
| 降钙素原(μg/L) | 1.18±1.97 | 25.44±34.06 | 5.70 | 0.000 |
| 乳酸脱氢酶(U/L) | 237.66±77.81 | 304.36±81.39 | 2.60 | 0.010 |
| 免疫球蛋白G(g/L) | 18.88±12.03 | 10.48±7.50 | 2.23 | 0.035 |
| 免疫球蛋白A(g/L) | 1.03±0.59 | 1.07±0.42 | 0.21 | 0.832 |
| 免疫球蛋白M(g/L) | 3.96±9.15 | 0.95±0.23 | 1.08 | 0.283 |
| 补体C3(g/L) | 1.28±0.31 | 1.11±0.31 | 1.65 | 0.101 |
| 补体C4(g/L) | 0.21±0.10 | 0.27± 0.15 | 1.71 | 0.092 |
| CD3+ T淋巴细胞(%) | 59.69±10.86 | 44.39±11.86 | 4.24 | 0.000 |
| CD4+ T淋巴细胞(%) | 35.77±11.24 | 25.17±8.78 | 2.96 | 0.005 |
| CD8+ T淋巴细胞(%) | 18.44±5.98 | 14.85±5.79 | 1.84 | 0.074 |
| 自然杀伤细胞(%) | 5.41±3.63 | 9.93±5.63 | 3.46 | 0.000 |
| B淋巴细胞(%) | 29.18±9.53 | 40.93±13.74 | 3.50 | 0.000 |
注:KD:川崎病;KDSS:川崎病休克综合征 KD:Kawasaki disease;KDSS:Kawasaki disease shock syndrome
2组KD患儿均使用丙种球蛋白治疗,除KDSS组1例2.3个月小婴儿于确诊前使用丙种球蛋白(从发热至确诊用时15 d),其余患儿均于确诊后使用丙种球蛋白。KDSS组中出现丙种球蛋白抵抗的比例多于无休克KD组[2/11例(18.2%)比3/61例(4.9%)],但差异无统计学意义(P>0.05)。2例KDSS患儿被转入儿科重症监护病房(PICU)治疗(表3)。KDSS患儿均使用类固醇激素,明显多于无休克KD组[11/11例(100.0%)比1/61例(1.6%)],差异有统计学意义(P<0.05)。KDSS患儿均接受液体复苏,同时接受48~168 (91.62±39.01) h的血管活性药物注入。无一例患儿需机械通气支持。无一例患儿出现脱水或严重体液损失现象。KD患儿预后均可,无一例死亡。
在2组资料比较的基础上,建立Logistic回归模型,将有统计学意义的因素输入数据库,进行多因素分析校正各因素之间的相互混杂影响,显示与KDSS相关的因素包括cTnI [比值比(OR)=4.173,Wald=56.967,95%可信区间(CI):3.071~5.677,P<0.001]、PCT(OR=0.378,Wald=14.738,95%CI:0.240~0.650,P=0.007)、NK细胞(OR=0.053,Wald=6.656,95%CI:0.024~0.078,P=0.008)。
近年来,KDSS受到越来越多的关注,当严重KD伴血流动力学不稳定时,且与IVIG无关时,考虑存在KDSS[3,4,5,12]。KDSS的定义为基于各年龄段的收缩期低血压,收缩压持续下降≥基线的20%或临床有低灌注的表现[2]。KDSS的具体发病机制尚不清楚,可能原因有血管炎产生严重毛细血管渗漏,另外与心脏功能障碍、炎性细胞因子释放等有关[3,13]。KDSS可以是心源性的,也可以是体液分布性或二者相结合的结果[13,14,15]。本研究结果显示,KDSS组患儿的患病率为15.3%(11/72例),国外文献报道患病率为1.9%~7.0%[2,5,6],本研究结果明显高于国外相关研究,可能与本研究样本量少或在诊断上存在主观上的差异有关。国外统计数据显示女性占主导地位,而本研究数据显示男性占主导地位,可能与种族差异有关;另外本研究结果显示年龄上有增大趋势,与国外研究一致[5,6]。
本研究结果发现,KDSS组患儿出现胃肠道症状的比例明显高于无休克KD组,与国外报道一致[6,16,17]。Gatterre等[3]描述了11例KDSS患者,胃肠道表现较为常见:呕吐(9例)、腹泻(2例)、腹腔积液(6例),其中2例由于腹膜炎表现明显行腹腔镜手术,仅发现无菌性腹膜炎,提示一种血管炎现象。本研究中KDSS组11例患儿中呕吐6例(54.5%)、腹痛4例(36.4%)、腹泻2例(18.2%)、胃肠道出血2例(18.2%),但未发现腹腔积液患儿。Nagata等[18]在KD患者的胃肠道中发现产生热休克蛋白细菌,并提出肠道细菌可能与KD发病有关,不同致病细菌的结合会导致免疫激活的共同途径。上述研究及报道均提示胃肠道表现与KDSS之间可能存在一定关联,细菌可能是诱发因素。
本研究还发现KD患儿有较多并发心脏超声异常,其中以冠状动脉扩张和二尖瓣反流多见,冠状动脉扩张占20.8%(15/72例),这一结果比最近文献报告的18.3%的冠状动脉异常略高[19],这可能与临床表现不典型致诊断延迟造成丙种球蛋白应用时间较晚有关,需进一步研究来证实。KDSS组患儿心脏超声异常的比例[10/11例(90.9%)]明显高于无休克KD组[11/61例(18.0%)],冠状动脉扩张及左心室功能不全的发生率均高于无休克KD组,与文献[5,17,18,19,20]报道相似,提示KDSS患儿更易出现心脏超声异常,需加强监测。
严重KD患儿实验室检测仍是重要手段。本研究也证实KDSS患儿存在实验室异常,包括低钠血症和BNP、cTnI、PCT明显增高等。本研究发现KDSS患儿易出现低钠血症,虽然该因素经多因素分析后并不是危险因素之一,但值得临床关注。低钠血症可能与毛细血管渗漏学说有关,而毛细血管渗漏正是KDSS的可能机制之一。尽管KD发现以来,已历经50年的历史[21],但发病机制仍未明确,而冠状动脉异常导致心肌缺血梗死已成为共识[22]。当心肌缺血致心肌细胞受损后,在血液中很快能监测到cTnI,cTnI测定已广泛应用于急性心肌梗死、心肌炎[23]。目前,关于KDSS患儿cTnI显著升高的报道较少,本研究发现,KDSS组cTnI值较无休克KD组明显升高,且经过多因素回归分析后仍显示明显的关联,提示KDSS的发生与心肌损伤有关。另外,BNP水平明显升高提示心功能不全[24]。本研究KDSS组患儿BNP水平明显高于无休克KD组,表现出左心功能不全,与国内报道一致[25,26],提示心源性休克可能参与KDSS的发病。Shulman和Rowley[22]报道的大量流行病学资料提示感染是KD发生的主要原因。PCT与其他急性时相反应物的特征类似,是由于多种炎症(尤其是细菌产物)刺激而产生。本研究KDSS组中PCT较无休克KD组明显升高,推测有感染的因素参与,引起KD进一步发展为KDSS,故PCT可作为一项更好的指标来提示KD的严重性[22,27],对早期发现KDSS提供帮助,也为进一步研究KDSS的发病机制提供线索。
基于最近的研究,免疫机制亦参与KD的发病:高度活性的免疫细胞产生各种细胞因子,导致细胞因子失衡引起内皮细胞损伤[28]。段炤等[29]研究发现KD患者存在明显的细胞免疫及炎性因子紊乱。本研究KDSS组患儿在CD3+T淋巴细胞、CD4+T淋巴细胞、NK细胞和B淋巴细胞上表现出更明显的细胞免疫功能紊乱,不仅证实这一免疫机制学说,更说明机体在严重状态下调动了一系列的炎症瀑布反应,需进一步去检测KDSS时的炎性因子,发掘始动因素及由KD发展成为KDSS的发展因素。有报道称,KDSS患者表现出更明显的IVIG抵抗[2,30]。本研究结果显示,KDSS组2例(18.2%)IVIG抵抗,无休克KD组3例(4.9%)IVIG抵抗,2组如果仅从比例上看确实KDSS组明显增高,但差异无统计学意义,期待大样本验证。部分KDSS患者需被转入重症监护室,反映出并发症的严重程度。因为,KDSS患者出现低灌注、缓慢毛细血管充盈、低血压症状,所以患儿均需液体复苏和血管活性药物。
综上,KDSS是KD的重要并发症。KDSS患儿似乎有更高的发生胃肠道受累及超声心动图异常的概率,需要更多的研究来阐明这一现象的机制。可能与本研究样本量小有关,多因素分析结果仅显示cTnI、PCT、NK细胞为KDSS的相关因素,如临床上遇到低钠血症、BNP异常升高、细胞免疫功能明显紊乱时亦需警惕KDSS。



























