
探讨供者来源CD19嵌合抗原受体T淋巴细胞(CD19 CAR-T)治疗对异基因造血干细胞移植后复发急性B淋巴细胞白血病的疗效及不良反应,分析影响治疗因素。
回顾性分析2015年7月至2017年10月5例在首都医科大学附属北京儿童医院接受供者CD19 CAR-T治疗患儿的治疗及随访资料。总结输注治疗疾病状态、预处理方案、回输细胞剂量及治疗后不良反应和相关免疫学指标变化,并追踪随访治疗结果。
1例患儿对治疗无反应。4例患儿在4周内获得形态学缓解或微小残留病变(MRD)转阴,中位作用时间为14 d。外周血CAR-T细胞高峰出现在回输后2周左右。截至最后随访日期,接受治疗的患儿中死亡2例,存活3例,死亡原因均为原发病进展,存活病例中2例为无病生存,1例为CD19阴性髓外复发后带瘤生存。治疗不良反应主要为细胞因子释放综合征(CRS)反应,通常出现在治疗后1~2周;此外,1例患儿出现中枢神经系统异常,2例患儿出现可疑移植物抗宿主病表现。
供者CD19 CAR-T对移植后复发急性B淋巴细胞白血病有良好的短期效果,长期疗效还需进一步观察;CRS为治疗最常见不良反应;治疗靶点脱失、CAR-T细胞耗竭是导致治疗失败的主要原因。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
白血病复发是急性淋巴细胞白血病移植后主要死亡原因。此类患儿对化疗反应差,供者淋巴细胞输注对急性淋巴细胞白血病效果有限,仅有20%左右有效率,且易引发严重移植物抗宿主病[1]。因此需要有新的针对移植后复发急性淋巴细胞白血病的治疗手段。嵌合抗原受体T淋巴细胞(CAR-T)治疗是全新的治疗难治复发白血病的有效手段,通过在自体T淋巴细胞表面表达肿瘤特异性的基因工程T淋巴细胞受体(TCR)达到对肿瘤细胞特异杀伤的效果[2,3]。首都医科大学附属北京儿童医院自2015年7月开始对5例异基因造血干细胞移植后复发急性B细胞白血病患儿进行CD19 CAR-T细胞治疗,观察供者来源异基因CD19 CAR-T治疗移植后复发急性B细胞白血病患儿的效果和主要不良反应,讨论异基因CAR-T治疗的有效性和安全性,为CAR-T治疗提供新策略。现报道如下。
选择2015年7月至2017年10月在北京儿童医院行异基因造血干细胞移植后复发急性B淋巴细胞白血病患儿5例,其中男3例,女2例;中位年龄7岁(1~13岁)。4例患儿在治疗前为血液学复发,骨髓幼稚细胞中位百分比为64.0%(52.2%~83.0%),1例患儿为免疫学复发,微小残留病(MRD)持续阳性(表1)。所有患儿在接受CD19 CAR-T治疗前均进行供者淋巴细胞输注(DLI),结果无效。所有患儿治疗前均充分告知治疗风险,并取得患儿监护人知情同意,本研究通过医院医学伦理委员批准(批准文号:2017-81)。
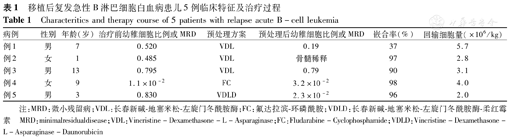
移植后复发急性B淋巴细胞白血病患儿5例临床特征及治疗过程
Characteritics and therapy course of 5 patients with relapse acute B-cell leukemia
移植后复发急性B淋巴细胞白血病患儿5例临床特征及治疗过程
Characteritics and therapy course of 5 patients with relapse acute B-cell leukemia
| 病例 | 性别 | 年龄(岁) | 治疗前幼稚细胞比例或MRD | 预处理方案 | 预处理后幼稚细胞比例或MRD | 嵌合率(%) | 回输细胞量(×106/kg) |
|---|---|---|---|---|---|---|---|
| 例1 | 男 | 7 | 0.520 | VDL | 0.19 | 37 | 5.7 |
| 例2 | 女 | 1 | 0.485 | VDL | 骨髓稀释 | 97 | 2.8 |
| 例3 | 男 | 13 | 0.795 | VDL | 0.79 | 90 | 3.1 |
| 例4 | 女 | 9 | 1.1×10-2 | FC | 3.2×10-2 | 98 | 4.0 |
| 例5 | 男 | 3 | 0.830 | VDLD | 2.3×10-2 | 96 | 2.0 |
注:MRD:微小残留病;VDL:长春新碱-地塞米松-左旋门冬酰胺酶;FC:氟达拉滨-环磷酰胺;VDLD:长春新碱-地塞米松-左旋门冬酰胺酶-柔红霉素 MRD:minimalresidualdisease;VDL:Vincristine-Dexamethasone-L-Asparaginase;FC:Fludarabine-Cyclophosphamide;VDLD:Vincristine-Dexamethasone-L-Asparaginase-Daunorubicin
在治疗前预先采集供者外周血淋巴细胞行CD19 CAR-T细胞制备。血液学复发患儿中3例接受VDL方案预处理化疗,方案组成:地塞米松6 mg/m2第1-14天,1周减停,长春新碱1.5 mg/m2第1、8天,左旋门冬酰胺酶6 000 U/m2隔日1剂,共8剂;1例患儿在VDL基础再上加用2剂柔红霉素(40 mg/m2)。免疫学复发患儿采用FC方案预处理化疗,方案组成为:氟达拉滨(25 mg/m2,3 d)、环磷酰胺(250 mg/m2,3 d)。化疗结束后2~5 d回输供者CD19 CAR-T细胞,输注细胞的中位剂量为3.1×106/kg[(2.0~5.7)×106/kg](表1),回输细胞前复查骨髓、移植嵌合率。回输后监测体温、脉搏、血压、经皮血氧饱和度等生命体征变化,观察不良反应。所有患儿在回输前及回输后0、7、14、21 d行骨髓、细胞因子、生化、凝血、铁蛋白、淋巴细胞亚群、免疫球蛋白检查,外周血CAR-T细胞监测。
细胞因子释放综合征(CRS)和中枢神经系统毒性为CAR-T治疗主要不良反应。其中CRS是CAR-T治疗后最严重的不良反应,根据临床表现分为4级(表2)[4]。1~2级患儿仅给予对症治疗,3~4级患儿在对症治疗基础上加用抗白细胞介素6(IL-6)、肿瘤坏死因子的单抗治疗;神经系统毒性可表现,精神异常、失语、抽搐,有可疑神经系统症状的患儿均完善脑脊液、头颅磁共振等检查排除中枢神经系统感染,同时检测有无脑脊液CAR-T细胞升高,对症处理。此外,每例患儿还着重观察皮疹、腹泻症状及胆红素、肝酶等移植物抗宿主病(GVHD)相关实验室检查指标,对症处理为主,必要时加用糖皮质激素治疗。
2例无病存活患儿定期返院复查,评估原发病状态、脏器功能,带瘤生存患儿以电话方式定期随访。
1例患儿对治疗无反应,其余患儿均在4周内获得形态学缓解或MRD转阴,中位恢复时间为14 d。无治疗反应患儿在输注细胞后1周给予IL-2刺激淋巴细胞增殖,但仍无治疗反应出现。2例患儿在缓解后再次复发,其中1例为治疗后36 d骨髓复发,另1例为治疗后114 d髓外复发,局部活检免疫组织化学提示复发细胞表型为CD19阴性。截至最后随访日期,2例患儿死亡,死亡原因均为原发病进展,3例存活患儿中2例为无病存活,1例为带瘤生存。
4例患儿出现不同程度的CRS反应,3例为1级CRS,以持续发热为主要表现,1例输注前高肿瘤负荷患儿为3级CRS,在高热基础上还出现持续性低血压,经过多巴胺升压,抗IL-6单抗和肿瘤坏死因子受体拮抗剂治疗后恢复。所有诊断CRS患儿均经过病原学、影像学检查排除感染,合并粒细胞缺乏的患儿常规使用抗生素治疗。1例患儿出现中枢神经系统症状,主要表现为精神反应下降,脑脊液检查可见细胞数升高、病原学检查阴性,影像学检查未见异常,脑脊液中可检测到CD19 CAR-T细胞。2例出现皮疹、眼干等可疑GVHD,但未经组织病理学证实(表3)。

CD19CAR-T淋巴细胞治疗移植后复发急性B淋巴细胞白血病患儿不良反应及预后
Side-effect and prognosis of CD19 CAR-T cells in children with recurrent acute B-cell leukemia after transplantation
CD19CAR-T淋巴细胞治疗移植后复发急性B淋巴细胞白血病患儿不良反应及预后
Side-effect and prognosis of CD19 CAR-T cells in children with recurrent acute B-cell leukemia after transplantation
| 病例 | 缓解时间或微小残留病转阴时间 | 不良反应 | 复发时间 | 复发部位 | 接受CAR-T后治疗 | 预后 |
|---|---|---|---|---|---|---|
| 例1 | 未缓解 | 无 | 无 | 死于原发病 | ||
| 例2 | 17 d | 1级CRS,可疑GVHD,中枢神经系统毒性 | 114 d | 髓外 | 对症治疗 | 带瘤生存27个月 |
| 例3 | 24 d | 3级CRS | 36 d | 骨髓 | 对症治疗 | 死于原发病 |
| 例4 | 9 d | 1级CRS | 未复发 | 无 | 无 | 无病存活13个月 |
| 例5 | 11 d | 1级CRS可疑GVHD | 未复发 | 无 | 无 | 无病存活2个月 |
注:CAR-T:嵌合抗原受体T淋巴细胞;CRS:细胞因子释放综合征;GVHD:移植物抗宿主病 CAR-T:chimeric antigen receptor T cell;CRS:cytokine release syndrome;GVHD:graft-versus-host disease
有治疗反应的患儿在治疗后1~2周均出现不同程度的IL-6、肿瘤坏死因子高峰,治疗后1周开始出现外周血B淋巴细胞水平下降(图1A、图1B、图1C)。


注:CAR-T:嵌合抗原受体T淋巴细胞 CAR-T:chimeric antigen receptor T cell
5例患儿中,4例有治疗反应的均在治疗7~10 d出现外周血CAR-T细胞高峰(图1D),其中治疗前幼稚细胞比例最高的3号患儿CAR-T峰值最高,提示CAR-T峰值与输注时肿瘤负荷有一定相关性。无治疗反应患儿体内早期检测不到明显CAR-T细胞增殖,IL-2刺激后有短暂低水平升高,后迅速消失。缓解后早期骨髓复发患儿则在高峰后迅速降低,治疗后36 d外周血已检测不到CAR-T细胞存在,3例存活患儿外周血中均可检测到低水平CAR-T细胞存在,最长维持时间在2年以上。
CAR-T为一种基因修饰T淋巴细胞,通过分子生物学技术在T淋巴细胞表面引入肿瘤特异性的基因工程TCR,从而能特异识别杀灭表达特定抗原的肿瘤细胞。目前针对CD19抗原CART已广泛应用于多种恶性B淋巴细胞疾病治疗。
从本研究治疗结果来看,供者CD19 CAR-T细胞治疗对移植后复发患儿的近期的治疗效果明显,但长期预后还需要进行持续观察。进一步分析3例患儿治疗失败的原因。髓外复发患儿在复发后多次复查骨髓幼稚细胞不高,局部活检免疫组织化学提示复发细胞表型为CD19阴性,且治疗后800 d仍能在外周血检测到低水平CAR-T细胞存在,考虑脱靶为本例患儿复发原因。既往研究报道认为CAR-T治疗脱靶率为10%~20%,关于具体脱靶机制分别有相关研究报道,认为克隆压力选择及CD19分子表达异常是导致治疗靶点脱失的主要原因[5,6]。但由于本患儿为髓外复发,标本取材不便,故未能行进一步检测明确脱靶原因。骨髓复发患儿在CAR-T细胞输注时骨髓幼稚细胞比例高,复发后复查免疫分型提示与治疗前一致,外周血已检测不到CAR-T存在,故考虑为本例患儿复发主要原因为CAR-T细胞耗竭,提示对高肿瘤负荷患儿的CAR-T细胞的治疗剂量应高于低肿瘤负荷患儿。但目前治疗细胞的剂量尚无明确报道。Lee等[7]在2014年报道在儿童患者中CD19 CAR-T细胞治疗的剂量爬坡1期临床试验结果,发现在3×106/kg细胞剂量下,所有患儿耐受良好,未观察严重不良反应发生。因此,对于高瘤负荷患儿提高输注细胞剂量具有可行性,但具体剂量还须进一步的临床研究确定。无治疗反应患儿是在低嵌合状态下采用供者CAR-T细胞治疗,治疗后无明显CAR-T细胞高峰出现,且经过IL-2刺激后仍无明显反应,但具体原因尚不明确。既往研究表明外周血髓系单个核细胞有抑制CAR-T细胞增殖的作用[8],考虑受者的免疫细胞可能对供者来源淋巴细胞有抑制作用,影响输入供者CAR-T细胞功能导致治疗无效可能性大。
CAR-T治疗最主要的不良反应为CRS和中枢神经系统毒性。本研究观察到有临床反应的病例中均有不同程度CRS发生,发生时间均在细胞输注后7~10 d,发生时间与外周血CAR-T细胞和IL-6高峰时间一致,且回输前骨髓幼稚细胞比例最高的患儿CRS程度最重,既往研究认为细胞因子峰值与细胞回输前肿瘤负荷、CAR-T细胞增殖程度具一定相关性,并与CRS严重程度平行[9]。本研究中大部分患儿表现与该研究[9]报道一致。但肿瘤负荷较低的4号患者仍有高细胞因子峰值,且CRS程度不重,考虑存在检验误差可能,需要在今后的工作中进一步验证。仅1例患儿出现神经系统症状,主要表现精神萎靡,脑脊液检查可见单个核白细胞升高,并可检测到CAR-T细胞存在,且神经系统影像检查未见明显异常,经对症治疗后可自行恢复。供者CAR-T治疗后GVHD也是当前供者CAR-T治疗的主要关注点,理论上CAR-T细胞的作用为非主要组织相容性复合体限制性作用,因此不会导致GVHD,但不同临床研究结果却不尽一致。有研究对异基因造血干细胞移植后复发患者行供者CAR-T治疗,未有GVHD发生[10,11]。Dai等[12]报道在7例接受供者CAR-T治疗的患者中有2例出现2~3度GVHD。但本组患儿中有2例出现可疑GVHD表现,未予特殊治疗后可自行缓解。因为所有患儿在进行供者CAR-T细胞治疗前均接受供者淋巴细胞输注治疗,故不能排除输注的供者淋巴细胞诱导产生GVHD的可能,因此尚不能认为供者CAR-T细胞治疗能诱导或加重GVHD。总体而言,本组病例的治疗中尚未发现严重不良反应,无因治疗不良反应导致死亡的病例,因此本研究认为供者CD19 CAR-T细胞治疗总体是安全的,不良反应可控。
从目前已有的研究报道来看,CD19 CAR-T治疗对B淋巴细胞恶性疾病的整体有效率为60%~80%[13]。为进一步提高CAR-T治疗效果,规避脱靶复发风险,已有多个相关研究结果正在进行中。Otáhal等[14]发现来那度胺可提高CAR-T细胞在体内活性,但具体机制尚不明确;Zah等[15]构建针对CD19/CD20双靶点的CAR-T细胞,认为可以有效降低抗原逃逸所导致的治疗无效。Cai等[16]则将CAR-T与半相合微移植结合起来作为预处理一部分,虽然患者最终因放弃治疗而死亡,但为CAR-T更广泛的应用做出了有益探索。这些研究目前大多处于临床前阶段或初期临床试验阶段,距离大规模临床运用还尚需时日。
综上所述,供者CD19 CAR-T对移植后复发B淋巴细胞白血病有良好的短期疗效,且不增加发生GVHD风险。CRS为治疗最常见不良反应,其严重程度与治疗前肿瘤负荷相关,IL-6上升水平能反映CRS的程度。治疗靶点脱失、CAR-T细胞耗竭是常见导致治疗失败的原因。CD19 CAR-T最大安全剂量及脱靶的机制还需要进一步研究明确,以增加CAR-T治疗的长期疗效。
所有作者均声明不存在利益冲突
































