
自身炎症性疾病(autoinflammatory diseases,AIDs)是由基因突变引起其编码蛋白发生改变,造成固有免疫系统失调而引起全身炎症反应的一组疾病。这组疾病以反复或持续的炎症反应为特点(急性时相炎症蛋白升高)、缺乏适应性免疫系统的参与(缺乏自身反应性T淋巴细胞和自身抗体)。AIDs种类繁多,临床表现和发病机制多样,根据其临床特点及发病机制分为不同种类。对于起病年龄小、具有反复发作性的发热和其他全身炎症反应表现及家族史的患儿需考虑到AIDs的可能,明确诊断依赖于病史、临床表现和基因检测结果的综合分析。治疗AIDs的常用药物包括非甾体类抗炎药物、糖皮质激素、免疫抑制剂和生物制剂。早期诊断并积极治疗AIDs可有效减轻全身炎症、缓解脏器损伤、降低远期并发症的发生率。为规范AIDs的诊治,中华医学会儿科学分会风湿病学组等特制定儿童AIDs诊断与治疗专家共识。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
自身炎症性疾病(autoinflammatory diseases,AIDs)是由基因突变引起其编码蛋白发生改变,造成固有免疫系统失调而引起全身炎症反应的一组疾病。近年来,对AIDs的认识逐渐加深,但由于AIDs常表现为多系统受累,临床表现复杂多样,与自身免疫性疾病、感染、肿瘤等疾病鉴别困难,诊断有一定难度;治疗水平远远落后于其他风湿免疫性疾病,导致目前AIDs的治疗方案欠规范。因此,AIDs的早期识别、早期诊断及合理治疗仍然存在巨大挑战。为规范AIDs的诊治,特制定儿童AIDs诊断与治疗专家共识,对AIDs的定义、分类及临床表现、诊断思路、治疗策略、几种主要的AIDs进行阐述,以提高对AIDs这组罕见风湿免疫性疾病的诊断和治疗水平。
最早被认识的AIDs是一组符合孟德尔遗传规律的周期性发热,称为遗传性周期性发热综合征,其特征是不定期或周期性发作性发热伴局部炎症,包括家族性地中海热(familial Mediterranean fever,FMF)、NLRP3相关AIDs(NLRP3-associated autoinflammatory disease,NLRP3-AID)(或冷炎素相关周期性综合征,cryopyrin-associated periodic syndrome,CAPS)、甲羟戊酸激酶缺乏症(mevalonate kinase deficiency,MKD)和肿瘤坏死因子(TNF)受体相关周期性综合征(TNF-receptor associated periodic syndrome,TRAPS)等。目前AIDs已经成为一组涵盖范围非常广泛的疾病谱。广义的AIDs不仅包括40余种单基因疾病,还包括了一些以前被认为是自身免疫性疾病的多基因病,如全身型幼年特发性关节炎(sJIA)、成人Still病、白塞病、克罗恩病和银屑病[1]。2018年国际儿童风湿病试验组织(PRINTO)及AIDs研究组织共同对AIDs的定义做了更新,AIDs是由固有免疫系统缺陷或紊乱引起的一组疾病,这组疾病以反复或持续的炎症反应为特点(急性时相炎症蛋白升高)、缺乏适应性免疫系统的参与(缺乏自身反应性T淋巴细胞和自身抗体)[2]。狭义的AIDs主要是指基因突变引起固有免疫失调的单基因遗传病。本文AIDs是指狭义的疾病。
AIDs种类繁多,临床表现和发病机制多样,目前主要从临床表型和基因突变影响的炎症信号通路两方面对其进行分类。
由于发热和皮疹是AIDs较常见的表现,Almeida de Jesus和Goldbach-Mansky[3]提出了以发热和皮疹特点为依据的疾病分类方法,该分类方法主要将AIDs分为6大类,见表1。

自身炎症性疾病按临床表型的分类
Classification of autoinflammatory diseases by clinical phenotype
自身炎症性疾病按临床表型的分类
Classification of autoinflammatory diseases by clinical phenotype
| 临床表型 | 疾病 | |
|---|---|---|
| 非特异性斑丘疹伴复发性周期性发热和腹痛 | ||
| 短时间内反复发热(典型<7 d) | FMF、HIDS | |
| 持续时间较长的反复发热(典型>7 d) | TRAPS | |
| 嗜中性粒细胞荨麻疹 | ||
| 发热反复发作但持续时间短(通常<24 h) | CAPS/FCAS、CAPS/MWS | |
| 持续发热 | CAPS/CINCA | |
| 肉芽肿样皮肤病变伴低热 | Blau综合征 | |
| 脓疱性皮疹和间歇性发热 | ||
| 伴炎性骨病 | DIRA、Majeed综合征 | |
| 伴化脓性关节炎 | PAPA谱系疾病 | |
| 伴炎症性肠病 | 早发IBD | |
| 伴其他脏器受累 | DITRA、CAMPS | |
| 非典型中性粒细胞性皮肤病,有组织样细胞浸润 | PRAAS | |
| 具有自身炎症和免疫缺陷的综合征 | PLAID、APLAID、HOIL-1缺陷 | |
注:FMF:家族性地中海热;HIDS:高IgD综合征;TRAPS:肿瘤坏死因子受体相关周期性综合征;CAPS/FCAS:冷炎素相关周期性综合征/家族性寒冷性自身炎症综合征;CAPS/MWS:冷炎素相关周期性综合征/穆克勒-韦尔斯综合征;CAPS/CINCA:冷炎素相关周期性综合征/慢性婴儿神经皮肤关节综合征;DIRA:白细胞介素1受体拮抗剂缺乏症;PAPA:化脓性无菌性关节炎-坏疽性脓皮病-痤疮综合征;IBD:炎症性肠病;DITRA:白细胞介素36受体拮抗剂缺乏症;CAMPS:CARD14介导的银屑病;PRAAS:蛋白酶体相关的自身炎症综合征;PLAID:PLCγ-2相关的抗体缺陷和免疫紊乱;APLAID:PLCγ-2相关的自身炎症、抗体缺陷和免疫紊乱;HOIL-1:氧化血红素IRP2泛素连接酶-1 FMF:familial Mediterranean fever;HIDS:hyper immmunoglobulinemia D with periodic fever syndrome;CAPS/FCAS:cryopyrin-associated periodic syndrome/familial cold autoinflammatory syndrome;CAPS/MWS:cryopyrin-associated periodic syndrome/Muckle-Wells syndrome;CAPS/CINCA:cryopyrin-associated periodic syndrome/chronic infantile neurologic cutaneous and articular syndrome;DIRA:deficiency of interleukin-1 receptor antagonist;PAPA:pyogenic sterile arthritis,pyoderma gangrenosum,acne syndrome;IBD:inflammatory bowel disease;DITRA:deficiency of interleukin -36 receptor antagonist;CAMPS:CARD14 mediated psoriasis;PRAAS:proteasome-associated autoinflammatory syndrome;PLAID:phospholipase-Cγ2-associated antibody deficiency and immune dysregulation;APLAID:autoinflammation and phospholipase-Cγ2-associated antibody deficiency and immune dysregulation;HOIL-1:heme-oxidized IRP2 ubiqui-tin ligase-1
也有学者根据发热和脏器受累情况[4]、疾病临床表现和发病机制特点[5]对AIDs进行分类。尽管基于临床表型的分类方法在临床工作中能提供一定参考,但无法完全满足日益更新的AIDs疾病谱诊断的需求。
为深入理解疾病发病机制并精准地指导诊断和治疗,Manthiram等[6]根据参与疾病的主要炎症信号通路将AIDs分为以下几类:炎性小体疾病[也称为白细胞介素(IL)-1信号通路疾病]、干扰素(IFN)信号通路疾病、核因子(NF)-κB信号通路疾病、蛋白折叠障碍疾病、其他细胞因子相关疾病、其他分类不明疾病,各类疾病及相应临床表现见表2。本共识建议临床诊治过程中应用此分类方法,但此分类方法并非绝对,因为各信号通路存在一定的交叉相互影响。

参与自身炎症性疾病发病机制的主要炎症信号通路的分类及各类疾病相应的临床表现
Classification of main inflammatory signaling pathways involved in the pathogenesis of autoinflammatory diseases and clinical manifestations of various diseases
参与自身炎症性疾病发病机制的主要炎症信号通路的分类及各类疾病相应的临床表现
Classification of main inflammatory signaling pathways involved in the pathogenesis of autoinflammatory diseases and clinical manifestations of various diseases
| 疾病 | 遗传方式 | 突变基因 | 临床表现 | |
|---|---|---|---|---|
| IL-1信号通路疾病 | ||||
| CAPS(FCAS、MWS和CINCA) | AD或新发突变 | NLRP3 | FCAS:寒冷诱发的荨麻疹、发热、关节痛 | |
| MWS:发热、皮疹、关节痛、感音神经性耳聋 | ||||
| CINCA:新生儿期起病的发热、无菌性脑膜炎、感音神经性耳聋 | ||||
| FMF | AR | MEFV | 周期性发热、浆膜炎、皮疹、淀粉样变性 | |
| PAAND | AD | MEFV | 发热,脓疱性痤疮,脓皮病,嗜中性粒细胞性皮肤病,关节痛 | |
| NLRC4-MAS | AD | NLRC4 | 反复MAS,肠炎,寒冷诱发的发热和荨麻疹,中枢神经系统炎症 | |
| NAIAD | AD/AR | NLRP1 | 全身炎症,关节炎,角化不良 | |
| HIDS/MKD | AR | MVK | 发热,坏疽,皮疹,淋巴结大,腹痛,呕吐 | |
| PAPA谱系疾病 | AD | PSTPIP1 | 脓皮病,化脓性关节炎,严重的囊肿性痤疮 | |
| APLAID | AD | PLCG2 | 寒冷性荨麻疹,肺间质病变,复发性水疱,关节痛,眼部炎症,小肠结肠炎和抗体缺乏 | |
| PFIT | AR | WDR1 | 周期性发热、免疫缺陷、血小板减少 | |
| Majeed综合征 | AR | LPIN2 | 贫血,骨髓炎,嗜中性粒细胞性皮肤病 | |
| DIRA | AR | IL1RN | 骨炎,脓疱性皮损 | |
| IFN信号通路疾病 | ||||
| PRAAS (CANDLE、NNS和JMP) | AR | PSMB8、PSMB4、PSMA3、PSMB9、POMP | 发热,全身炎症反应,嗜中性粒细胞性皮肤病,肌炎,脂膜炎,基底核钙化 | |
| SAVI | AR | TMEM173 | 血管炎,血栓性微血管病,肺间质疾病 | |
| AGS | AR或AD | TREX1、RNASEH2A、RNASEH2B、RNASEH2C、SAMHD1、ADAR、IFIH1 | 基底核钙化,冻疮样皮疹,长期的认知缺陷 | |
| Singleton-Merten综合征 | AD | DDX58(RIG-I) | 青光眼,骨骼异常,主动脉钙化,银屑病 | |
| SPENCDI | AR | ACP5 | 中轴骨发育不良、颅内钙化和自身免疫性疾病(如溶血性贫血、自身免疫性甲状腺炎或系统性红斑狼疮) | |
| NF-κB信号通路疾病 | ||||
| NLRP12相关疾病 | AD | NLRP12 | 寒冷诱发的发热,皮疹,关节痛,肌痛 | |
| Blau综合征 | AD或新发突变 | NOD2 | 早发结节病,葡萄膜炎,肉芽肿性多关节炎 | |
| CARD14介导的银屑病 | AD | CARD14 | 银屑病,红糠疹,脓疱型银屑病 | |
| HA20 | AD | TNFAIP3 | 发热、口腔和外生殖器溃疡、关节炎、眼部炎症 | |
| ORAS | AR | FAM105B(Otulin) | 发热,嗜中性粒细胞性皮肤病,脂肪营养不良,发育不良 | |
| 蛋白折叠障碍疾病 | ||||
| TRAPS | AD | TNFSRF1A | 长期周期性发热,腹痛,眶周水肿 | |
| 其他细胞因子介导 | ||||
| DITRA | AR | IL36RN | 周期性发热,脓疱性皮疹 | |
| IL-10缺乏症 | AR | IL10、IL10RA、IL10RB | 早发IBD | |
| 其他分类不明确疾病 | ||||
| SIFD | AR | TNRT1 | 铁粒幼细胞贫血,B细胞缺陷,发热,发育延迟 | |
| DADA2 | AR | CECR1 | 早发中风,血管炎(结节性多动脉炎、网状青斑)、免疫缺陷、贫血 | |
注:IL:白细胞介素;CAPS:冷炎素相关周期性综合征;FCAS:家族性寒冷性自身炎症综合征;MWS:穆克勒-韦尔斯综合征;CINCA:慢性婴儿神经皮肤关节综合征;FMF:家族性地中海热;PAAND:与pyrin相关的伴有嗜中性粒细胞性皮肤病的自身炎症性疾病;NLRC4-MAS:NLRC4相关的巨噬细胞活化综合征;NAIAD:伴关节炎和角化不良的NLRP1相关的自身炎症性疾病;HIDS:高IgD综合征;MKD:甲羟戊酸激酶缺乏症;PAPA:化脓性无菌性关节炎-坏疽性脓皮病-痤疮综合征;APLAID:PLCγ-2相关的自身炎症、抗体缺陷和免疫紊乱;PFIT:周期性发热、免疫缺陷和血小板减少;DIRA:白细胞介素1受体拮抗剂缺乏症;IFN:干扰素;PRAAS:蛋白酶体相关的自身炎症综合征;CANDLE:慢性非典型中性粒细胞性皮炎伴脂肪营养不良和发热;NNS:中条-西村综合征;JMP:关节挛缩-肌萎缩-小细胞性贫血-脂膜炎相关脂营养不良;SAVI:婴幼儿起病的STING相关血管病;AGS:Aicardi-Goutieres综合征;SPENCDI:椎体软骨发育不良伴免疫调节失调;NF:核因子;HA20:A20的单倍体不足;ORAS:OTULIN相关的自身炎症性疾病;TRAPS:肿瘤坏死因子受体相关周期性发热综合征;DITRA:IL-36受体拮抗剂缺乏症;SIFD:铁粒细胞性贫血-免疫缺陷-发热-发育迟缓;DADA2:腺苷脱氨酶2缺乏症;AD:常染色体显性遗传;AR:常染色体隐性遗传;MAS:巨噬细胞活化综合征;IBD:炎症性肠病 IL:interleukin;CAPS:cryopyrin-associated periodic syndromes;FCAS:familial cold autoinflammatory syndrome;MWS:Muckle-Wells syndrome;CINCA:chronic infantile neurologic cutaneous and articular syndrome;FMF:familial mediterranean fever;PAAND:pyrin associated autoinflammation and neutrophilic dermatosis;NLRC4-MAS:NLRC4- macrophage activation syndrome;NAIAD:NLRP1-associated autoinflammation with arthritis and dyskeratosis;HIDS:hyper immmunoglobulinemia D with periodic fever syndrome;MKD:mevalonate kinase deficiency;PAPA:pyogenic sterile arthritis,pyoderma gangrenosum acne syndrome;APLAID:autoinflammation and phospholipase-Cγ2-associated antibody deficiency and immune dysregulation;PFIT:periodic fever,immunodeficiency,and thrombocytopenia;DIRA:deficiency of interleukin-1 receptor antagonist;IFN:interferon;PRAAS:proteasome-associated autoinflammatory syndrome:CANDLE:chronic atypical neutrophilic dermatosis with lipodystrophy and elevated temperature;NNS:Nakajo-Nishimura syndrome;JMP:joint contractures,muscle atrophy,microcytic anemia and panniculitis-induced lipodystrophy;SAVI:stimulator of interferon genes associa-ted vasculopathy with onset in infant;AGS:Aicardi-Goutieres syndrome;SPENCDI:spondyloenchondrodysplasia with immune dysregulation;NF:nuclear factor;HA20:A20 haploinsufficiency;ORAS:OTULIN-related autoinflammatory syndrome;TRAPS:tumor necrosis factor receptor-associated periodic syndrome;DITRA:deficiency of interleukin-36 receptor antagonist;SIFD:sideroblastic anemia with immunodeficiency,fevers,and developmental delay;DADA2:deficiency of adenosine deaminase 2;AD:autosomal dominant inheritance;AR:autosomal recessive inheritance;MAS:macrophage activation syndrome;IBD:inflammatory bowel disease
对于小年龄儿童(≤5岁)不明原因反复发热,并伴有以下2项以上者:(1)反复皮疹;(2)关节痛/炎;(3)口腔溃疡;(4)反复胸痛或腹痛;(5)肺间质病变;(6)反复头痛、呕吐、智力减退;(7)结膜炎、虹膜睫状体炎等眼部病变;(8)不明原因耳聋;(9)不明原因肝脾和淋巴结大;(10)炎症指标,如血常规白细胞、中性粒细胞、C反应蛋白(CRP)和红细胞沉降率(ESR)反复升高,在充分排除其他风湿免疫性疾病、感染和肿瘤等后,应考虑AIDs的可能。
对于可疑AIDs的患儿深入挖掘病史对疾病的诊断非常重要。
仔细询问家族史,包括种族、地区、三代以内有血缘关系的家属所患疾病,尤其需要关注与患儿有类似临床表现者、其他炎症性疾病患儿(如炎症性肠病、银屑病等),并绘制家系图。
起病年龄越早越应警惕AIDs。如慢性婴儿神经皮肤关节(chronic infantile neurologic cutaneous and articular,CINCA)综合征患儿往往出生后数天即发病。如果患儿临床表现不典型或起病晚,则需要考虑存在低外显性基因突变或体细胞嵌合突变。
询问热峰、发热持续时间和间隔时间非常重要。例如FMF多数情况下每次发作时间不超过3 d。发作间隔时间在许多AIDs并无特殊规律,但在周期性发热和伴口疮性口炎、咽炎、淋巴结炎(PFAPA)综合征患儿,发作间隔时间大多数非常固定,一般为4周。
皮疹是AIDs常见伴随症状,常见皮疹包括荨麻疹、口腔/外阴溃疡、冻疮样皮疹、鱼鳞病样丘疹、红斑、眶周水肿、脓疱疹、坏疽性脓皮病、网状青斑等。可疑病变应尽量行皮肤活检,以寻找组织病理学改变的证据。
关节肿痛也是AIDs常见伴随症状之一,问诊和查体时应明确关节肿痛的部位,并通过影像学检查明确骨关节病变的范围、性质和严重程度。
AIDs可累及全身多脏器。心、肺和消化道是常见的受累器官。浆膜炎可导致AIDs患儿出现腹痛(腹膜炎)、胸痛(胸膜炎),也可出现心包炎、鞘膜积液等。无菌性胸膜炎和腹膜炎所导致的胸痛、腹痛,最常见于FMF。消化道受累除了无菌性腹膜炎引起的腹痛外,腺苷脱氨酶2缺乏症(deficiency of adenosine deaminase 2,DADA2)引起的腹部血管炎症也可引起剧烈腹痛,需与外科急腹症进行鉴别。
中枢神经系统受累常见于穆克勒-韦尔斯综合征(Muckle-Wells syndrome,MWS)和CINCA综合征,可以有头痛、智力发育迟滞、听力下降等,通过脑脊液、头颅影像学检查和听力筛查可以发现无菌性脑膜炎、脑积水、脑萎缩、感音神经性耳聋等。在IFN信号通路疾病中,中枢神经系统受累主要表现为颅内钙化、癫痫、脑梗死。脑卒中也是DADA2最常见的表现。
眼科检查在AIDs的诊断中尤为重要,需要注意有无葡萄膜炎、结膜炎、巩膜炎、青光眼、视乳头水肿等。
为明确AIDs的诊断,必须追溯和分析患儿发病以来甚至是自出生后开始的化验检查,包括CRP、白细胞、中性粒细胞和ESR。对比发作期与发作间期上述炎症指标的变化,有助于鉴别不同类型的AIDs。
对于临床高度怀疑AIDs的患儿,应尽早行基因检测,将患儿的临床表型和基因测序结果结合分析可以更加高效精准地诊断AIDs。
在除外其他风湿免疫性疾病、感染和肿瘤的情况下,将患儿的病史、临床表现和基因检测结果结合起来方可诊断AIDs[7]。AIDs诊断的流程见图1。
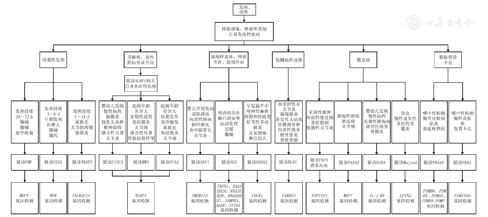

注:FMF:家族性地中海热;HIDS:高IgD综合征;TRAPS:肿瘤坏死因子受体相关周期性发热综合征;CINCA:慢性婴儿神经皮肤关节综合征;MWS:穆克勒-韦尔斯综合征;FCAS:家族性寒冷性自身炎症综合征;SAVI:婴幼儿起病的STING相关血管病;AGS:Aicardi-Goutieres综合征;DADA2:腺苷脱氨酶2缺乏症;BLAU:Blau综合征;PAPA:化脓性无菌性关节炎-坏疽性脓皮病-痤疮综合征;PAAND:与pyrin相关的伴有嗜中性粒细胞性皮肤病的自身炎症性疾病;DIRA:白细胞介素1受体拮抗剂缺乏症;PRAAS:蛋白酶体相关的自身炎症综合征;ORAS:OTULIN相关的自身炎症性疾病 FMF:familial mediterranean fever;HIDS:hyper immmunoglobulinemia D with periodic fever syndrome;TRAPS:tumor necrosis factor receptor-associated periodic syndrome;CINCA:chronic infantile neurologic cutaneous and articular syndrome;MWS:Muckle-Wells syndrome;FCAS:familial cold autoinflammatory syndrome;SAVI:stimulator of interferon genes associated vasculopathy with onset in infant;AGS:Aicardi-Goutieres syndrome;DADA2:deficiency of adenosine deaminase 2;BLAU:Blau syndrome;PAPA:pyogenic sterile arthritis,pyoderma gangrenosum acne syndrome;PAAND:pyrin associated autoinflammation and neutrophilic dermatosis;DIRA:deficiency of interleukin-1 receptor antagonist;PRAAS:proteasome-associated autoinflammatory syndrome;ORAS:OTULIN-related autoinflammatory syndrome
AIDs种类繁多,目前可选的治疗药物包括传统药物和靶向药物,如何早期快速控制炎症、降低致残和致死率依赖于不同药物的合理、规范联合使用。
非甾体类抗炎药物可以改善AIDs患儿的发热和关节症状,对于以发热和关节炎为主要表现的AIDs患儿可作为基础用药,具体用量见表3。
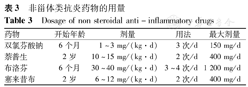
非甾体类抗炎药物的用量
Dosage of non steroidal anti-inflammatory drugs
非甾体类抗炎药物的用量
Dosage of non steroidal anti-inflammatory drugs
| 药物 | 开始年龄 | 剂量 | 用法 | 最大剂量 |
|---|---|---|---|---|
| 双氯芬酸钠 | 6个月 | 1~3 mg/(kg·d) | 3次/d | 150 mg/d |
| 萘普生 | 2岁 | 10~15 mg/(kg·d) | 2次/d | 400 mg/d |
| 布洛芬 | 6个月 | 30~40 mg/(kg·d) | 3~4次/d | 1 200 mg/d |
| 塞来昔布 | 2岁 | 6~12 mg/(kg·d) | 2次/d | 400 mg/d |
糖皮质激素对于控制AIDs患儿的炎症反应有重要作用。其剂量因病情而异,一般泼尼松0.5~2.0 mg/(kg·d),最大剂量为60 mg/d,分次口服,炎症明显的患儿可予甲泼尼龙冲击治疗,剂量为15~30 mg/(kg·d),连用3~5 d,每日最大剂量为1 g。因其不良反应较大,尽量避免长时间、大剂量应用,病情稳定后逐渐减量,具体应用疗程依炎症控制程度而定。
秋水仙碱是治疗FMF的经典药物,不仅可以快速控制发热等症状,还可降低淀粉样变性的发生率。剂量为<5岁,≤0.5 mg/d;5~10岁,0.5~1.0 mg/d;>10岁,1.0~1.5 mg/d。使用时注意胃肠道、神经系统和血液系统等不良反应的发生。
免疫抑制剂的联合使用有助于控制病情,有利于糖皮质激素的减量。甲氨蝶呤、环孢素为最常用的免疫抑制剂,甲氨蝶呤按10~15 mg/(m2·周)口服,最大剂量每周15 mg;环孢素按3~5 mg/(kg·d),最大剂量150 mg/d口服,用药过程中应注意监测血药浓度。对于脏器受累明显的患儿可选择环磷酰胺静脉冲击治疗,肺部病变为主者按300~400 mg/m2,1次/月静脉输注,具体疗程根据病情决定。
沙利度胺具有特异性免疫调节作用,能抑制单核细胞产生TNF,还能协同刺激人T淋巴细胞,辅助T淋巴细胞应答,并可抑制血管的形成和黏附分子的活性。沙利度胺可有效缓解关节症状和控制体温,也可用于AIDs的治疗。一般3岁以上儿童考虑应用,1~2 mg/(kg·d),最大剂量为25 mg/次,3次/d口服。用药过程中需注意监测神经系统的不良反应。
以TNF-α为靶向的生物制剂包括TNF受体抗体融合蛋白(依那西普)、人鼠嵌合TNF单克隆抗体(英夫利昔单抗)及完全人源化的TNF单克隆抗体(阿达木单抗)。依那西普用于治疗TRAPS取得了良好的疗效。英夫利昔单抗也被证实对TRAPS和Blau综合征有较好的治疗作用,剂量为3~5 mg/次,每4~6周应用1次,用药间隔时间视病情而定。
IL-1β活化途径的靶向治疗是AIDs有效的治疗手段。国外目前IL-1β拮抗剂主要包括阿那白滞素、列洛西普、卡那单抗和格沃吉珠单抗,具体作用机制及剂量见表4。阿那白滞素可用于治疗秋水仙碱无效的FMF、高IgD综合征(HIDS),也有治疗NLRP3-AID成功的病例,对TRAPS、Blau综合征、化脓性无菌性关节炎-坏疽性脓皮病-痤疮(pyogenic arthritis,pyoderma gangrenosum and acne,PAPA)综合征和IL-1受体拮抗剂缺乏症(DIRA)等也有治疗作用。列洛西普于2009年被美国食品药品监督管理局批准用于4岁以上家族性寒冷性自身炎症综合征(familial cold autoinfla-mmatory syndrome,FCAS)和MWS患儿。卡那单抗用于治疗NLRP3-AID有良好的效果。格沃吉珠单抗主要用于治疗FCAS和MWS患儿。
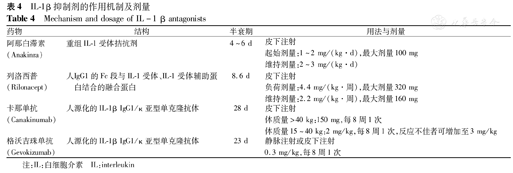
IL-1β抑制剂的作用机制及剂量
Mechanism and dosage of IL-1 β antagonists
IL-1β抑制剂的作用机制及剂量
Mechanism and dosage of IL-1 β antagonists
| 药物 | 结构 | 半衰期 | 用法与剂量 |
|---|---|---|---|
| 阿那白滞素(Anakinra) | 重组IL-1受体拮抗剂 | 4~6 d | 皮下注射 |
| 起始剂量:1~2 mg/(kg·d),最大剂量100 mg | |||
| 维持剂量:2~3 mg/(kg·d) | |||
| 列洛西普(Rilonacept) | 人IgG1的Fc段与IL-1受体、IL-1受体辅助蛋白结合的融合蛋白 | 8.6 d | 皮下注射 |
| 负荷剂量:4.4 mg/(kg·周),最大剂量320 mg | |||
| 维持剂量:2.2 mg/(kg·周),最大剂量160 mg | |||
| 卡那单抗(Canakinumab) | 人源化的IL-1β IgG1/κ亚型单克隆抗体 | 28 d | 皮下注射 |
| 体质量>40 kg:150 mg,每8周1次 | |||
| 体质量15~40 kg:2 mg/kg,每8周1次,反应不佳者可增加至3 mg/kg | |||
| 格沃吉珠单抗(Gevokizumab) | 人源化的IL-1β IgG1/κ亚型单克隆抗体 | 23 d | 静脉注射或皮下注射 |
| 0.3 mg/kg,每8周1次 |
注:IL:白细胞介素 IL:interleukin
人源型抗人IL-6受体的单克隆抗体(托珠单抗)用于部分AIDs有一定疗效,可有效控制全身炎症和关节症状,有研究表明其用于治疗MWS有良好的效果。托珠单抗为静脉滴注给药,8~12 mg/(kg·次),每2~4周1次。
AIDs种类繁多,临床表现复杂多样,下面就几种主要的AIDs进行介绍。
NLRP3-AID又称为CAPS,是一组罕见的常染色体显性遗传AIDs,包括FCAS、MWS及新生儿起病的多系统炎性疾病(neonatal-onset multisystem inflammatory disease,NOMID)/CINCA综合征3种表型。
NLRP3-AID与NLRP3基因突变相关,NLRP3基因定位于lq44,编码NLRP3(又称冷炎素,cryopyrin),是NLRP3炎性小体的关键组分,可激活半胱氨酸蛋白酶1,形成活化的NLRP3-炎症小体,切割IL-1β前体生成有活性的IL-1β,介导炎症反应。NLRP3基因突变可导致NLRP3-炎症小体过度活化,IL-1β异常产生。IL-1β是体内主要的内源性致热源,亦可诱导滑膜细胞和软骨细胞产生胶原酶及金属蛋白酶,导致全身及骨关节症状。
迄今已发现170多种基因突变与NLRP3-AID有关[10],均位于NACHT结构域第3外显子。目前仍未完全清楚NLRP3-AID基因型与表型的关系,将本病按轻(FACS)、中(MWS)、重(CINCA综合征)分组,注意到轻重组间基因型很少有重叠。CINCA综合征多与Y570C、F309S或F523L位点突变有关,重叠仅发生在相邻两组间,如R260W和V198M位点突变见于MWS和FACS,T348M发生在重型MWS和轻型CINCA综合征,D303N主要见于中重度CINCA综合征[11]。
FCAS患儿多于出生后6个月内发病,症状通常在24 h内自行缓解,次日复发,持续终生。症状发生于暴露寒冷环境后数小时内,主要包括发热、皮疹、关节痛,皮疹通常从暴露的肢端开始出现,大多数发作时会发展至全身的其他部位,包括红色斑疹、斑块、荨麻疹样皮损,有时会出现瘀斑,并可产生一种烧灼感或痒感。多数患儿出现关节痛,最常累及手、膝及踝关节,但也可以累及足、腕及肘关节,未发现明显的关节炎。大多数患儿在发热时出现结膜炎,还可出现头痛、嗜睡、肌肉酸痛、乏力、多汗等全身非特异性症状。重症患儿可出现肾脏淀粉样变,常为致死原因。
MWS常于婴幼儿期起病,首发症状为周期发作性非瘙痒性荨麻疹,皮疹可由寒冷诱发,伴低热、关节痛、荨麻疹、结膜炎、头痛、乏力、肌痛和腹痛等症状。炎症发作通常持续24~48 h。至青少年期,出现进行性感音神经性耳聋症状。成年期患儿可继发系统性淀粉样变,累及肾脏时预后不佳。其他常见临床表现包括口腔、外阴溃疡,胱氨酸尿症,鱼鳞病和显微镜下血尿。部分患儿可有特殊面容,表现为凸额、鞍鼻,还可出现身材矮小和弓形足。
CINCA综合征出生后即可发病。弛张热至少持续2周为该病的特点。约50%的患儿为足月小样儿。皮疹、关节炎和神经系统症状是其典型三联征。皮疹见于所有患儿,多在出生时出现,为无瘙痒移行性荨麻疹,这些皮疹在一昼夜内就可变形。关节症状可为关节痛、关节肿胀、关节积液,严重病例可出现关节明显畸形。神经系统受累表现为头痛、癫痫、短暂偏瘫、腿部肌肉痉挛,可出现慢性脑(脊)膜炎、脑萎缩、脑积水、视乳头水肿和感音神经性耳聋,部分患儿随着病程延长可有智商下降。眼部受累可出现进行性视力下降,严重患儿可出现失明。此外,患儿常有凸额、塌鼻样特殊面容,身材矮小和声音嘶哑,亦可出现肝脾大和淋巴结大[12]。少数患儿可继发淀粉样变性。
血小板增多和急性时相炎症蛋白升高。皮疹的活检显示血管周围有明显的中性粒细胞浸润,与典型过敏性荨麻疹中的淋巴细胞和嗜酸性粒细胞浸润不同。慢性脑膜炎患儿的脑脊液可能显示颅压升高、中性粒细胞增多和蛋白升高。长骨的X线片可以显示骨骺病变。
对于反复出现不明原因发热和/或荨麻疹皮疹的患儿,尤其是有阳性家族史的患儿,应怀疑NLRP3-AID的诊断。基因检测是一种有价值的辅助检查手段,但50%的患儿缺乏NLRP3基因突变的证据,因此NLRP3-AID的诊断主要依据临床表现。
FMF是最常见的AID,以反复发作性发热和浆膜炎为主要特征。多见于犹太人、阿拉伯人、亚美尼亚人、土耳其人和意大利人后裔,亚洲人群也有报道。
通常认为FMF属于常染色体隐性遗传性疾病,约30%的患儿为常染色体显性遗传。位于16号染色体的MEFV是FMF唯一已知致病基因。MEFV基因编码一种由781个氨基酸组成的蛋白质,称为炎素(pyrin),后者在宿主防御细菌过程中发挥重要作用。在FMF患儿中,MEFV基因突变导致即使在没有外部触发因素的情况下也会产生炎素,促使NLRP3炎性小体形成,进而导致IL-1β和其他炎症介质的分泌,最终导致FMF发作。
FMF特征为发作不规律,患儿在两次发作间期可无症状。发作频率也有很大变化。发病间隔不规律,从1周到数月或数年不等。剧烈运动、情绪压力、间发性感染、寒冷暴露、手术等与一些患儿的发作有关。
发热可能是FMF首发也是唯一的症状,尤其是年幼儿童。几乎所有病例在发作期间都有此表现。轻微的发作可能伴随低热,但大多数FMF患儿的体温可达38~40 ℃。发热的持续时间短,持续12 h~3 d。
95%的FMF患儿有阵发性腹痛。腹痛最初可能是局限的,然后范围逐渐扩大。由于腹痛的原因是腹膜炎症,常出现腹膜炎的体征,如压痛、反跳痛、板状腹,这些表现可能被误认为是外科急腹症而导致诊断延迟,有时甚至导致误行手术治疗。
33%~84%的患儿疼痛性发作局限于胸部,胸痛可能是由胸膜炎症引起,也可能是由膈下炎症引起的牵涉痛所致。胸膜炎症通常表现为单侧胸痛,随着吸气或咳嗽加重。患儿常有少量的一过性胸腔积液。发作常在3 d内缓解,但也可能持续1周。出现胸膜炎的患儿也可能会伴心包炎。
约75%的患儿会有突然发作的关节疼痛,常为单个大关节受累。症状和体征在发作后的24~48 h达到峰值,此后逐渐消失。关节炎通常完全消失而不会导致关节破坏。然而,重度迁延性病例可发生永久性畸形、功能受限。关节炎偶尔可持续数周到数月。
12%~40%的FMF患儿有丹毒样皮肤损害,可有疼痛、隆起和红斑,病灶通常发生于小腿、踝或足部。病变可能是一过性皮温升高,不伴相关疼痛或压痛。丹毒样皮损可能是儿童FMF的起病特征,可能被误诊为感染性丹毒或蜂窝织炎。
肾脏淀粉样变性可以是FMF患儿的首发表现。肾脏淀粉样变性患儿可表现为无症状蛋白尿或临床上明显的肾病综合征,这些患儿可逐渐发生进行性肾病和终末期肾病。运动诱导的肌痛是FMF的一种典型表现,常累及下肢(大腿和小腿)。极少数患儿会出现症状性急性心包炎,心包炎的临床特征包括胸痛、心包摩擦音和心电图上广泛的ST段抬高。可出现轻微头痛及无菌性脑膜炎表现。少数患儿可出现单侧阴囊肿胀表现。
急性FMF发作期,可出现以中性粒细胞为主的白细胞增多,急性时相炎症蛋白升高,如ESR、CRP、血清淀粉样蛋白A(serum amyloid A,SAA)和纤维蛋白原升高。尿液分析结果可见血尿或蛋白尿。发作间期炎性指标可降至正常。
FMF的诊断主要基于临床表现,在临床经验有限的情况下,基因检测有辅助作用,还可用于排除其他遗传性周期性发热综合征。MEFV基因纯合或复合杂合突变有助于确诊FMF,但MEFV基因杂合突变或未发现明确突变也不能排除诊断。目前成人风湿科医师最广泛使用的临床诊断标准是1997年以色列Tel Hashomer医疗中心提出的标准[13],其特异性和敏感性均达95%以上。有学者在Tel Hashomer诊断标准基础上,总结出适合儿童FMF的新诊断标准[14],见表5,满足5项中的2项以上即可诊断。

儿童家族性地中海热的诊断标准
Diagnostic criteria of familial Mediterranean fever in children
儿童家族性地中海热的诊断标准
Diagnostic criteria of familial Mediterranean fever in children
| 临床症状 | 临床体征 |
|---|---|
| 发热 | 持续时间为6~72 h,体温>38 ℃,发作次数≥3次 |
| 腹痛 | 持续时间为6~72 h,发作次数≥3次 |
| 胸痛 | 持续时间为6~72 h,发作次数≥3次 |
| 关节炎 | 持续时间为6~72 h,发作次数≥3次,单关节炎 |
| FMF家族史 | 阳性 |
注:FMF:家族性地中海热 FMF:familial Mediterranean fever
PAPA综合征原名化脓性关节炎综合征、坏疽性脓皮病和痤疮,于1997年由Lindor等[15]首次报道。好发于5岁以下儿童。PAPA综合征是一种非常罕见的常染色体显性遗传病,由脯氨酸/丝氨酸/苏氨酸磷脂酶反应蛋白1(proline-serine-threonine phosphatase-interacting protein 1,PSTPIP1)基因突变所致。
PSTPIP1定位于染色体15q24-25.1,所编码的CD2结合蛋白1(CD2BP1)能与Pyrin结合。脯氨酸-谷氨酸-丝氨酸-苏氨酸(PEST)型的酪氨酸磷脂酶(PTP-PEST)能催化CD2BP1去磷酸化,松解CD2BP1与Pyrin的结合,增强Pyrin的负性调节作用。PSTPIP1基因突变(163 E250K、E250Q)可致CD2BP1的过度磷酸化,增强Pyrin-CD2BP1的结合,干扰Pyrin对NALP3炎症小体的负性抑制作用,导致IL-1过度产生,从而引起PAPA综合征。
PAPA综合征表现为反复发作的关节及皮肤炎症。关节病变常先于皮肤损害,关节炎常累及肘、膝、踝等部位。儿童早期的关节炎,可为自发性或表现为外伤后轻微疼痛,偶尔可出现严重的关节破坏。关节积液呈浆液脓性或血性,关节腔积液细菌培养阴性。关节炎不能自行消退,需糖皮质激素治疗或外科引流。关节炎反复发作会出现关节肿痛、皮温升高,甚至关节强直。
皮肤损害主要表现为反复发作的无菌性糜烂,随着患儿进入青春期,皮肤受累可能占主导地位。另一个重要临床表现为囊性痤疮,该症状可以从儿童期持续到成年期;青春期最明显。本病可因磺胺过敏引起骨髓抑制,也可以出现注射部位脓肿、糖尿病及肾小球肾炎的临床表现。
全血细胞减少,炎性指标如中性粒细胞、ESR和CRP升高,轻至中度贫血,并脾功能亢进时可伴血小板减少。促炎性血清MRP8和MRP14复合物(S100A8/S100A9或钙卫蛋白)的浓度显著升高。
关节积液病原学检测为阴性;反复慢性病病程的患儿,关节X线片表现为关节间隙变窄、骨赘形成、关节强直等。
目前针对该病尚无统一诊断标准,根据临床症状,如关节炎、坏疽性脓皮病及囊性痤疮,同时结合辅助检查特点,可疑诊该病。通过基因检测,发现PSTPIP1基因位点变异为诊断该病的确诊依据。
SAVI是一种呈常染色体显性遗传的AIDs,为Ⅰ型IFN通路疾病。2014年Liu等[16]研究人员首次于N Engl J Med杂志对6例SAVI患儿进行报道,其主要临床特点为全身炎症反应显著,ESR和CRP明显增高,重度皮肤血管病变导致广泛组织损害,尤其是肺纤维化和严重的间质性肺部疾病。
SAVI是由于TMEM173基因功能性突变引起。TMEM173编码的STING是一种连接病原(病毒和细菌)DNA与产生Ⅰ型IFN的信号转导过程的衔接分子,同时也是固有免疫应答的组成部分。TMEM173基因功能获得性突变进一步导致STING激活和Ⅰ型IFN上调,与IFN受体结合后经过JAK-STAT信号通路进一步刺激包括STING在内的基因高表达,循环往复,即可产生炎症风暴,既能引起发热、贫血、关节炎等全身表现,又会对STING基因高表达的组织造成持久破坏,从而引起早发的系统性炎症、皮肤血管病变及肺部炎症。
发热是该病的最主要且早期出现的表现,通常在出生后几个月即可出现,最早报道可在出生后1周内发病,伴炎性指标升高。
绝大多数患儿会出现不同程度的皮肤损伤,包括毛细血管扩张、脓疱或水疱性皮疹。皮损更容易出现在寒冷敏感的肢端区域,包括脸颊、鼻尖、手指、脚趾、足底等部位的紫罗兰色斑块和/或结节以及远端溃疡。严重者随寒冷天气恶化可延伸到耳郭和四肢分散的部位,并进展为疼痛的溃疡性病变,伴结痂甚至出现坏疽指(趾),严重者可能需要手术截肢。部分患儿可出现指甲营养不良。部分患儿可能出现网状青斑、雷诺现象等。小血管闭塞可能导致耳软骨瘢痕及鼻中隔穿孔。也有报道患儿可出现血栓性微血管病[17]。
肺部受累是该病的重要特征,进行性间质性肺纤维化及相关的肺动脉高压是致死的重要病因,但不同患儿肺纤维化程度不同。
部分患儿可能伴有肌炎、关节炎和关节痛,还有病例报道有坏死性筋膜炎,但不同患儿临床表现个体差异较大。
血常规可见白细胞升高、贫血等,炎性指标(ESR、CRP)可明显升高。出现多种自身抗体阳性,如类风湿因子、抗核抗体、抗中性粒细胞胞质抗体、抗心磷脂抗体和狼疮抗凝集物等。胸部CT(或高分辨CT)可见肺间质纤维化,可并肺大泡、肺气肿、肺动脉高压等,肺组织活检可见肺泡腔扩张,肺泡间隔增宽,纤维组织增生,厚壁畸形血管等表现。超声心动图有助于发现肺动脉高压并评估心脏功能。TMEM173基因突变位点检测有助于确诊本病。
本病尚无统一的诊断标准,当患儿幼年起病,表现为发热、反复干咳、冻疮样皮疹或毛细血管扩张、间质性肺病,伴炎症指标升高时,应高度怀疑本病,需进一步完善TMEM173基因检测。
AGS是最早报道的IFN信号通路疾病,于1984年由Aicardi和Goutières首先提出,是一种罕见的以脑白质受累为主的遗传性脑病,其典型的临床表现包括严重的智力运动发育落后或倒退、锥体束及锥体外系症状和体征、癫痫、小头畸形及冻疮样皮疹,还可出现血细胞减少、肝酶升高、甲状腺功能异常等多种临床表现。AGS临床表型及基因型复杂。
根据基因突变类型AGS可分为7型,即AGS 1型(TREX1基因)、AGS 2型(RNASEH2B基因)、AGS 3型(RNASEH2C基因)、AGS 4型(RNASEH2A基因)、AGS 5型(SAMHD1基因)、AGS 6型(ADAR1基因)和AGS7型(IFIH1基因)。在AGS 7个致病基因中,TREX1和RNASEH2B最常见,各约占38%、23%,而RNASEH2A约占6%。AGS6型通过中和内源性反转录病毒产生RNA的能力受损而致病。新发现的AGS7型是由IFN诱导的螺旋酶C结构域包含蛋白1突变所致,其编码蛋白黑色素瘤分化相关蛋白5(MDA5)。
宫内发育迟缓,间断发热伴炎症指标升高,生长缓慢。
大多数AGS患儿出生时或1岁以内即出现严重的神经功能障碍,表现为喂养困难、小头畸形、眼球震颤、肢体痉挛和肌张力障碍、不同程度精神运动发育迟缓或呈倒退性改变、智力障碍、癫痫、脑萎缩、脑白质营养不良及颅内钙化等;少部分可出现脱髓鞘性周围神经病变。极少患儿亦可表现为智力及运动发育正常。
约40%的患儿手、足或耳朵部位可出现冻疮样皮疹,少部分还可有特应性皮炎、皮肤血管炎改变。皮肤病理显示免疫复合物和补体沉积于血管壁。
可有溶血性贫血、血小板减少症、白细胞数量正常或减少,其中约33%的TREX1基因缺陷相关性AGS在新生儿期即出现血小板减少症伴肝脾大及转氨酶升高。
极少数可出现Crohn病、萎缩性胃炎、乳糜泻、非特异性结肠炎或自身免疫性肝炎等。
可表现为肾病综合征及慢性肾损害等。
可见新生儿呼吸窘迫综合征及由神经系统后遗症所致的反复呼吸道感染。
婴儿期起病肥厚性心肌病(3.3%)或自身免疫性心肌炎,见于TREX1基因突变。
极少数患儿可出现关节疼痛、肿胀、变形、滑膜积液及滑膜增厚,为非破坏慢性关节病,由SAMHD1基因突变所致。
极少数患儿可出现甲状腺功能减低(约3.9%)、糖尿病(约1.4%)、甲状旁腺功能亢进症或生长激素缺乏症。
部分患儿可出现青光眼,多由SAMHD1基因突变所致。
系统性红斑狼疮、抗磷脂综合征或脂膜炎等。
血常规可见白细胞升高、贫血等,炎性指标如ESR、CRP可升高。头颅影像学检查和基因检测有助于明确诊断。
Blau综合征即儿童肉芽肿性关节炎,是一种常染色体显性遗传性疾病。该病的典型临床表现为肉芽肿性多关节炎、眼葡萄膜炎和皮肤肉芽肿性炎症三联征,进行性加重,可能导致严重的并发症,如失明和关节破坏。一般于出生后早期发病,典型的发病年龄为5岁前。
Blau综合征致病基因为定位于染色体16q12的CARD15/ NOD2基因的第4外显子。单个位点突变即可致病,目前已发现的突变位点有R334W、R334Q、C495R、G481D、M513T、R587C、R334L、E383D、R471C、C495R,这些突变位点可引起编码细胞受体蛋白发生不可逆改变,导致NF-кB炎症调节发生改变,最终导致一系列自身炎症反应发生。
是本病早期最突出的临床表现,一般于出生后早期出现,皮疹的特点是细碎的鳞屑样皮疹,粉红色或棕褐色的丘疹样皮疹,常见于背部和四肢。也可表现为鱼鳞病样皮损、皮肤红斑、皮肤结节、毛细血管扩张等[21]。肉芽肿性改变是皮肤组织病理学检查的特征性表现。
于皮疹后不久或与皮疹同时出现,皮疹和肉芽肿性关节炎常早于眼部病变出现。常为无痛性关节炎,表现为对称性多关节炎,大小关节均可受累,常累及双肘关节、双腕关节、双膝关节和双踝关节,跖趾关节、掌指关节,指间关节也可受累。少数患儿可发生脊柱受累[22],有文献报道有患儿发生骶髂关节受累[23]。关节炎表现为滑膜炎、腱鞘炎,滑膜明显增生,表现为特征性的无痛性"囊样"增生改变。如未及时早期诊治,可能发生关节挛缩。
常为双侧,临床表现多样,包括白内障、青光眼、视网膜剥离、带状睫状体病等。患儿可表现为畏光、眼痛、视力不清、视物模糊等。如未积极治疗可进展为全葡萄膜炎,严重者可致失明。
本病除典型的三联征外,半数患儿伴间断发热,部分患儿有多发性大动脉炎、间质性肉芽肿性肾炎、肝脾肉芽肿病变等全身多个脏器受累,少数患儿可并骨软骨瘤。也有报道出现中枢神经系统受累的临床表现[24]。
血常规可出现轻度贫血,白细胞及血小板升高,急性时相炎症蛋白ESR和CRP可升高,纤维蛋白原也可升高。所有患儿自身抗体均为阴性。胸片检查肺门淋巴结无肿大。关节B超显示腱鞘增厚,滑膜明显增生,关节液增多或囊性包块。关节X线片显示骨质疏松,但很少提示骨破坏及关节间隙狭窄。皮肤或滑膜病理学检查提示非干酪性肉芽肿改变。
Blau综合征的诊断主要依据典型的临床三联征,家族遗传史、皮肤或关节滑膜病理活检及基因检测有助于明确诊断。组织病理学改变可见到滑膜增生,非干酪性改变的巨细胞肉芽肿。
家族性Behcet样自身炎症反应综合征又称A20单倍剂量不足(A20 haploinsufficiency,HA20),是由TNF-α诱导蛋白3(tumor necrosis factor α-induced protein 3,TNFAIP3)基因功能突变导致的一种罕见的早发性AIDs,为常染色体显性遗传性疾病。HA20多于儿童早期起病,无种族特异性,男女比例约为1∶2。
A20是炎症反应的负调节因子,由6号染色体上TNFAIP3编码的790个氨基酸组成,包括1个N末端OTU结构域和1个含7个锌指结构域的C末端OTU结构域。其中OTU结构域具有去泛素(deubiquitination)和泛素化(ubiquitination)双重作用,能够水解与63位赖氨酸连接的泛素链(K63 linkages),也可以连接48位赖氨酸连接的泛素链(K48 linkages)。TNFAIP3功能丧失型突变导致A20功能不全,会阻碍聚泛素链的激活和释放,从而使IκB蛋白在IκB激酶复合体的作用之下快速发生磷酸化修饰,被磷酸化修饰的IκB蛋白继而发生多泛素化修饰,并被26S蛋白酶体降解,从而释放NF-κB,NF-κB得以进入细胞核内,激活一系列促炎因子基因的转录,同时使炎性小体活性增加,导致炎性因子(IL-1、IL-6、IL-18、TNF-α)的过度表达[25]。
HA20患儿的临床表现主要包括反复口腔和/或外阴溃疡,眼部受累(前葡萄膜炎、脉络丛视网膜瘢痕,视网膜血管炎引发黄斑纤维化而导致视力丧失),消化道表现(腹痛、呕吐、腹泻、腹腔淋巴水肿、小肠肿胀),反复发热,皮疹,关节炎[26]。部分患儿也会出现心血管疾病、肾病综合征、血管炎、呼吸道感染等,表现出自身炎症及自身免疫性疾病的特点。
TNFAIP3基因不同位点突变,其临床表型不同,同一突变位点不同家族成员间临床表型也可能不同。
HA20尚无特异性实验室检查。在急性期CRP、ESR等炎症指标增高,在发作间歇期,炎症指标可恢复正常。但在某些未经治疗的患儿体内,炎症指标可持续增高。
部分患儿可检测到自身抗体,如抗核抗体、抗双链DNA抗体等。HA20患儿皮肤或黏膜组织病理活检可见非特异性慢性炎症表现。人类白细胞抗原(HLA)-B51被认为与家族性白塞病高度相关,部分患儿体内也可有HLA-B51阳性。
HA20尚无确切的诊断标准。当患儿有复发性口腔溃疡、生殖器溃疡、胃肠道溃疡等类白塞病临床特点,发病年龄小,有阳性家族史时,需要警惕HA20。诊断性全外显子测序可帮助筛选突变基因,同时排除其他遗传性AIDs。发现TNFAIP3基因杂合性功能突变进一步支持该病诊断。
DADA2于2014年被首次报道[27],是由腺苷脱氨酶2(ADA2)基因发生功能缺失性突变所致的一种常染色体隐性遗传性疾病。多于儿童期起病,典型临床表现包括网状青斑、全身炎症、结节性多动脉炎、早发脑卒中、低丙种球蛋白血症和血细胞减少等。可出现多系统受累。
DADA2因ADA2基因发生功能缺失性突变,造成ADA2水平下降所致。ADA2由单核细胞和髓系细胞产生,包含4个结构:信号多肽、受体结合域、二聚体形成结构域和催化功能结构域。ADA2主要在血浆中表达,作用于T淋巴细胞、B淋巴细胞和单核细胞表面的受体,同时作为一种生长因子,在维持内皮细胞完整性、促炎和抗炎巨噬细胞之间的平衡调节方面发挥重要作用。目前发现的CECR1突变位点多为纯合或复合杂和突变。已发现突变位点多达60余个,常见突变位点包括G47R、R169Q、Y453C、G47A、T360A和G358R等。CECR1基因的突变类型及ADA2的活性水平对DADA2疾病临床表型产生重要影响。
约80%的患儿起病年龄在10岁以前,但也有成年起病的个例报道。该病临床表现个体差异较大,从仅有的皮肤表现到致命性的血管炎相关临床事件均可发生。该疾病血管病变主要累及中小动脉,皮肤和中枢神经系统是最常见受累器官,其他受累器官包括胃肠道、肝脏、肾脏和冠状动脉。
可出现发热、关节痛、关节炎和肌无力。
是该疾病最常见临床表现,可见网状青斑、皮肤结节性多动脉炎、指端坏疽、皮下结节、雷诺现象和阿弗他溃疡等。
神经系统表现包括缺血性卒中、出血性卒中、颅神经麻痹和周围神经病变。缺血性卒中最常见,可反复发作,常发生在脑干、丘脑、基底神经核和内囊等部位[28],小腔隙性梗死影像学不易发现,严重卒中可导致永久性的神经损伤,如构音障碍、共济失调、颅神经麻痹、认知障碍等,甚至死亡[29]。出血性卒中发生率仅次于缺血性卒中,颅内出血常发生在应用抗凝剂或抗血小板聚集药物治疗后,部分DADA2患儿颅内出血缺乏血管炎证据,有效全身抗炎治疗后仍发生颅内出血。DADA2患儿常见的颅神经麻痹有动眼神经(Ⅲ)、滑车神经(Ⅳ)、外展神经(Ⅵ)和面神经(Ⅶ)麻痹,主要表现为神经性耳聋和视力丧失、视网膜中央动脉阻塞、视神经萎缩、葡萄膜炎、复视、眼球震颤、斜视等眼科并发症。外周神经病变见于多数DADA2患儿,痉挛性截瘫也有报道[30]。
20%左右的患儿可出现持续低丙种球蛋白血症,记忆B淋巴细胞、成熟B淋巴细胞数目下降。合并感染的病原以病毒和细菌更为多见。
淋巴组织增生是DADA2的另一突出临床表现,约29%的患儿出现脾大,19%的患儿出现肝大,9%的患儿出现淋巴结增大,需注意与恶性肿瘤及淋巴增殖性疾病,如Castleman病相鉴别。
在一些患儿中,血细胞减少是该病的首发或重要伴随症状。部分患儿以先天性纯红细胞再生障碍性贫血起病。约7%和6%的DADA2患儿分别出现中性粒细胞和血小板减少。部分患儿可不伴有任何血管病变,仅表现为血液系统受累。
DADA2血管炎表现可累及肝脏、肾脏和胃肠道等多个器官。研究报道有高血压、肾动脉瘤、肾动脉狭窄、淋巴细胞浸润肾实质、肾小球瘢痕形成等表现。胃肠道表现包括肠坏死、肠穿孔、肠狭窄和肠系膜上动脉/腹主动脉动脉瘤,另有部分患儿出现转氨酶升高、肝脾大、门静脉高压的表现。
急性期患儿CRP、ESR和转氨酶常升高。常见的免疫缺陷主要为低丙种球蛋白血症,IgM、IgG和IgA均有不同程度降低;CD4+淋巴细胞轻度至重度减少,自然杀伤细胞计数降低。自身抗体阴性。血浆ADA2活性下降程度与疾病严重性相关。
皮肤活检可提示血管炎证据,包括非肉芽肿性坏死性动脉炎、白细胞破碎性血管炎和脂膜炎。头颅影像学检查可见缺血性卒中表现,常发生于脑干、丘脑、基底神经核和内囊等部位。血管造影可见肾动脉瘤、中小动脉扩张和肾内动脉狭窄、梗死等。基因检测显示ADA2基因突变类型有错义突变、移码突变、剪接缺陷和基因缺失,多数DADA2患儿为复合杂合错义突变。
目前尚无DADA2统一的诊断标准。临床、实验室和影像学发现以血管炎、免疫功能失调和血液系统异常为特征的患儿,应怀疑DADA2并进行ADA2基因测序和ADA2血浆蛋白水平或活性检测。如发现基因功能丧失的ADA2致病性突变和较低的ADA2蛋白活性(低于正常水平5%),DADA2可确诊。
以上几种主要的AIDs的临床特点及相应治疗见表6。
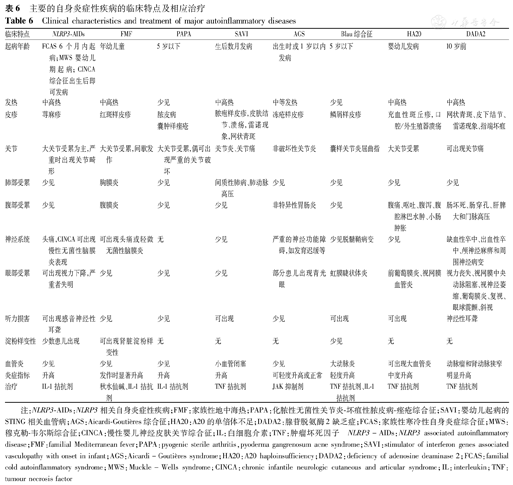
主要的自身炎症性疾病的临床特点及相应治疗
Clinical characteristics and treatment of major autoinflammatory diseases
主要的自身炎症性疾病的临床特点及相应治疗
Clinical characteristics and treatment of major autoinflammatory diseases
| 临床特点 | NLRP3-AIDs | FMF | PAPA | SAVI | AGS | Blau综合征 | HA20 | DADA2 |
|---|---|---|---|---|---|---|---|---|
| 起病年龄 | FCAS 6个月内起病;MWS婴幼儿期起病;CINCA综合征出生后即可发病 | 年幼儿童 | 5岁以下 | 生后数月发病 | 出生时或1岁以内发病 | 5岁以下 | 婴幼儿发病 | 10岁前 |
| 发热 | 中高热 | 中高热 | 少见 | 中高热 | 中等发热 | 少见 | 中高热 | 中高热 |
| 皮疹 | 荨麻疹 | 红斑样皮疹 | 脓皮病 | 脓疱样皮疹,皮肤结节、溃疡,雷诺现象,网状青斑 | 冻疮样皮疹 | 鳞屑样皮疹 | 充血性斑丘疹,口腔/外生殖器溃疡 | 网状青斑、皮下结节、雷诺现象、指端坏疽 |
| 囊肿样痤疮 | ||||||||
| 关节 | 大关节受累为主,严重时出现关节畸形 | 大关节受累,间歇发作 | 大关节受累,偶可出现严重的关节破坏 | 关节炎、关节痛 | 非破坏性关节炎 | 囊样关节炎屈曲指 | 大关节受累 | 可出现关节痛 |
| 肺部受累 | 少见 | 胸膜炎 | 少见 | 间质性肺病、肺动脉高压 | 少见 | 少见 | 少见 | 少见 |
| 腹部受累 | 少见 | 腹膜炎 | 少见 | 少见 | 非特异性胃肠炎 | 少见 | 腹痛、呕吐、腹泻、腹腔淋巴水肿、小肠肿胀 | 肠坏死、肠穿孔、肝脾大和门脉高压 |
| 神经系统 | 头痛,CINCA可出现慢性无菌性脑膜炎表现 | 可出现头痛或轻微无菌性脑膜炎 | 无 | 少见 | 严重的神经功能障碍,如发育迟缓等 | 少见脱髓鞘病变 | 少见 | 缺血性卒中、出血性卒中、颅神经麻痹和周围神经病变 |
| 眼部受累 | 可出现视力下降,严重者失明 | 少见 | 少见 | 少见 | 部分患儿出现青光眼 | 虹膜睫状体炎 | 前葡萄膜炎、视网膜血管炎 | 视力丧失、视网膜中央动脉阻塞、视神经萎缩、葡萄膜炎、复视、眼球震颤、斜视 |
| 听力损害 | 可出现感音神经性耳聋 | 少见 | 少见 | 可出现 | 少见 | 可出现 | 可出现 | 神经性耳聋 |
| 淀粉样变性 | 少数患儿出现 | 可出现肾脏淀粉样变性 | 无 | 无 | 无 | 少见 | 无 | 无 |
| 血管炎 | 少见 | 少见 | 少见 | 小血管闭塞 | 少见 | 大动脉炎 | 可出现大血管炎 | 动脉瘤和肾动脉狭窄 |
| 炎症指标 | 升高 | 发作时显著升高 | 升高 | 升高 | 可轻度升高或正常 | 轻度升高 | 中度升高 | 明显升高 |
| 治疗 | IL-1拮抗剂 | 秋水仙碱、IL-1拮抗剂 | IL-1拮抗剂 | TNF拮抗剂 | JAK抑制剂 | TNF拮抗剂、IL-1拮抗剂 | TNF拮抗剂 | TNF拮抗剂 |
注:NLRP3-AIDs:NLRP3相关自身炎症性疾病;FMF:家族性地中海热;PAPA:化脓性无菌性关节炎-坏疽性脓皮病-痤疮综合征;SAVI:婴幼儿起病的STING相关血管病;AGS:Aicardi-Goutières综合征;HA20:A20的单倍体不足;DADA2:腺苷脱氨酶2缺乏症;FCAS:家族性寒冷性自身炎症综合征;MWS:穆克勒-韦尔斯综合征;CINCA:慢性婴儿神经皮肤关节综合征;IL:白细胞介素;TNF:肿瘤坏死因子 NLRP3-AIDs:NLRP3 associated autoinflammatory disease;FMF:familial Mediterranean fever;PAPA:pyogenic sterile arthritis,pyoderma gangrenosum acne syndrome;SAVI:stimulator of interferon genes associated vasculopathy with onset in infant;AGS:Aicardi-Goutières syndrome;HA20:A20 haploinsufficiency;DADA2:deficiency of adenosine deaminase 2;FCAS:familial cold autoinflammatory syndrome;MWS:Muckle-Wells syndrome;CINCA:chronic infantile neurologic cutaneous and articular syndrome;IL:interleukin;TNF:tumour necrosis factor
AIDs是由基因突变引起其编码蛋白异常,造成固有免疫系统失调而引起全身炎症反应的一类遗传性疾病,其临床表现复杂多样,多种炎症信号通路异常参与疾病的发生。在临床工作中对于起病年龄小、复发性和周期性发热、伴全身症状和多系统炎症表现、有或无类似疾病家族史、发作期间急性时相炎症蛋白升高而无症状期间正常的患儿需要考虑到AIDs的可能性,可进一步完善相关检查并行基因检测明确诊断。目前治疗AIDs的药物主要包括糖皮质激素、非甾体类抗炎药物、免疫抑制剂、秋水仙碱和生物制剂等靶向药物,药物的合理应用有助于控制全身炎症。对AIDs早期识别、早期诊断、早期干预和治疗,可以减少脏器功能损伤和衰竭、减少淀粉样变性等远期并发症,从而改善患儿的远期预后。
(张俊梅 邓江红 檀晓华 李彩凤 执笔)
参与本共识讨论、制定的专家(按姓氏拼音排序):曹兰芳(上海交通大学医学院附属仁济医院);陈同辛(上海交通大学医学院附属上海儿童医学中心);陈雨青(安徽省儿童医院);邓江红(国家儿童医学中心,首都医科大学附属北京儿童医院);封其华(苏州大学附属儿童医院);韩梅(大连市儿童医院);金燕樑(上海交通大学医学院附属上海儿童医学中心);李彩凤(国家儿童医学中心,首都医科大学附属北京儿童医院);李亚蕊(山西省儿童医院);李玉峰(上海交通大学医学院附属新华医院);李志辉(湖南省儿童医院);廖亚彬(昆明市儿童医院);刘小惠(江西省儿童医院);刘翠华(河南省儿童医院);卢美萍(浙江大学医学院附属儿童医院);孙利(上海复旦大学儿科医院);檀晓华(国家儿童医学中心,首都医科大学附属北京儿童医院);尹薇(武汉妇女儿童医院);张洪霞(山东大学齐鲁儿童医院);张俊梅(国家儿童医学中心,首都医科大学附属北京儿童医院);郑雯洁(温州医科大学附属第二医院);周志轩(首都儿科研究所附属儿童医院)
所有作者均声明不存在利益冲突



























