
探讨微小RNA(miRNA)–214对慢性间歇低氧大鼠心肌细胞凋亡的影响及机制。
SD雄性大鼠20只,按随机数字表法随机分为慢性间歇低氧组(间歇性低氧舱内饲养8 h/d,共6周)和对照组(正常饲养)各10只。实验结束时通过颈动脉插管测定其血液动力学指标,TUNEL法检测大鼠心肌细胞凋亡,实时定量PCR测定心肌中miRNA–214及靶基因缺氧诱导因子–1α(HIF–1α)的变化;采用Western印迹法检测心肌组织中凋亡相关蛋白的相对表达量。
慢性间歇低氧组左室舒张末压显著高于对照组[(4.1±0.5)比(2.7±0.4)mmHg](1 mmHg=0.133 kPa),而左室内压最大下降速率[(3 005±86)比(5 918±112)mmHg/s]、左室内压最大上升速率[(4 118±76)比(7 547±271)mmHg/s]和左室收缩压[(90.7±2.5)比(132.7±5.5)mmHg]均显著低于对照组(均P<0.001);慢性间歇低氧组心肌细胞凋亡指数显著高于对照组,miRNA–214相对表达量显著低于对照组,其靶基因HIF–1α相对表达量显著高于对照组(均P<0.001);慢性间歇低氧组凋亡相关蛋白半胱氨酸天冬氨酸蛋白酶(caspase)–3、caspase–8及脂肪酸合成酶(Fas)、B细胞淋巴瘤–2(Bcl–2)相关X蛋白(Bax)的相对表达量均显著高于对照组,Bcl–2相对表达量显著低于对照组(均P<0.001)。
慢性间歇性低氧可引起大鼠左心室收缩和舒张功能降低,miRNA–214能调控其靶基因HIF–1α,激活Fas死亡受体凋亡通路,影响慢性间歇性低氧诱导大鼠心肌细胞凋亡。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
既往研究表明,睡眠呼吸暂停综合征(SAS)和心力衰竭密切相关[1];夜间反复的低氧复氧可能会造成炎症反应和氧化应激增多,交感神经驱动增加,进而导致SAS患者的心血管损害和心肌损伤[2];心肌细胞凋亡在心衰的发生中发挥了关键作用[3]。有文献报道,心肌梗死的小鼠心肌细胞凋亡增加,其微小RNA(miRNA)–214表达下调[4];缺氧诱导因子(HIF)–1α可能是miRNA–214的靶基因,参与心肌凋亡的调节[5]。本研究建立大鼠慢性间歇低氧模型,观察其心功能变化,探讨miRNA–214对其心肌凋亡的影响及机制。
雄性SPF级健康SD大鼠20只,体质量200~220 g;购自复旦大学实验动物中心,动物使用合格证SYXK(沪)2009–0082;动物生产合格证SCXK(沪)2009–0019。
Trizol试剂、Tunel试剂盒、SYBR Green实时定量PCR混合试剂盒(美国Invitrogen公司)miRNA cDNA第一链合成试剂盒、miRNA提取分离试剂盒、miRNA荧光定量检测试剂盒(北京天根生化科技有限公司);4',6–二脒基–2–苯基吲哚(DAPI)、半胱氨酸天冬氨酸蛋白酶(caspase)–3、caspase–8、脂肪酸合成酶(Fas)、B细胞淋巴瘤–2(Bcl–2)、Bcl–2相关X蛋白(Bax)、β–肌动蛋白兔抗大鼠多克隆抗体(美国Santa Cruz公司);水合氯醛(上海试剂公司);有机玻璃舱箱(杭州艾普仪器公司);CY–12D测氧仪(上海华亭仪器厂);MLT844动脉压力换能器、10T多导生理记录仪、Chart 4.0软件(美国Powerlab公司);IPP6.2图像分析软件(美国IPP公司);CY–2000荧光显微镜、Alpha Imager HP凝胶成像仪(德国Leica公司);大鼠抗兔辣根过氧化酶标记二抗(美国Sigma公司);电化学发光(ECL)试剂盒、蛋白检测试剂盒(武汉博士德公司)。引物:5s核糖体RNA(5srRNA):5' GTCTAC GGCCATACCACCCTGAAC 3';miRNA–214:5' ACA GCAGGCACAGACAGGCAGT 3';HIF–1α上游:5' TTATCATGCTTTGGACTCTG 3',下游:5' CCAGCA AAGTTAAAGCATCA 3';β–肌动蛋白上游:5' GGA CGACATGGAGAAAATACTGG 3',下游:5' GGATAG CAACGTACATGGCTGG 3'(上海生工生物科技有限公司合成)。
20只大鼠按照随机数字表法随机分为对照组和慢性间歇低氧组各10只。
(1)慢性间歇低氧组:大鼠放于35 cm×32 cm×12 cm有机玻璃舱内,舱箱和循环定时器间使用螺丝管阀门连接。在往舱内输入纯氮40 s后,使用测氧仪测得舱内氧浓度维持在6%~8%,并且在保持10 s后,输入纯氧10 s,使舱内氧浓度回升至20.5%,1次/min循环,每天7 h(10:30至17:30),持续6周。(2)对照组:大鼠放在相同的有机玻璃舱箱内,给予空气。
肝素化的生理盐水(150 U/ml)导入动脉压力换能器,多导生理记录仪调零;注射水合氯醛(10 mg/100 g)进大鼠腹腔麻醉,分离左侧颈总动脉,插入PE–50导管,并固定。将导管沿颈总动脉向心脏方向送进,并用Chart 4.0软件依次记录动脉压和心室内压,分别记录3次×5 min,取连续5个波形图平均值,记录左室内压最大下降速率和左室内压最大上升速率、左室舒张末压、左室收缩压。
每组取5只大鼠近心尖部心肌组织约120 mg,冰冻切片,用TUNEL法检测心肌细胞凋亡,首先用PBS洗涤玻片,放在37 ℃湿盒中孵育40 min,用PBS冲洗5次,在其上滴入60 μl荧光底物溶液,室温孵育40 min,用PBS冲洗5次,DAPI复染细胞核,树脂封片。用IPP6.2图像分析软件计数和荧光显微镜拍照。在每张切片随机选5个视野进行细胞计数,计算视野中凋亡细胞数量、总细胞数及凋亡指数。凋亡指数=凋亡细胞数量(在细胞核中红色荧光为凋亡细胞)/同一视野细胞总数×100%。
(1)miRNA的提取:每组取5只大鼠心肌组织各100 mg组织,使用液氮将心肌组织研磨成粉末,在加入1 ml裂解液后,抽提心肌细胞中总miRNA。(2)逆转录反应:miRNA–214 3'末端加多聚A尾,将miRNA–214进行逆转录反应,生成cDNA第一链,具体的操作步骤参照miRNA cDNA第一链合成试剂盒说明书。(3)实时定量PCR反应:对合成后的miRNA–214 cDNA第一链行实时定量PCR反应,反应体系:20 μl,反应条件:95 ℃ 2 min,(95 ℃ 20 s,62 ℃ 30 s,73 ℃ 20 s)×50周期,5srRNA作为内参,具体操作步骤参照miRNA荧光定量检测试剂盒。目的基因相对表达量用2–ΔΔCT法分析。
实时定量PCR反应:每组取5只大鼠左心室心肌组织各100 mg组织,采用液氮研磨法将心肌组织磨成粉末,加入1 ml TRIzol混合,提取心肌组织中总mRNA。在波长260及280 nm测定样品吸光度(A)值,两者比值控制在1.8~2.1;β–肌动蛋白为内参。使用mRNA实时定量PCR反应,测定HIF–1α mRNA的含量,具体步骤按试剂盒说明,目的基因相对表达量用2–ΔΔCT法分析。
每组取5只大鼠麻醉处死,取心肌组织300 mg。使用蛋白裂解液提取心肌组织蛋白,采用蛋白检测试剂盒测定蛋白浓度,采用Western印迹法测定大鼠心肌组织凋亡相关蛋白(caspase –3、caspase–8、Fas、Bcl–2、Bax)相对表达量。用PBS稀释一抗:Fas抗体(1∶200)、caspase –3抗体(1∶500)、caspase–8抗体(1∶400)、Bax抗体(1∶300)、Bcl–2抗体(1∶400)、β–肌动蛋白抗体(1∶300)。用PBS稀释大鼠抗兔辣根过氧化酶标记二抗,浓度均为1∶2 000,使用ECL试剂盒发光,曝光和采集图像,IPP6.2图像分析软件进行分析。
使用SPSS 16.0统计学软件进行分析。正态分布的连续变量以 ±s表示。两组间均数比较采用独立样本t检验,以P<0.05为差异有统计学意义。
±s表示。两组间均数比较采用独立样本t检验,以P<0.05为差异有统计学意义。
慢性间歇低氧组左室内压最大下降速率和左室内压最大上升速率、左室收缩压显著低于对照组,左室舒张末压显著高于对照组(均P<0.001)(表1)。
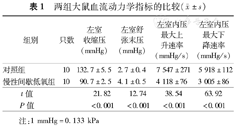
两组大鼠血流动力学指标的比较( ±s)
±s)
两组大鼠血流动力学指标的比较( ±s)
±s)
| 组别 | 只数 | 左室收缩压(mmHg) | 左室舒张末压(mmHg) | 左室内压最大上升速率(mmHg/s) | 左室内压最大下降速率(mmHg/s) | |
|---|---|---|---|---|---|---|
| 对照组 | 10 | 132.7±5.5 | 2.7±0.4 | 7 547±271 | 5 918±112 | |
| 慢性间歇低氧组 | 10 | 90.7±2.5 | 4.1±0.5 | 4 118±76 | 3 005±86 | |
| t值 | 21.82 | 12.74 | 38.54 | 63.92 | ||
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | ||
注:1 mmHg=0.133 kPa
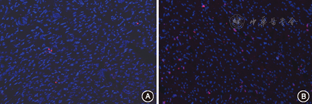
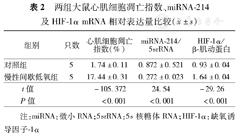
慢性间歇低氧组(图1B)在荧光镜下的TUNEL红色荧光标记的凋亡细胞数量显著多于对照组(图1A),凋亡指数增加显著(表2)。

两组大鼠心肌细胞凋亡指数、miRNA–214及HIF–1α mRNA相对表达量比较( ±s)
±s)
两组大鼠心肌细胞凋亡指数、miRNA–214及HIF–1α mRNA相对表达量比较( ±s)
±s)
| 组别 | 只数 | 心肌细胞凋亡指数(%) | miRNA–214/5srRNA | HIF–1α/β–肌动蛋白 | |
|---|---|---|---|---|---|
| 对照组 | 5 | 1.74±0.11 | 0.872±0.521 | 0.93±0.04 | |
| 慢性间歇低氧组 | 5 | 17.44±0.31 | 0.272±0.023 | 1.64±0.04 | |
| t值 | –105.372 | 24.54 | –29.26 | ||
| P值 | <0.001 | <0.001 | <0.001 | ||
注:miRNA:微小RNA;5srRNA:5s核糖体RNA;HIF–1α:缺氧诱导因子–1α
慢性间歇低氧组心肌组织中的miRNA–214相对表达量显著低于对照组,而慢性间歇低氧组中HIF–1α mRNA相对表达量显著高于对照组(均P<0.001)(表2)。
慢性间歇低氧组抑制凋亡蛋白Bcl–2相对表达量显著低于对照组,而Fas、Bax、caspase–3、caspase–8蛋白相对表达量均显著高于对照组(均P<0.01)(表3)。
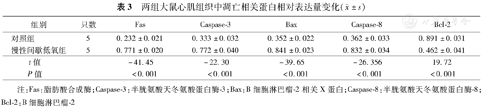
两组大鼠心肌组织中凋亡相关蛋白相对表达量变化( ±s)
±s)
两组大鼠心肌组织中凋亡相关蛋白相对表达量变化( ±s)
±s)
| 组别 | 只数 | Fas | Caspase–3 | Bax | Caspase–8 | Bcl–2 | |
|---|---|---|---|---|---|---|---|
| 对照组 | 5 | 0.232±0.021 | 0.333±0.032 | 0.352±0.022 | 0.362±0.033 | 0.891±0.031 | |
| 慢性间歇低氧组 | 5 | 0.771±0.020 | 0.772±0.040 | 0.841±0.023 | 0.832±0.034 | 0.462±0.041 | |
| t值 | –41.45 | –22.30 | –39.65 | –26.356 | 19.72 | ||
| P值 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | ||
注:Fas:脂肪酸合成酶;Caspase–3:半胱氨酸天冬氨酸蛋白酶–3;Bax:B细胞淋巴瘤–2相关X蛋白;Caspase–8:半胱氨酸天冬氨酸蛋白酶–8;Bcl–2:B细胞淋巴瘤–2
模拟慢性间歇性低氧大鼠心脏特点和SAS患者相似,具体症状表现为左室肥厚和功能不全和血压上升。动物实验提示,慢性间歇性低氧会导致左心功能降低[6]。本实验结果显示慢性间歇性低氧大鼠左室舒张末压明显升高,左室内压最大下降速率、左室内压最大上升速率、左室收缩压显著下降,提示其心功能降低。
研究表明,长期间歇性低氧可引起心肌细胞损伤[7];处于左室心力衰竭的病患在疾病终末期,心肌凋亡指数显著增加[8];长期慢性间歇低氧可激活Fas死亡受体通路和线粒体通路诱导心肌细胞凋亡,心肌细胞Fas死亡受体凋亡通路有关蛋白质表达上调,而抗凋亡蛋白Bcl–2表达下调[9]。本研究中慢性间歇低氧大鼠的心肌细胞凋亡指数上升,凋亡相关蛋白表达上调,抗凋亡蛋白Bcl–2表达下调,表明慢性间歇低氧造成了心肌细胞凋亡。
有研究表明,心肌损伤和miRNA密切相关[10,11];小鼠心肌受损后,其心肌组织中miRNA–214表达明显下调,推测其可能与细胞缺氧有关[4]。研究提示,心肌细胞在H2O2处理后,其miRNA–214表达下降[12]。本实验发现,慢性间歇低氧大鼠心肌组织中的miRNA–214表达显著下降,而其调控的靶基因HIF–1α[5,13]的mRNA水平显著增加,这符合miRNA–214对其调控后的变化。
研究证实,缺氧可以诱导HIF–1α蛋白的稳定及其转录,进而激活Fas死亡受体凋亡通路,细胞凋亡增加,促进其凋亡相关蛋白表达上调[14]。因此,我们推测在慢性间歇低氧组miRNA–214表达下调后,进一步上调其靶基因HIF–1α,激活Fas死亡受体凋亡通路导致心肌凋亡。miRNA–214和HIF–1α相互作用后是否还有其他途径导致心肌凋亡有待进一步研究。



























