
探讨血清脂蛋白相关磷脂酶A2(Lp-PLA2)与基于KIM分型脑白质病变(WML)以及颈动脉粥样硬化斑块的相关性。
收集2018年11月至2019年7月于安徽医科大学第一附属医院神经内科以头痛或头晕起病的住院患者155例,其中头颅MRI表现为WML者125例(WML组),头颅MRI正常30例作为对照组(NC组)。WML组患者根据KIM分型分为脑室旁组(JVWML组)(n=30)、近脑室组(PVWML组)(n=33)、近皮质组(JCWML组)(n=30)、深部组(DWML组)(n=32)。调查所有受试对象血管危险因素临床资料并记录;采用双抗体夹心酶联免疫吸附法(ELISA)对所有受试对象血清Lp-PLA2含量进行测定;应用颈动脉超声检测颈动脉粥样硬化斑块并分为稳定性和不稳定性斑块,并按照Crouse法计算各自斑块总积分。
WML组Lp-PLA2[(117±37)ng/ml比(95±30)ng/ml]、稳定斑块积分[0(0,2.5)分比0分]、不稳定斑块积分[0(0,3.4)分比0分]均明显高于NC组(均P<0.05);PVWML组Lp-PLA2[(138±41)ng/ml]和不稳定斑块积分[1.5(0,3.8)分]明显高于NC组(均P<0.05);PVWML组Lp-PLA2水平明显高于JVWML组[(100±28)ng/ml]、JCWML组[(101±27)ng/ml](均P<0.05)。相关分析显示,PVWML组不稳定斑块积分与血糖(r=0.600, P=0.000)、TG(r=0.371, P=0.034)、LDL-C(r=0.367, P=0.036)、Lp-PLA2(r=0.567, P=0.001)呈正相关,与HDL-C呈负相关(r=-0.368, P=0.035)。将PVWML组所有相关因素与不稳定斑块积分进行多元线性回归显示:血糖(b=0.463, P<0.01)、Lp-PLA2(b=0.347, P<0.05)与不稳定斑块积分仍呈正相关。
血清Lp-PLA2是反映动脉粥样硬化的一项指标,其与近脑室型WML颈动脉不稳定性斑块存在一定的相关性,提示炎症机制在缺血性WML发生发展中起重要作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脑白质病变(white matter lesion,WML)是由多种病因和发病机制引起的,与认知障碍、脑卒中、步态障碍、情感障碍等均有相关。根据KIM分型[1]可将WML分为脑室旁组(juxtaventricular white matter lesion,JVWML)、近脑室组(periventricular white matter lesion,PVWML)、近皮质组(juxtacortical white matter lesion,JCWML)和深部组(deep white matter lesion,DWML),不同部位WML的危险因素和发生机制需要进一步深入研究。脂蛋白相关磷脂酶A2(Lp-PLA2)属于磷脂酶A2超家族,主要由炎症细胞(如巨噬细胞、淋巴细胞等)分泌,是一个新近研究的炎性反应介质。有研究表明,Lp-PLA2是导致动脉硬化和反映动脉易损斑块稳定性的重要生物学指标[2],其水平与心脑血管疾病的发生发展、预后等有关[3,4,5,6]。近年来,有研究提出颈动脉壁增厚与WML发生密切相关[7],颈动脉狭窄程度与WML的严重程度呈显著正相关[8]。有学者提出Lp-PLA2与颈动脉粥样硬化斑块的不稳定性存在一定相关性,并且与皮质下WML关系密切[9]。目前Lp-PLA2在不同部位WML患者之间的差异及其在颈动脉粥样硬化斑块中的作用鲜有报道。本研究旨在探讨基于KIM分型,不同部位WML血清Lp-PLA2水平变化,及其与颈动脉粥样硬化斑块的相关性,为进一步探讨WML发病机制,并为临床有针对性干预提供一定依据。
选择安徽医科大学第一附属医院神经内科2018年11月至2019年7月以头痛或头晕起病的住院患者155例,头颅磁共振成像(MRI)表现为WML的患者125例,其中男67例,女58例,年龄(68±8)岁;正常60~70岁的老年人WML的发生率为80%左右,故满足最小样本量条件下,我们从中选出年龄性别相匹配,头颅MRI未见明显异常的30例患者为对照(NC)组,其中男16例,女14例,年龄(65±8)岁。按照KIM分型将WML组分为4个亚组:JVWML组30例,年龄(67±8)岁;PVWML组33例,年龄(68±7)岁;JCWML组30例,年龄(68±10)岁;DWML组32例,年龄(68±8)岁。
选取以主诉头晕或头痛,查体无明显神经系统缺损症状者为研究对象,符合影像学诊断标准:根据1986年加拿大神经病学家Hachinski等[10]提出,WML,指脑室周围及皮质下(半卵圆中心)区域脑白质的弥漫性斑点状或斑片状改变,在MRI T2加权像上的高信号区。排除标准:(1)脑肿瘤、急性期脑梗死、脑外伤、脑出血、精神系统疾病等;(2)其他因素引起的非血管性脑白质改变,如多发性硬化、免疫、代谢、中毒、感染等;(3)合并严重的心、肺、肾功能不全,严重的肝功能损害、恶性肿瘤、自身免疫性疾病、代谢综合征、血液系统疾病等;(4)近两周有手术史或严重的感染性疾病。
本研究经安徽医科大学第一附属医院伦理委员会批准(批准号:20170227),所有受试者均签署知情同意书。
记录所有受试者详细的病史资料,包括性别、年龄、高血压史、糖尿病史、心脏病史(包括冠状动脉粥样硬化性心脏病、心律失常等)、饮酒史、吸烟史、肝肾疾病史等。
患者入院后次日清晨空腹12 h以上采肘静脉3 ml,送我院检验科采用罗氏Cobas8000测定尿素氮、尿酸等肾功能指标,超敏C反应蛋白(hs-CRP)、同型半胱氨酸(Hcy)以及空腹血糖、总胆固醇(TCH)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)等血脂指标。
采用EDTA-K2抗凝管抽取所有研究对象的空腹静脉血2 ml,1 500 r/min,离心10 min,Eppendorf管收集血浆,于-20 ℃保存,避免反复冻融,集中检测。血清Lp-PLA2水平检测试剂由天津康尔克生物科技有限公司提供,采用双抗体夹心酶联免疫吸附法(ELISA),酶标仪型号为BioTek Elx880。所有操作严格按操作规程进行。
所有受试者采用GE公司生产的Signa 3.0T超导磁共振机器上进行扫描,依据头颅MRI T2、FLAIR结果对所有受试者根据KIM分型分为JVWML组(脑白质损伤在侧脑室旁3 mm内)、PVWML组(脑白质损伤在脑室外3~13 mm)、JCWML组(脑白质损伤在皮质下,与脑皮髓质交界区4 mm以内)、DWML组(脑白质损伤在深部),对于少部分白质损伤有交叉重叠的,我们以某一部位损伤为主进行分组。
采用飞利浦Sparq彩色多普勒超声检查仪进行颈部血管超声检查,4~12 MHz线阵式探头。患者取平卧头仰位,由同一检查者操作,以血管长轴图像为准,扫描左右颈总动脉、颈动脉分叉处、颈内动脉和颈外动脉,并测量3次,取平均值为颈动脉内中膜厚度(IMT),以IMT后壁为标准,IMT≥1.5 mm为斑块形成,根据Crouse计量法[11]计算斑块总积分,即将同侧颈动脉血管内各个孤立性动脉粥样硬化斑块的最大厚度相加,得到该侧颈动脉斑块积分值,双侧颈动脉斑块积分之和为斑块总积分。根据超声声像特点,将颈动脉粥样硬化斑块分为稳定斑块、不稳定斑块,计算稳定和不稳定斑块的斑块总积分。
采用SPSS 22.0版统计学软件分析,计量资料服从正态分布以 ±s表示,不服从正态分布以M(Q1,Q3)表示;计数资料以例(%)表示。两组正态分布计量资料比较使用两独立样本t检验;两组非正态分组计量资料比较采用两独立样本秩和检验;WML各亚型间危险因素的比较采用多样本均数间多重比较。两组计数资料比较采用χ2检验。计量资料的相关分析采用Pearson相关;计数资料的相关分析采用Spearman相关;不同WML亚型影响因素的分析采用多元线性回归分析。以P<0.05为差异有统计学意义。
±s表示,不服从正态分布以M(Q1,Q3)表示;计数资料以例(%)表示。两组正态分布计量资料比较使用两独立样本t检验;两组非正态分组计量资料比较采用两独立样本秩和检验;WML各亚型间危险因素的比较采用多样本均数间多重比较。两组计数资料比较采用χ2检验。计量资料的相关分析采用Pearson相关;计数资料的相关分析采用Spearman相关;不同WML亚型影响因素的分析采用多元线性回归分析。以P<0.05为差异有统计学意义。
WML组高血压比例、Hcy、不稳定斑块积分均高于NC组(均P<0.05);Lp-PLA2水平、稳定斑块积分明显高于NC组(均P<0.01);其他指标与NC组比较,差异无统计学意义(均P>0.05)(表1)。
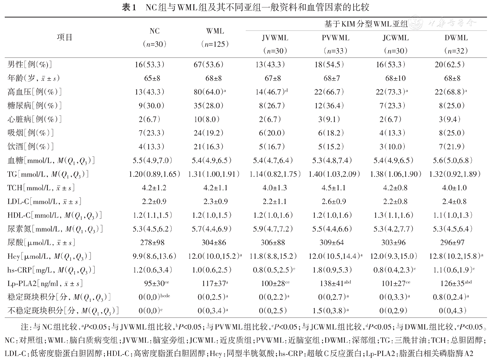
NC组与WML组及其不同亚组一般资料和血管因素的比较
NC组与WML组及其不同亚组一般资料和血管因素的比较
| 项目 | NC(n=30) | WML(n=125) | 基于KIM分型WML亚组 | |||
|---|---|---|---|---|---|---|
| JVWML(n=30) | PVWML(n=33) | JCWML(n=30) | DWML(n=32) | |||
| 男性[例(%)] | 16(53.3) | 67(53.6) | 13(43.3) | 18(54.5) | 16(53.3) | 20(62.5) |
年龄(岁, ± s) ± s) | 65±8 | 68±8 | 67±8 | 68±7 | 68±10 | 68±8 |
| 高血压[例(%)] | 13(43.3) | 80(64.0)a | 14(46.7)d | 22(66.7) | 22(73.3)a | 22(68.8)a |
| 糖尿病[例(%)] | 9(30.0) | 35(28.0) | 8(26.7) | 12(36.4) | 7(23.3) | 8(25.0) |
| 心脏病[例(%)] | 2(6.7) | 10(8.0) | 2(6.7) | 3(9.1) | 2(6.7) | 3(9.4) |
| 吸烟[例(%)] | 7(23.3) | 24(19.2) | 6(20.0) | 6(18.2) | 4(13.3) | 8(25.0) |
| 饮酒[例(%)] | 4(13.3) | 21(16.3) | 5(16.7) | 5(15.2) | 3(10.0) | 7(21.9) |
| 血糖[mmol/L,M(Q1,Q3)] | 5.5(4.9,7.0) | 5.4(4.9,6.5) | 5.4(4.7,6.4) | 5.3(4.8,7.4) | 5.4(4.9,6.5) | 5.6(5.0,6.8) |
| TG[mmol/L,M(Q1,Q3)] | 1.20(0.89,1.65) | 1.31(1.00,1.91) | 1.14(0.82,1.75) | 1.40(1.03,2.09) | 1.38(1.06,1.90) | 1.32(0.92,1.89) |
TCH[mmol/L, ± s] ± s] | 4.2±1.2 | 4.2±1.1 | 4.0±1.3 | 4.5±1.1 | 4.2±0.8 | 4.0±1.0 |
LDL-C[mmol/L, ± s] ± s] | 2.2±0.9 | 2.3±0.9 | 2.2±1.1 | 2.6±0.9 | 2.2±0.8 | 2.4±0.8 |
| HDL-C[mmol/L,M(Q1,Q3)] | 1.2(1.1,1.5) | 1.2(1.0,1.5) | 1.2(1.0,1.6) | 1.2(1.0,1.6) | 1.3(1.1,1.6) | 1.1(1.0,1.3) |
| 尿素氮[mmol/L,M(Q1,Q3)] | 5.3(4.5,6.2) | 5.7(4.4,6.9) | 5.9(4.7,7.2) | 5.5(4.4,6.6) | 5.3(4.2,7.7) | 5.3(4.5,6.4) |
尿酸[μmol/L, ± s] ± s] | 278±98 | 304±86 | 306±88 | 309±64 | 303±96 | 296±97 |
| Hcy[μmol/L,M(Q1,Q3)] | 9.9(8.6,13.6) | 12.0(10.0,15.2)a | 11.8(8.8,15.2) | 12.0(10.5,14.4)a | 12.0(9.3,15.0) | 12.8(10.2,15.8)a |
| hs-CRP[mg/L,M(Q1,Q3)] | 1.2(0.6,3.4) | 1.0(0.6,2.5) | 0.8(0.5,2.5)c | 1.8(0.9,5.3) | 0.8(0.4,2.3)c | 1.1(0.6,1.9)c |
Lp-PLA2[ng/ml, ± s] ± s] | 95±30ce | 117±37a | 100±28ce | 138±41abd | 101±27ce | 126±35abd |
| 稳定斑块积分[分,M(Q1,Q3)] | 0(0,0)bcde | 0(0,2.5)a | 0(0,2.2)a | 0(0,2.7)a | 0(0,3.3)a | 0.8(0,2.4)a |
| 不稳定斑块积分[分,M(Q1,Q3)] | 0(0,0)c | 0(0,3.4)a | 0(0,2.5) | 1.5(0,3.8)a | 0(0,2.9) | 0(0,4.3) |
注:与NC组比较,aP<0.05;与JVWML组比较,bP<0.05;与PVWML组比较,cP<0.05;与JCWML组比较,dP<0.05;与DWML组比较,eP<0.05。NC:对照组;WML:脑白质病变组;JVWML:脑室旁组;JCWML:近皮质组;PVWML:近脑室组;DWML:深部组;TG:三酰甘油;TCH:总胆固醇;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇;Hcy:同型半胱氨酸;hs-CRP:超敏C反应蛋白;Lp-PLA2:脂蛋白相关磷脂酶A2
PVWML和DWML组Lp-PLA2水平明显高于NC组,差异有统计学意义(均P<0.01),PVWML和DWML组Hcy水平高于NC组,差异有统计学意义(P<0.01,P<0.05);JCWML组和DWML组高血压比例高于NC组,差异有统计学意义(均P<0.05);4组WML亚型患者稳定斑块积分高于NC组,差异有统计学意义(均P<0.05);PVWML组不稳定斑块积分高于NC组,差异有统计学意义(P<0.05)(表1)。
PVWML组患者hs-CRP水平明显高于JVWML组、JCWML组、DWML组,差异有统计学意义(P<0.05,P<0.01,P<0.05)。PVWML组血清Lp-PLA2水平明显高于JVWML组、JCWML组,差异有统计学意义(均P<0.01)。DWML组血清Lp-PLA2水平明显高于JCWML组,差异有统计学意义(P<0.01)(表1)。
JVWML组不稳定斑块积分与年龄(r=0.411,P=0.024)、饮酒(r=0.496,P=0.005)、Hcy(r=0.461,P=0.010)呈正相关。PVWML组不稳定斑块积分与血糖(r=0.600,P=0.000)、TG(r=0.371,P=0.034)、LDL-C(r=0.367,P=0.036)、Lp-PLA2(r=0.567,P=0.001)呈正相关,与HDL-C呈负相关(r=-0.368,P=0.035)。DWML组稳定斑块积分与Lp-PLA2(r=-0.465,P=0.007)呈负相关;不稳定斑块积分与TCH(r=-0.429,P=0.014)、LDL-C(r=-0.468,P=0.007)呈负相关(表2)。
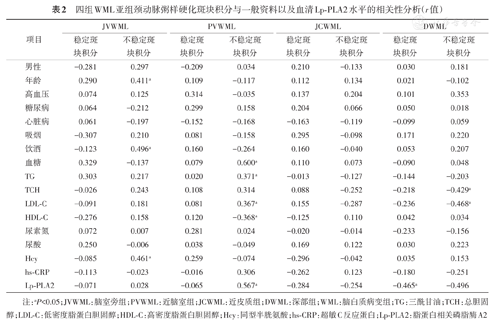
四组WML亚组颈动脉粥样硬化斑块积分与一般资料以及血清Lp-PLA2水平的相关性分析(r值)
四组WML亚组颈动脉粥样硬化斑块积分与一般资料以及血清Lp-PLA2水平的相关性分析(r值)
| 项目 | JVWML | PVWML | JCWML | DWML | ||||
|---|---|---|---|---|---|---|---|---|
| 稳定斑块积分 | 不稳定斑块积分 | 稳定斑块积分 | 不稳定斑块积分 | 稳定斑块积分 | 不稳定斑块积分 | 稳定斑块积分 | 不稳定斑块积分 | |
| 男性 | -0.281 | 0.297 | -0.209 | 0.034 | 0.210 | -0.133 | 0.030 | 0.181 |
| 年龄 | 0.290 | 0.411a | 0.109 | -0.117 | 0.112 | 0.134 | 0.021 | -0.102 |
| 高血压 | 0.074 | 0.125 | 0.314 | -0.035 | 0.137 | 0.204 | 0.101 | 0.353 |
| 糖尿病 | 0.064 | -0.212 | 0.299 | 0.158 | 0.204 | 0.066 | 0.050 | 0.018 |
| 心脏病 | 0.061 | -0.197 | -0.152 | -0.168 | -0.163 | -0.119 | -0.099 | 0.059 |
| 吸烟 | -0.307 | 0.210 | 0.081 | -0.158 | 0.295 | -0.098 | 0.171 | 0.220 |
| 饮酒 | -0.123 | 0.496a | 0.160 | -0.264 | 0.160 | -0.040 | 0.053 | 0.207 |
| 血糖 | 0.329 | -0.137 | 0.079 | 0.600a | 0.110 | 0.073 | -0.090 | 0.048 |
| TG | 0.303 | 0.217 | 0.020 | 0.371a | -0.013 | -0.127 | -0.144 | -0.203 |
| TCH | -0.026 | 0.243 | 0.108 | 0.314 | 0.088 | -0.252 | -0.218 | -0.429a |
| LDL-C | -0.091 | 0.181 | 0.081 | 0.367a | 0.155 | -0.287 | -0.236 | -0.468a |
| HDL-C | -0.276 | 0.158 | 0.120 | -0.368a | -0.125 | 0.110 | 0.042 | 0.034 |
| 尿素氮 | 0.072 | 0.007 | 0.281 | 0.024 | -0.020 | -0.014 | -0.233 | -0.156 |
| 尿酸 | 0.250 | -0.006 | 0.038 | -0.049 | 0.169 | 0.122 | 0.030 | 0.223 |
| Hcy | -0.085 | 0.461a | 0.259 | -0.074 | -0.296 | -0.042 | 0.035 | 0.153 |
| hs-CRP | -0.113 | -0.023 | -0.016 | 0.306 | -0.262 | 0.123 | -0.180 | -0.251 |
| Lp-PLA2 | -0.071 | 0.028 | -0.065 | 0.567a | -0.284 | -0.254 | -0.465a | -0.496 |
注:aP<0.05;JVWML:脑室旁组;PVWML:近脑室组;JCWML:近皮质组;DWML:深部组;WML:脑白质病变组;TG:三酰甘油;TCH:总胆固醇;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇;Hcy:同型半胱氨酸;hs-CRP:超敏C反应蛋白;Lp-PLA2:脂蛋白相关磷脂酶A2
年龄与不稳定斑块积分无明显相关性(P>0.05);饮酒(b=0.606,P<0.01),Hcy(b=0.485,P<0.01)与不稳定斑块积分有显著正相关。
TG、LDL-C、HDL-C与不稳定斑块积分无明显相关性(均P>0.05);血糖(b=0.463,P<0.01)、Lp-PLA2(b=0.347,P<0.05)与不稳定斑块积分仍呈正相关。
TCH、LDL-C与不稳定斑块积分无明显相关性(P>0.05)。
WML的病因有很多,如遗传、缺血、中毒、感染、代谢等,其中缺血是WML常见的病因类型之一。2008年Kim等[1]首次提出了非缺血性和缺血性WML的概念,认为WML的发生与缺血性改变更为密切,主要包括脑小血管壁损伤和脑低灌注等。脑室旁3 mm以外的WML多属于缺血性病变,根据病因及解剖学进一步分为近脑室(脑室下)、深部和近皮质。缺血性WML发病机制暂不十分明确。在本研究中,我们根据不同解剖部位来划分脑白质损伤,探讨了Lp-PLA2、颈动脉粥样硬化斑块与WML三者之间的关系,进一步了解WML的发病机制以及Lp-PLA2在WML的发生发展中可能起到的作用。
我们的研究结果发现WML组Lp-PLA2浓度显著高于NC组,在WML 4个亚组中,PVWML组和DWML组Lp-PLA2水平明显高于NC组,并且PVWML组Lp-PLA2水平也明显高于其他三组,这表明Lp-PLA2虽然可能参与了WML的形成,但却与不同的解剖部位有关。同时,研究发现WML组稳定斑块积分、不稳定斑块积分均明显高于NC组,4个亚型稳定斑块积分均高于NC组,但不稳定斑块积分只有PVWML组明显高于NC组,这表明颈动脉粥样硬化斑块与WML有关,但斑块的性质以及在不同的WML部位所起的作用有差异。此外,对PVWML组不稳定斑块积分与多种相关因素进行多元线性回归分析显示,Lp-PLA2与不稳定斑块积分仍呈正相关。我们认为Lp-PLA2与不稳定斑块存在一定的相关性,推测不同部位WML可能存在着不同的发病机制,其中近脑室型WML的发生发展可能与Lp-PLA2促进生成的颈动脉不稳定斑块有着密切关系。
Lp-PLA2是扩大的磷脂酶A2超家族成员,主要由淋巴细胞和巨噬细胞产生[12]。80%的Lp-PLA2以结合形式存在于血液循环中,绝大部分与LDL-C结合[13]。Lp-PLA2可水解氧化型低密度脂蛋白(ox-LDL)中的氧化卵磷脂,使之分解生成氧化型游离脂肪酸(oxFFA)和溶血卵磷脂(Lyso-PC),这二者可调节炎症因子表达,促进白细胞聚集,促进氧化修饰等,从而发挥促炎以及促动脉粥样硬化作用[14,15]。研究发现高水平Lp-PLA2与冠心病、糖尿病、外周动脉疾病的发生发展有关[16,17,18]。近年来还有研究者发现Lp-PLA2浓度的升高与WML的发病有关[19]。2012年Sarlon-Bartoli等[20]收集颈动脉内膜切除术患者的斑块样本,结果发现不稳定斑块的Lp-PLA2水平较稳定斑块明显升高,Lp-PLA2可增加颈动脉狭窄风险及斑块的不稳定性,我们在研究中发现,DWML组Lp-PLA2与稳定斑块积分呈负相关,这可能与Lp-PLA2促进稳定斑块向不稳定斑块转化有关,与该结果也是一致的。Altaf等[21]通过颈内动脉切除术所得斑块进行分析,证明不稳定斑块较稳定斑块对于WML的影响更大,活动性的斑块促进WML的发展。我们的研究结果发现Lp-PLA2与颈动脉粥样硬化斑块有关,其可能增加了颈动脉粥样硬化斑块的不稳定性,进而在WML的发生发展中起作用,这与以上研究结果一致。
国内也有学者对Lp-PLA2、颈动脉粥样硬化斑块与WML的关系进行研究,结果显示皮质下型Lp-PLA2水平最高,且与不稳定斑块积分呈正相关[9],与我们的研究结果有部分相同之处,但该研究以及以往大家对于WML的分型都是根据MRI表现分为脑室周围型、皮质下型、混合型多见,而我们的研究是根据KIM分型,即不同的解剖部位来分型的,因为不同解剖部位的WML可能有着不同的发病机制,这为我们探讨Lp-PLA2、颈动脉粥样硬化斑块与WML之间的关系提供了更好的基础,为了解WML的发病机制提供一种新的思路。此外,本研究还将Lp-PLA2与传统的炎性因子hs-CRP进行了对比,结果发现WML组Lp-PLA2较NC组明显升高,而hs-CRP与NC组并无差别,说明Lp-PLA2在WML中可能出现得更早,特异性更高。另一方面我们发现,Lp-PLA2水平较其他三组更高的PVWML组,hs-CRP水平也是明显升高的,这也提示炎症机制可能在WML中发挥作用。
我们首次利用KIM分型报道了Lp-PLA2、颈动脉粥样硬化斑块与WML之间的关系,发现在WML中血清Lp-PLA2是一项较hs-CRP更具有特异性的指标,其与不稳定斑块存在一定的相关性。不同部位WML可能存在着不同的发病机制,推测炎症机制在WML发生发展中起重要作用。本研究利用头颅MRI对于不同解剖部位进行分型,部分研究对象有白质损伤的重合,对于研究有一定的干扰,另外我们仅通过颈动脉超声采集的颈动脉粥样硬化斑块来研究三者的关系,方法较为单一。今后,还需要扩大样本量,增加新的辅助技术来进行深入研究。
所有作者均声明不存在利益冲突



























