
构建斑马鱼脑出血模型,并以此筛选诱导斑马鱼脑出血的相关基因。
通过吗啉代寡核苷酸(MO)技术和单细胞显微注射技术构建斑马鱼脑出血模型,并从宏观、微观角度多重验证。首先,造模实验采用注射Control MO的正常野生型AB品系斑马鱼作为对照组,实验组在AB斑马鱼胚胎单细胞时期分别注射神经嵴源性细胞(NCDCs)发育相关基因的MO,包括col8a1 MO、tfap2α MO、msx1a MO、msx2 MO、dkk1a MO等,于显微镜白光视野下初步验证模型。其次,采用Tg(flk1:GFP;gata1:dsRed)双转基因斑马鱼进行模型验证,该转基因鱼用绿色荧光蛋白(GFP)标记血管内皮细胞,用红色荧光蛋白(dsRed)标记血红细胞,能够更清晰地观察到斑马鱼脑出血的部位。在斑马鱼胚胎单细胞时期注射Control MO 作为对照组,注射col8a1 MO作为实验组,正常培养至受精后48 h通过激光共聚焦观察红细胞渗漏情况,构建荧光视野可观察的脑出血模型。最后,采用Tg(flk1:GFP)转基因斑马鱼进行基于血脑屏障的模型验证,通过Dextran-Rhodamin和DAPI染料的渗漏现象进一步明确斑马鱼血脑屏障的破坏与脑出血的发生,并进行定量统计,从而验证NCDCs发育相关基因与脑出血表型的关系,证明造模有效。
与注射Control MO的正常野生型AB品系斑马鱼对照组相比,col8a1、tfap2α和msx1基因突变的实验组斑马鱼有明显的脑出血现象,出血比例分别为18.18%(52/286)、23.04%(62/251)、35.94%(23/64),而msx2和dkk1a基因突变的斑马鱼极少观察到脑出血,出血比例仅分别为1.03%(1/97)和1.15%(1/87)。注射Control MO与col8a1 MO的Tg(flk1:GFP;gata1:dsRed)双转基因斑马鱼红细胞渗漏发生率分别为0.37%(1/273)与18.18%(52/286)(P<0.001)。注射Control MO与col8a1 MO组Tg(flk1:GFP)转基因斑马鱼DAPI阳性的细胞核数分别为(10.05±5.27)个与(60.35±3.96)个(P<0.001);Dextran-Rhodamin染料渗漏引起的中脑实质荧光示踪强度值分别为2.54±4.70与5.13±3.52(P<0.001),两组比较差异有统计学意义。
本研究成功构建了斑马鱼脑出血模型,并筛选出col8a1、tfap2α、msx1等诱导斑马鱼脑出血的相关基因。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脑出血是一种常见的脑血管综合征,具有高发病率、高死亡率、高致残率的临床特点,约占卒中的15%和卒中相关死亡的近50%[1]。生存患者大多存在神经功能障碍,严重影响患者生存质量,也给家庭、社会造成沉重负担[2]。
脑出血的发病机制目前尚不十分清楚,但具有明显的遗传倾向,和血-脑屏障(blood-brain barrier,BBB)发育相关的基因突变密切相关。BBB系分隔中枢神经系统和外周血液循环系统的多细胞血管结构,包括内皮细胞、周细胞和星形胶质细胞[3]。BBB构成单元的变异可改变其完整性和通透性,影响脑内物质与能量代谢平衡,在危险因素作用下诱发脑出血[4]。
研究表明,神经嵴源性细胞(neural crest-derived cells,NCDCs)能够渗透到前脑中分化成微血管周细胞[5]。作为周细胞的主要来源之一,NCDCs对周细胞的正常发育非常重要[6]。因此NCDCs相关基因的缺失可能会导致周细胞发育异常,进而引起脑出血及BBB渗漏。为了研究NCDCs相关基因与脑出血、BBB的关联性,本研究构建了斑马鱼脑出血模型和BBB渗漏模型,并筛选出能够诱导脑出血的NCDCs突变基因。
本研究中造模对象为野生型AB品系斑马鱼,由清华大学孟安明院士实验室提供。斑马鱼房温度为恒温28 ℃,明暗照比为14 h/10 h,系统水24 h过滤循环,pH控制在7.0~7.5。每天上下午各喂养1次。
模型验证实验中,采用不同基因背景的Tg(flk1:GFP;gata1:dsRed)双转基因斑马鱼与Tg(flk1:GFP)转基因斑马鱼来验证NCDCs发育相关基因与脑出血表型的关系,进一步证明造模结果的可重复性。
为求更加精准的统计结果,本研究将实验用斑马鱼所产胚胎数量全部进行统计,不同组别的样本量取决于各组斑马鱼所产胚胎数,理论上每组样本量n≥30即达统计学要求。
麻醉剂Tricaine(货号:E10521)和丙基硫氧嘧啶(propylthiouracil,PTU)(货号:P0643)均购自美国MERCK公司;Dextran-Rhodamine-10 kD(货号:D1816)和4′,6二脒基-2-苯吲哚(4′,6-diamidino-2-phenylindole,DAPI)(货号:62248)均购自美国Invitrogen公司,吗啉代寡核苷酸(morpholino oligonucleotides,MO)由GeneTools公司设计提供;纯水净化系统(美国Millipore公司);体式荧光显微镜(日本Olympus公司);激光共聚焦显微镜(德国Leica公司)。
本研究通过MO基因敲降技术和单细胞显微注射技术构建斑马鱼脑出血模型。对照组为正常野生型AB品系斑马鱼,予以注射Control MO,Control MO是指大小为25 bp的分子片段,不会与斑马鱼体内的任何基因碱基配对,也不影响mRNA的翻译过程。实验组在AB斑马鱼胚胎单细胞时期分别注射NCDCs发育相关基因的MO,包括col8a1 MO、tfap2α MO、msx1a MO、msx2 MO、dkk1a MO等。MO是一种通常大小为25 bp的分子片段,吗啡基可以替代天然核苷酸中的核糖基进行碱基互补配对,但不会被DNA酶或RNA酶识别和降解,具有很强的稳定性。根据互补配对原则设计的MO可反义结合靶基因的mRNA或pre-mRNA,阻止该mRNA的翻译或剪接过程,造成该基因编码的蛋白水平下调,从而发挥基因功能敲降的作用。
单细胞显微注射操作时,首先将开好针尖的注射针固定于持针仪上;其次,清洗干净收集到的胚胎,在显微镜下选取单细胞期胚胎;然后,于细胞与卵黄的交界处进行注射,每个胚胎的MO注射含量为4~8 ng,总注射体积为1~2 nl;最后,将注射后的胚胎立即转入干净的培养皿中,并置于28 ℃升温培养箱中培养。
白光视野下的模型验证可通过显微镜直接观察得到。为了更清晰地观察到斑马鱼脑出血的部位,选用Tg(flk1:GFP;gata1:dsRed)双转基因斑马鱼为研究对象,该转基因鱼用绿色荧光蛋白(GFP)标记血管内皮细胞,用红色荧光蛋白(dsRed)标记血红细胞。在斑马鱼胚胎单细胞时期,对照组依然予以注射Control MO,实验组注射col8a1 MO,正常培养至受精后48 h通过激光共聚焦观察红细胞渗漏情况,验证斑马鱼脑出血模型构建效果。
为观察BBB渗漏情况,并对渗漏情况进行统计,本研究用Dextran-Rhodamin和DAPI染料来构建斑马鱼脑出血的BBB模型。收集单细胞时期Tg(flk1:GFP)转基因斑马鱼胚胎,对照组依然予以注射Control MO,实验组注射col8a1 MO。正常培养至受精后2 d挑选脑出血的胚胎进行培养,在受精后3 d用100 mg/ml的tricaine麻醉幼鱼,经基底静脉注射Dextran-Rhodamin和DAPI混合液,1 h后用共聚焦显微镜拍照观察幼鱼脑血管渗漏情况。由于斑马鱼脑血管生长开始于受精后24 h左右,至受精后48~72 h新生血管较易出血,因此本研究在受精后48~72 h观察斑马鱼脑出血情况。
斑马鱼BBB渗漏的DAPI数目和染料渗漏荧光强度用Image J进行统计学分析。所有数据采用GraphPad Prism 6软件(GraphPad software)进行统计学分析。正态分布的连续变量以表示,采用独立样本t检验进行两组间比较。计数资料采用例数(%)表示,采用χ²检验。双侧检验,检验水准取α=0.05。
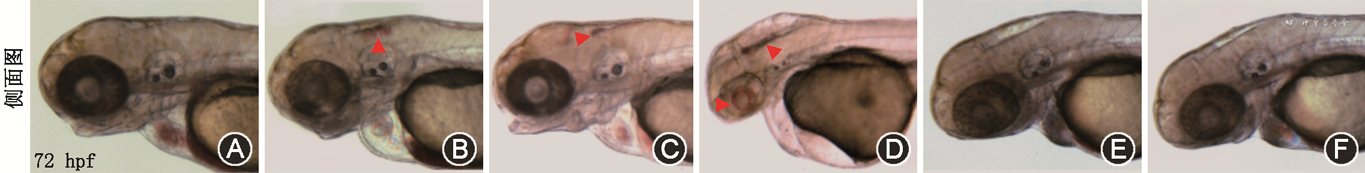
注射Control MO正常野生型AB品系斑马鱼组几乎没有脑出血现象(图1A)。与注射Control MO组相比,注射col8a MO、tfap2α MO和msx1a MO正常野生型AB品系斑马鱼组均有明显的脑出血现象(图1B~1D),msx2 MO、dkk1a MO组极少观察到脑出血现象(图1E、1F)。各NCDCs相关基因MO注射后的脑出血情况统计见表1。

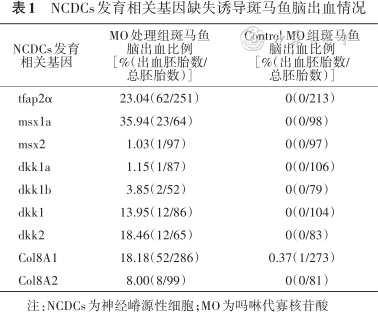
NCDCs发育相关基因缺失诱导斑马鱼脑出血情况
NCDCs发育相关基因缺失诱导斑马鱼脑出血情况
| NCDCs发育相关基因 | MO处理组斑马鱼脑出血比例[%(出血胚胎数/总胚胎数)] | Control MO组斑马鱼脑出血比例[%(出血胚胎数/总胚胎数)] |
|---|---|---|
| tfap2α | 23.04(62/251) | 0(0/213) |
| msx1a | 35.94(23/64) | 0(0/98) |
| msx2 | 1.03(1/97) | 0(0/97) |
| dkk1a | 1.15(1/87) | 0(0/106) |
| dkk1b | 3.85(2/52) | 0(0/79) |
| dkk1 | 13.95(12/86) | 0(0/104) |
| dkk2 | 18.46(12/65) | 0(0/83) |
| Col8A1 | 18.18(52/286) | 0.37(1/273) |
| Col8A2 | 8.00(8/99) | 0(0/81) |
注:NCDCs为神经嵴源性细胞;MO为吗啉代寡核苷酸
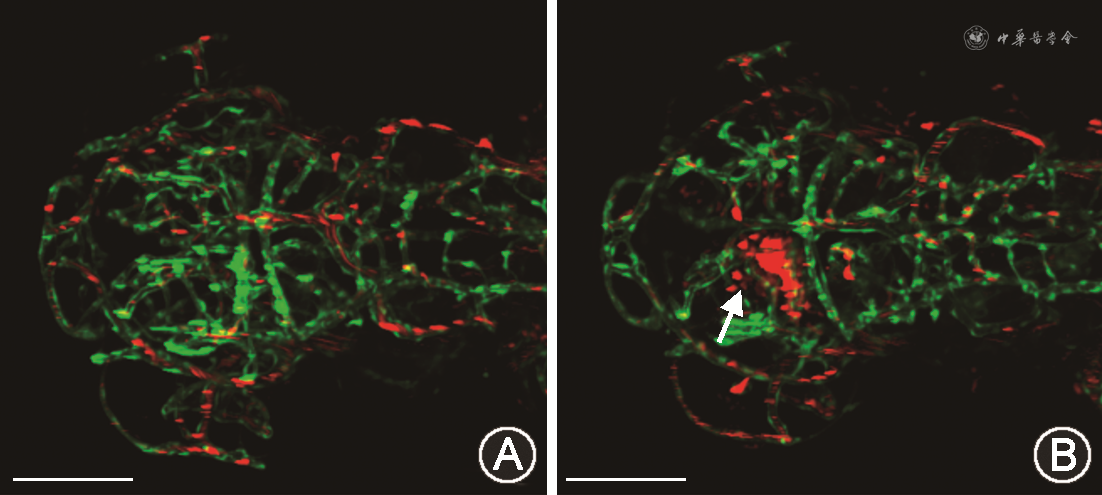
荧光视野下观察到,注射了Control MO的Tg(flk1:GFP;gata1:dsRed)双转基因斑马鱼胚胎中红细胞分布在血管以内,荧光视野下观察到的红细胞渗漏现象发生率为0.37%(1/273);而注射col8a1 MO的Tg(flk1:GFP;gata1:dsRed)双转基因斑马鱼胚胎中红细胞溢出血管,在脑实质中堆积(图2),荧光视野下观察到的红细胞渗漏现象发生率为18.18%(52/286)(χ2=51.65,P<0.001)。

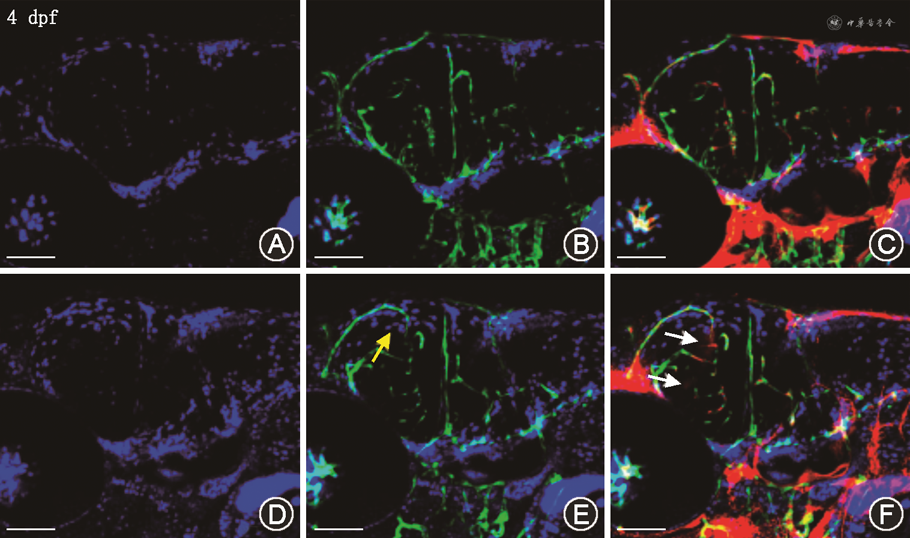
注射了Control MO的Tg(flk1:GFP)转基因斑马鱼胚胎脑血管外周很少有DAPI染料的渗漏,DAPI阳性的细胞核数为(10.05±5.27)个;而在注射了col8a1 MO的发生脑出血的Tg(flk1:GFP)转基因斑马鱼胚胎脑血管外周则有明显的DAPI染料渗漏,DAPI阳性的细胞核数为(60.35±3.96)个,两组比较差异有统计学意义(t=2.57,P<0.001)。
注射了Control MO的Tg(flk1:GFP)转基因斑马鱼胚胎脑血管外周很少有Dextran-Rhodamin染料的渗漏,Dextran-Rhodamin染料渗漏引起的中脑实质荧光示踪强度值仅为2.54±4.70;而在注射了col8a1 MO发生脑出血的Tg(flk1:GFP)转基因斑马鱼胚胎脑血管外周则有明显的Dextran-Rhodamin染料渗漏,Dextran-Rhodamin染料渗漏引起的中脑实质荧光示踪强度值达到5.13±3.52,两组比较差异具有统计学意义(t=2.54,P<0.001)(图3)。

BBB的构成单元在维持其功能方面发挥了关键的作用,若内皮细胞、周细胞和星形胶质细胞发生结构和功能变异,可导致其完整性和通透性发生改变[7, 8],影响脑内物质与能量代谢平衡,加之危险因素的作用,从而诱发脑出血[9]。研究发现,在斑马鱼脑血管发育过程中,在受精后24 h左右NCDCs和间充质细胞开始分化为周细胞,发育至受精后5 d时周细胞已全部形成。来源于NCDCs的周细胞异常是发生脑出血的原因之一[10],因此本研究对NCDCs发育相关的基因进行筛选构建斑马鱼脑出血模型。从实验结果可以看出调控NCDCs发育的一部分基因的敲降诱导严重的脑出血,还有一些相关基因的敲降并不能诱导斑马鱼脑出血,这些结果表明并非所有与NCDCs发育相关基因的缺失都会引起脑出血的发生,进一步强调了构建脑出血模型的重要性。
为了观察脑出血部位,本研究运用Tg(flk1:GFP;gata1:dsRed)转基因鱼,将脑血管和血红细胞区分开来,使结果更加直观准确,本模型使大规模筛选脑出血相关基因并对其作用进行验证提供了可能。
与其他动物脑出血模型相比,本研究所构建的斑马鱼脑出血模型具有以下优势:(1)实验周期短。斑马鱼受精后24 h血管开始同步发育,受精后48 h通过传统光学显微镜在白场下可直接观察斑马鱼脑出血情况。(2)斑马鱼胚胎全身透明,便于观察。Tg(flk1:GFP;gata1:dsRed)转基因斑马鱼的透明胚胎在激光共聚焦显微镜下可以清楚地观察到血管及出血情况。(3)方便染料的注射和观察。注射DAPI等荧光染料到Tg(flk:GFP)等标记血管的转基因斑马鱼中可以对BBB完整性进行定量分析。
斑马鱼由于血管结构易观察、基因和药物靶点相对保守、可进行高通量表型筛选等优势[11],有利于研究者对诱导脑出血的遗传因素进行更为全面地剖析,因此成为较为理想的脑血管病遗传分子学研究模式生物。基于此,本研究构建的斑马鱼脑出血模型可以结合人类脑出血性卒中的患者样本探讨BBB相关的基因在脑出血中的作用和分子机制,以加深对脑出血发病机制的理解,为筛选人脑出血相关基因奠定基础。
所有作者均声明不存在利益冲突



























