
慢性腹泻为消化科患者的常见主诉,按其发病机制可有多种类型,而嗜酸性粒细胞胃肠炎为其少见病因。患者50岁男性,因腹泻2年余,加重10个月余入院。患者禁食后腹泻减轻,辅助检查示贫血、维生素及矿物质缺乏、脂肪吸收不良和D-木糖吸收试验异常,胃排空延迟。患者最终通过胃肠镜黏膜病理诊断嗜酸性粒细胞胃肠炎,而糖尿病自主神经病变可能促进了腹泻的发生。经糖皮质激素治疗后患者病情缓解。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
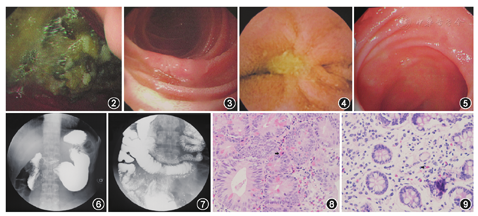
患者男,50岁。因"腹泻2年余,加重10个月余",2013年12月25日收入我院消化科。患者2011年9月中旬于外地进食海鲜后当日呕吐胃内容物数次,排黄色稀水样便10余次,无腹痛、发热、淋巴结肿大,禁食1 d后症状缓解。2011年10月初无明显诱因排糊状不成形黄色软便,每日5~6次,进食后加重。外院查胃镜示慢性浅表性胃炎;结肠镜检查正常;全消化道造影示胃排空延迟;腹部CT示盆腔肠管结构紊乱。临床诊断为"肠易激综合征",予以营养支持、益生菌后症状部分缓解出院。2013年初再次排黄色稀水样便,伴少量黄渣,每日20余次,进食饮水后腹泻加重,曾有便后心悸、头晕、跌倒。外院查血、尿、粪常规、生化均正常,血总IgE升高,过敏原筛查提示可疑鸡蛋白过敏,结肠镜示:回肠末端较密集黏膜下出血点,活检病理示黏膜慢性炎症。2013年12月我院门诊查粪常规、难辨梭菌毒素、炎症性肠病自身抗体谱、生长抑素受体显像,均正常。发病来体重下降31 kg。既往史:糖尿病病史5年,胰岛素及血糖控制欠佳。入我院体格检查发现体位性低血压,BMI 13.88 kg/m2,舌形态正常,腹软,肝脾不大。入院诊断:吸收不良综合征;淋巴瘤?;HBV携带状态;2型糖尿病。入院后完善实验室检查。血常规:白细胞4.64×109/L,嗜酸性粒细胞0.19×109/L,淋巴细胞1.02×109/L,Hb 88 g/L。粪常规:黄色稀糊便,2次便潜血阴性,1次便潜血阳性,WBC、RBC均为0个/高倍镜视野;粪便细菌、真菌、抗酸涂片及培养、寄生虫、轮状病毒均阴性。血生化:钾3.4 mmol/L,氯112 mmol/L,二氧化碳总量16.5 mmol/L,尿素氮8.91 mmol/L,葡萄糖11.4 mmol/L,肌酐130 μmol/L,白蛋白39 g/L,ALT 6 U/L,HbA1c 9.1%,血淀粉酶72 U/L;免疫球蛋白、超敏C反应蛋白及ESR均正常。HBsAg、抗-HBe、抗-HBc均阳性,血巨细胞病毒(CMV)-DNA阴性。癌胚抗原升高(7.24 μg/L),胃泌素水平正常。抗核抗体(ANA)、抗双链DNA抗体(抗ds-DNA)、抗中性粒细胞胞质抗体(ANCA)均阴性。评估消化及吸收功能:2次苏丹Ⅲ阴性,1次苏丹Ⅲ阳性;D-木糖吸收试验:0.5 g/5 h;叶酸1.8 μg/L,维生素B12>1 107 pmol/L,血清铁6.9 μmol/L,总铁结合力40 μmol/L,转铁蛋白饱和度0.162,铁蛋白644 μg/L;骨代谢指标:总钙2.10 mmol/L,血磷0.57 mmol/L,双羟维生素D 0.01 ng/L,均下降;甲状旁腺素正常。腹部增强CT及CT小肠重建:胰腺体尾部饱满,可疑强化略减低。CT小肠重建示小肠充盈欠佳,余未见明显异常(图1)。禁食试验:排粪便量由原每日10次,总量约1 700 ml减少为每日1次,总量约为30~200 ml。肌电图提示上下肢周围神经源性损害。胃镜:禁食6 h后胃内大量食物残渣潴留,十二指肠球后、降部绒毛显短,黏膜发白,降部后壁可见一处扁平隆起,稍充血,活检病理考虑腺管状腺瘤(图2,图3)。胶囊内镜可见十二指肠球部散在糜烂,空肠黏膜散在片状渗出样改变,伴轻度充血、绒毛稀疏(图4)。病理考虑回肠末端黏膜慢性炎,少部绒毛淋巴管扩张;直肠黏膜慢性炎。结肠镜见近回盲瓣开口处回肠绒毛似短缩,活检4块,质地软(图5)。患者每次内镜活检后均有一过性高热,予抗感染后好转。查胃排空时间:6 h钡条排出仅10%。全胃肠通过时间基本正常。胃电图结果正常。行口服小肠造影提示低张力胃,钡剂潴留在胃窦,改变体位后可顺利进入十二指肠,动态观察胃蠕动正常,小肠通过时间略快,未见憩室或瘘形成(图6,图7)。


孙晓红医师(消化内科) 患者为中年男性,慢性病程,主要表现为反复腹泻,禁食后好转,消瘦明显,伴贫血、维生素及矿物质缺乏、脂肪吸收不良和D-木糖吸收试验异常,初步诊断考虑吸收不良综合征,而该病的定位诊断应考虑:(1)腔内因素:胃排空或泌酸异常、肝分泌胆汁减少或胆道梗阻导致胆盐缺乏、胰腺癌或多发性内分泌腺瘤等导致胰酶缺乏、小肠细菌过度生长(small intestinal bacterial overgrowth SIBO)等;(2)黏膜因素:各种影响小肠黏膜绒毛的因素,如肠道感染、炎症性肠病、免疫缺陷病、成人乳糜泻、嗜酸性粒细胞性胃肠炎、淀粉样变等;(3)黏膜后因素:淋巴管和血液回流障碍因素,如淋巴系统发育不良、淋巴管扩张、淋巴管梗阻、淋巴瘤、肠系膜动脉粥样硬化或血管炎引起的血运障碍。该患者无胃肠道手术病史,不考虑手术所致胃酸分泌不足或肠道吸收不良。该患者无急性胰腺炎病史,胰腺CT未见胰管扩张、钙化等慢性胰腺炎或胰腺占位表现,故胰腺疾病证据不足。而惠普尔病相对罕见,该患者缺乏该病的肠外表现,且该病诊断需依靠病理。而广泛小肠淋巴瘤、肠结核、克罗恩病则因肠道黏膜破坏,多有粪潜血阳性,目前该类诊断暂无肠黏膜病理支持。该患者发病与饮食相关,结合年龄及病程,需除外成人乳糜泻。成人乳糜泻的相关麦胶蛋白抗体包括抗肌内膜抗体(EMA,IgA型)、抗组织转谷氨酰胺酶抗体(tTG,IgA、IgG型)、抗去酰胺基麦胶蛋白抗体(DGP,IgA、IgG型)。其中IgA型EMA和IgA型tTG的诊断准确性最高,而IgA型DGP和IgG型DGP因偶有假阳性出现,故其诊断准确性偏低,所以并不推荐用于疾病的初次筛查。以上抗体的滴度可用于治疗效果的随诊监测[1]。而成人乳糜泻的小肠肠道病理表现为上皮内淋巴细胞增多、黏膜低平伴萎缩、绒毛萎缩或消失[2]。
患者送检上述麦胶蛋白抗体谱,结果为阴性,回顾十二指肠及回肠末端黏膜病理并不符合成人乳糜泻病理改变。住院期间尝试去麦胶膳食2周,未观察到腹泻量明显变化。故成人乳糜泻不能诊断。
陈苗医师(血液内科) 患者以腹泻为主要表现,并有体位性低血压表现,追问病史,患者有性功能减退,考虑有多系统受累,是否存在系统性淀粉样变可能?但亦不能除外单纯消瘦所致体位性低血压及性功能减退可能。系统性淀粉样变的胃肠道表现可为腹胀、腹痛、腹水、肝脾大、吞咽困难、呕吐、便血或慢性腹泻,而由于淀粉样物质浸润胃肠道黏膜或SIBO,部分患者可表现为吸收不良。有研究纳入19例以吸收不良为主要表现的淀粉样变患者,结果显示多数患者以消瘦、腹泻为主要表现,部分可有纳差、眩晕或体位性低血压,中位生存期仅为11个月[3,4]。而淀粉样变的胃肠道内镜表现可为息肉,皱襞粗大,黏膜小出血点、糜烂、质脆,黄白色结节样病灶,蠕动减少,壁增厚,胃窦部黏膜下肿物等,但上述表现并不特异[5,6]。20%系统性淀粉样变患者可存在混合性感觉及运动外周神经病变,15%患者存在自主神经功能病变,后者可表现为胃肠道、膀胱功能障碍或体位性低血压。似乎系统性淀粉样变可解释患者病情的全貌,但该诊断需要活检病理结果证实。
但该患者无巨舌、肝脾大表现,入院后送检血免疫固定电泳未见M蛋白,尿游离轻链水平、骨髓穿刺及活检结果正常,超声心动图检查未见浸润性心肌病变,送检腹壁脂肪、直肠黏膜及十二指肠黏膜活检:刚果红染色回报均阴性。故系统性淀粉样变不能诊断。
朱丽明医师(消化内科) 患者不能诊断成人乳糜泻和系统性淀粉样变。而患者每次内镜检查后均一过性发热,抗感染有效,考虑与活检后细菌入血有关,结合患者肠道绒毛短缩,提示存在胃肠道黏膜屏障功能减退,而小肠黏膜绒毛短缩常见于慢性黏膜细菌感染所致黏膜破坏,如致病性肠杆菌属感染[7]。患者常规粪便培养均为阴性,是否患者存在SIBO可能?SIBO系指远端肠道菌群易位进入小肠,引起小肠内细菌过度生长,导致腹胀、腹泻、营养吸收不良等临床表现的综合征。SIBO诊断标准为:吸取小肠液进行细菌培养,小肠内容物细菌数>105 efu/ml。临床上也可用CO2呼气试验及氢呼气试验筛查SIBO。而上述检查在我院尚未开展,且患者住院期间因胃镜提示幽门螺杆菌感染,后予含替硝唑的抗幽门螺杆菌方案治疗2周,期间腹泻无缓解,故SIBO诊断难以确定。该患者病前有食物过敏史,需明确胃肠道黏膜病理是否存在嗜酸性粒细胞胃肠炎(eosinophilic gastroenteritis, EG)可能。
胡明明医师(内分泌科) 患者有长期未控制的糖尿病,肌电图提示上下肢周围神经源性损害,有胃排空延迟,口服小肠造影提示低张力胃,改变体位后胃内容物可顺利进入十二指肠,动态观察胃蠕动正常,胃电图正常,故考虑患者存在胃排空障碍,推测其原因:一为患者体形过瘦,缺少肠系膜脂肪进而导致低张力胃;二为高血糖所致自主神经病变及胃肠道激素异常。糖尿病患者小肠通过时间可延长或缩短,前者可引发SIBO进而腹泻,后者可因小肠推进性蠕动增强而腹泻,该患者小肠造影提示小肠通过时间略快,推测糖尿病自主神经病变可能促进了腹泻的发生。故建议该患者使用胰岛素,严格控制血糖达标。
钟定荣医师(病理科) 回顾患者病史,患者发病前曾进食海鲜,外院曾查血总IgE水平升高,可疑鸡蛋白过敏,属过敏性疾病易感人群。患者胃镜活检病理示十二指肠黏膜在管状腺瘤的基础上,固有层中嗜酸性粒细胞明显增多(>20个/高倍视野,图8),部分绒毛淋巴管扩张。结肠镜可见回肠末端较密集黏膜下出血点,结肠镜活检病理示黏膜慢性炎症,其中末端回肠黏膜内有散在嗜酸性粒细胞浸润(图9)。以上符合过敏性疾病肠道病理表现,提示存在EG可能,与食物过敏相关[8]。
患者入院后复查血总IgE水平升高(92 kU/L),除外寄生虫感染、肿瘤、血管炎类疾病后,予患者仅进食肠内营养制剂,并加用氢化可的松琥珀酸钠200 mg/d静脉输液治疗,患者每日总排便量减至200~400 ml糊状便,体重逐渐由46 kg增至55 kg。3周后氢化可的松琥珀酸钠减量为150 mg/d,1周改为口服泼尼松35 mg/d,3个月后逐渐减量至5 mg/d维持,总疗程半年后停用泼尼松。采用序贯法逐个排除可能引起致敏的食物,逐渐过渡为正常饮食,并口服补充碳酸氢钠、叶酸、碳酸钙D3咀嚼片及肠道益生菌。针对绒毛淋巴管扩张的病变,烹调油选用中链甘油三酯。患者腹泻逐渐减停,体重稳定。本例最终确定诊断:吸收不良综合征,EG。
EG临床表现无特异性,腹痛、腹泻是最常见的临床表现。主要特点与组织学分型有关,累及黏膜层者可表现为蛋白丢失性肠病、粪便隐血阳性、吸收不良综合征,累及肌层者可导致胃肠道完全或不完全性梗阻,累及浆膜层时合并腹水。Leinbach和Rubin[9]曾提出EG的诊断标准:(1)进食特殊食物后出现胃肠道症状及体征;(2)周围血中有嗜酸性粒细胞增多;(3)病理活检证实胃肠道黏膜有嗜酸性粒细胞增多或浸润;(4)应除外寄生虫感染和胃肠道外嗜酸性粒细胞增多的疾病。值得一提的是,20%的EG患者外周血嗜酸性粒细胞绝对值不高[8],而超过50%的患者存在遗传性过敏性体质或食物过敏史,提示该病为机体对过敏原的局部或全身变态反应。尚未有报道EG患者存在胃排空障碍,且EG与糖尿病并不相关,故推测该患者的胃动力异常并非EG所致。EG治疗方面可采用避免进食大豆、面粉、谷物、鸡蛋、牛奶、花生和海鲜类食物6周,后采用序贯法逐个排除可能引起致敏的食物,若效果欠佳可考虑加用糖皮质激素,色苷酸钠、富马酸酮替芬、孟鲁司特,对部分患者有效[10,11]。



























