
淋巴管平滑肌瘤病(LAM)是一种少见的系统性低度恶性肿瘤性疾病。LAM合并乳糜肺炎较为少见,易误诊、漏诊。本文报道1例LAM合并乳糜肺炎,患者胸部CT示双肺散在小圆形囊状透亮影、斑片影、磨玻璃影。血清血管内皮生长因子D(VEGF-D)11 370.2 ng/L,痰乳糜试验阳性。腹部CT示腹膜后可见多发低密度团块影。予西罗莫司维持治疗(血药浓度5~10 μg/L),随访18个月,患者症状改善,肺部病变、腹部病变逐渐吸收,血清VEGF-D水平降至3 231.9 ng/L。胸部CT示肺部出现小叶间隔增厚,磨玻璃影、斑片影等影像学表现时,需考虑乳糜肺炎可能;VEGF-D对该病的诊断和疗效评估具有重要意义;西罗莫司对LAM合并乳糜肺炎疗效显著,但其长期使用的有效性、安全性需进一步探究。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
淋巴管平滑肌瘤病(LAM)是一种罕见的系统性低度恶性肿瘤性疾病,与LAM细胞增殖、播散导致的肺部囊状病变、胸部和/或腹部乳糜液蓄积、腹部肿瘤(血管平滑肌脂肪瘤与淋巴管平滑肌瘤等)相关[1]。LAM可散发或与结节性硬化症(TSC)相关,TSC是一种与癫痫、认知受损、多器官肿瘤相关的遗传性肿瘤疾病[2]。LAM细胞增殖的分子基础可能为TSC1/TSC2基因突变后导致哺乳类雷帕霉素靶蛋白(mTOR)过度活化[1]。LAM几乎仅发生于成年女性,约5/100万,但在成年男性及儿童中亦有报道[3]。LAM患者肺功能下降速度可明显超过年龄相关的下降速度,达到2~4倍甚至更多,常出现活动后呼吸困难[1]。LAM患者胸部CT表现为多个薄壁圆形囊腔,易发生气胸及乳糜性胸腔积液[2]。LAM患者出现乳糜痰、乳糜肺炎并发症者较为少见。现报道1例淋巴管平滑肌瘤合并乳糜肺炎并文献复习。
患者女性,32岁。因咳嗽咳痰1年,气喘半年,加重1周于2017年4月12日入院。2016年4月起患者无明显诱因出现咳嗽咳痰,未予特殊治疗。2016年12月患者因气喘住院,胸部CT提示双肺散在小圆形透亮影,双肺散在斑片影,磨玻璃影。诊断间质性肺炎,予莫西沙星(0.4 g/d)及甲泼尼龙(40 mg/d)治疗7 d后出院,患者咳痰、气喘无明显改善。2017年4月初患者气喘加重,2017年4月5日门诊胸部CT提示双肺小囊状透亮影,小叶间隔增厚,双肺散在多发斑片影,磨玻璃影,右肺为重(图1),遂收住我科。体检:体温36.6℃,脉搏100次/min,呼吸20次/min,血压112/86 mmHg(1 mmHg=0.133 kPa)。双下肺听诊可闻及细湿啰音,心、腹体检未见明显异常。动脉血气分析:pH值7.40,动脉血氧分压(PaO2)56 mmHg,动脉血二氧化碳分压(PaCO2)32.6 mmHg,动脉血二氧化碳总量(TCO2)21 mmol/L,HCO3- 20.2 mmol/L,碱剩余−5 mmol/L,动脉血氧饱和度(SaO2)89%。实验室检查,白细胞计数6.14×109/L,红细胞计数4.79×1012/L,血红蛋白144.0 g/L,血小板计数289×109/L;丙氨酸转氨酶18 U/L,天冬氨酸转氨酶15 U/L,肌酐58 μmol/L,尿素氮4.30 μmol/L,甘油三酯0.96 mmol/L,钾3.61 mmol/L,钠140.9 mmol/L,血糖4.20 mmol/L;凝血酶原时间14 s,凝血酶原活动度89%,活化部分凝血活酶时间33.1 s,凝血酶时间18.7 s,纤维蛋白原3.13 g/L,国际标准化比值1.08;红细胞沉降率(1 mm/1h)、超敏C反应蛋白(<0.1 mg/L)、白细胞介素-6(2.82 ng/L)、降钙素原(<0.05 μg/L)均在正常范围。风湿免疫相关抗体(包括抗核抗体、抗双链DNA抗体、抗nRNP抗体、抗Sm抗体、抗SSA抗体、抗SSB抗体、抗Scl-70抗体、抗Jo-1抗体、抗着丝点B抗体、抗组蛋白抗体、抗核小体抗体、抗核糖体P蛋白抗体、抗Ro-52抗体)、类风湿因子(<20 IU/ml)、抗中性粒细胞胞质抗体胞质型和核周型、抗角蛋白抗体、抗心磷脂抗体均阴性。肿瘤标志物[甲胎蛋白4.03 μg/L,癌胚抗原1.33 μg/L,糖类抗原125 14.1 U/ml,糖类抗原15-3 18.8 U/ml,糖类抗原19-9 24.70 U/ml,糖类抗原72-4 0.58 U/ml,鳞状细胞癌相关抗原0.4 μg/L,总人绒毛膜促性腺激素(β-hCG)<0.10 mIU/ml]均正常。心电图、心脏彩色超声未见异常。患者气喘明显,肺部囊状病变多,行肺功能检查易诱发气胸,风险较大,故未行肺功能检查。因患者为年轻女性,前期抗生素和糖皮质激素治疗效果不佳,胸部CT提示多发小囊性影,考虑LAM,故测血清血管内皮生长因子D(VEGF-D)水平为11 370.2 ng/L。痰乳糜试验(苏丹红染色)阳性。腹部CT提示,腹膜后可见多发低密度团块影(图2)。考虑LAM合并乳糜肺炎,予西罗莫司(2 mg,1次/d)治疗20 d后,查血药浓度为14.32 μg/L,将西罗莫司改为单日口服1 mg,双日口服2 mg,患者气喘症状明显改善后出院。继续西罗莫司维持治疗,定期复诊调整西罗莫司剂量(1~2 mg,1次/d),使其血药浓度维持在5~10 μg/L。2个月后复诊时,西罗莫司改为单日口服1 mg,双日口服2 mg,查血药浓度为8.62 μg/L;复查胸部CT示,肺部病变改善(图3A);腹部CT示,腹部病灶缩小(图3B)。8个月后复诊时西罗莫司口服1 mg,1次/d,查血药浓度为4.94 μg/L;复查胸部CT示,肺部病变较前好转(图4A);腹部CT示,腹膜后未见到明显病灶(图4B)。18个月后复诊时西罗莫司口服1 mg,1次/d,查血药浓度为4.78 μg/L;复查胸部CT示,肺部病变明显好转(图5A);腹部CT示,腹膜后未见到明显病灶(图5B)。自2017年4月开始使用西罗莫司后,患者血清VEGF-D水平逐渐下降,6个月后为4 607.1 ng/L,9个月后为4 142.8 ng/L,18个月后为3 231.9 ng/L。
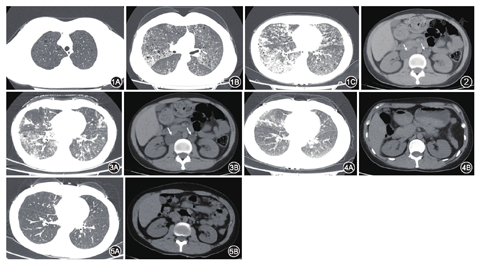

LAM患者胸部高分辨CT的特征性改变为多个薄壁圆形界限清楚的含气囊性病变[2]。除囊性病变外,可出现复发性气胸,常伴有乳糜性胸腔积液。本例患者初诊时其肺部CT除囊性病变外,还伴有斑片影及磨玻璃影,极易误诊。患者病程中无发热,血常规,C反应蛋白、白细胞介素-6、降钙素原等感染相关指标均正常,抗生素及糖皮质激素治疗效果不佳。使用西罗莫司后,患者症状好转,肺部斑片影及磨玻璃影吸收,增厚的小叶间隔恢复,结合痰乳糜试验阳性,提示患者肺部小叶间隔增厚及磨玻璃、斑片状病灶并非感染,应考虑乳糜瘀滞所致,可称之为乳糜肺炎。乳糜痰少见,除LAM外可见于淋巴管瘤、胸淋巴管扩张、黄甲综合征、白塞病及医源性损伤等[4]。痰液苏丹红染色、痰液甘油三酯检测、淋巴管造影等可用于乳糜痰检测[5]。其机制可能因为支气管树与并行淋巴管的结构异常,抑或乳糜胸合并支气管胸膜瘘[6,7]。LAM出现乳糜痰者少见,可能为3%~7%[8,9]。LAM患者中出现乳糜肺炎者较为少见,目前仅见2篇相关文献报道[10,11]。本例患者与文献[10,11]报道的2例患者均为女性,均有咳嗽咳痰,胸部CT除囊性病变外存在小叶间隔增厚,磨玻璃影、斑片影,西罗莫司治疗后咳嗽咳痰明显好转,肺部小叶间隔恢复,磨玻璃影、斑片影吸收,但肺囊性病变无明显变化。文献[10,11]报道的2例患者均曾因乳糜胸行胸膜固定术,术后才出现乳糜痰及乳糜肺炎,可能由于LAM细胞增殖导致胸导管阻塞影响淋巴回流,使淋巴液进入胸腔及纵隔,胸膜固定术后方使大量淋巴液进入肺淋巴管。本例患者不曾发生过乳糜胸,而出现乳糜肺炎。
LAM的诊断标准为特征性(>10个薄壁圆形界限清楚的含气囊性病变)或符合性(2~10个上述囊性病变)胸部CT表现,且肺活检符合LAM病理标准;或者特征性胸部CT表现及下述任何一项:肾血管肌脂瘤;胸腔或腹腔乳糜积液;淋巴管平滑肌瘤或淋巴结LAM受累;确诊或拟诊的TSC;血清VEGF-D水平高于800 ng/L[1,2,12]。2016年美国胸科协会联合日本呼吸学会制定的LAM诊断和管理临床指南中首次将血清VEGF-D水平高于800 ng/L纳入诊断标准,可有效避免患者接受不必要的有创检查[1,12]。血清VEGF-D主要来源于LAM细胞,仅在LAM患者中升高,在其他肺部囊性病变及不合并LAM的TSC患者并无显著升高[13]。其血清水平超过800 ng/L与肺活量进行性下降及残气量进行性增加有关[14]。VEGF-D水平高者肺部囊性病变更重,更多出现乳糜性胸腔积液、腹腔积液及淋巴管受累[15]。经西罗莫司治疗后,血清VEGF-D水平下降[16]。本例患者经西罗莫司治疗后,血清VEGF-D水平下降。
既往LAM的治疗有限,部分重度LAM患者甚至需要接受肺移植,占肺移植患者的1.1%,但因LAM的肿瘤特性,移植后肺部可重新出现LAM细胞[1,2,17]。自2016年美国胸科协会联合日本呼吸学会发布LAM诊断和管理临床指南后,西罗莫司成为首选药物,因其可抑制mTOR的活化,从而阻断LAM细胞增生[1]。对肺功能差或肺功能下降速度过快者、有症状的乳糜胸或乳糜腹者、肾血管肌脂瘤或腹膜后和盆腔淋巴管肌瘤者、TSC相关LAM者,可考虑使用西罗莫司,推荐血药浓度为5~15 μg/L[1,18]。西罗莫司治疗后,患者症状、生活质量改善,乳糜性胸腔积液和/或腹腔积液吸收,肺功能提高,血管肌脂瘤体积缩小[1,8,19]。本例患者使用西罗莫司治疗后腹膜后病灶几近消失,结合病史及影像学考虑腹膜后病灶为LAM细胞增殖、淋巴液瘀滞所致淋巴管平滑肌瘤。既往研究未提及西罗莫司对LAM患者乳糜肺炎的治疗效果。乳糜肺炎的一般治疗包括低脂饮食、化痰、支气管扩张剂等,严重者需要结扎、栓塞乳糜导管[5]。文献[10]报道的患者曾低脂饮食6个月未起到明显效果,经西罗莫司治疗后,本例患者及文献[10,11]报道的2例患者胸部CT示肺部增厚的小叶间隔改善,磨玻璃影、斑片影吸收,提示西罗莫司对LAM所致乳糜肺炎疗效良好。有研究发现,停用西罗莫司后患者肺功能再度下降[16],故目前认为除出现严重不良反应、妊娠等情况时,西罗莫司需长期使用[18]。然而,西罗莫司等mTOR抑制剂长期使用的有效性、安全性、最小维持剂量等均需进一步观察和研究。
总之,LAM合并乳糜肺炎较为少见,易误诊,临床医师需加强对本病的认识,VEGF-D对诊断、治疗评估有重要意义,西罗莫司对该病疗效显著。
所有作者均声明不存在利益冲突



























