
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
男性,28岁,因无明显诱因出现持续性上腹胀痛6 d于2015年12月23日入院。患者6 d前无明显诱因出现上腹部疼痛,呈持续性胀痛,有腰背部放射痛,伴恶心、呕吐,呕吐后腹痛无减轻,就诊于当地医院,检查血淀粉酶为8 504 U/L,三酰甘油为20.7 mmol/L。上腹部CT检查提示急性坏死性胰腺炎(胰周大量渗出),重度脂肪肝,胆囊结石。予胃肠减压、抑酸、抑酶、抗感染、补液、改善微循环等治疗措施后,患者症状无缓解而转至本院。入院时患者诉头晕、腹胀,言语欠清晰,伴烦躁不安。体检:心率133次/min、呼吸频率29次/min、血压143/92 mmHg(1 mmHg=0.133 kPa)、体温38.5 ℃,体重指数33.4 kg/m2,心肺听诊未及异常,腹部膨隆,有压痛,无反跳痛及肌紧张,肠鸣音0次/min。实验室检查:白细胞计数13.67×109/L、中性粒细胞百分比81.7% 、血红蛋白115 g/L 、血小板计数204×1012/L; ALT 54 U/L、AST 71 U/L、尿素26 mmol/L、血清肌酐132 μmol/L、血糖浓度20.7 mmol/L、血钙浓度1.67 mmol/L、乳酸脱氢酶1 744 U/L、乳酸3.86 mmol/L、三酰甘油15.27 mmol/L;尿常规示比重1.040、蛋白(+)、红细胞计数5.3个/高倍视野、管型计数0.63个/低倍视野、病理管型1.35、酮体(-)。入院诊断:(1)急性胰腺炎(中度重症、高脂血症性)伴急性肾损伤、胰性脑病可能;(2)脂肪肝;(3)胆囊结石。
入院后给予禁食、胃肠减压、抑酸、抑酶、芒硝外敷、生大黄灌肠、小剂量呋塞米利尿及抗感染等治疗。入院2 d后在鼻胃镜引导下置入空肠营养管,予短肽型肠内营养剂125 g/d及非诺贝特0.2 g(1次/晚),血脂康0.6 g(3次/d)降血脂治疗。经过上述治疗后,患者每日尿量为2 000 ml左右,诉腹胀稍好转,但仍有发热,体温波动于38.0~39.0 ℃。2015年12月29日患者出现胸闷、气急,指尖PO2<90%,动脉血气提示pH值7.354、PO2 147.5 mmHg、PCO2 40.9 mmHg,尿素27.9 mmol/L、血清肌酐186 μmol/L、三酰甘油4.07 mmol/L,当日突发尿量减少至550 ml/24 h,考虑肾损伤加重,给予床旁血液滤过治疗,尿液呈酱油色,次日出现无尿(40 ml/24 h)、肌酐384 μmol/L,考虑急性肾功能衰竭。2016年1月3日患者诉双下肢近端酸痛合并感觉丧失,血液滤过液呈红葡萄酒样,急查血液肌酸磷酸激酶为200 947 U/L、肌红蛋白614.7 μg/L、乳酸脱氢酶3 378 U/L、三酰甘油11.24 mmol/L,考虑横纹肌溶解综合征(rhabdomyolysis,RM)。予停用降脂药物,同时给予补液、碱化尿液及血液滤过治疗,肌酸磷酸激酶逐渐恢复正常,但仍持续无尿。2016年1月13日患者突发高热,体温39.5~40.0 ℃,予美罗培南抗感染,同时加强补液、抗炎等相关治疗,患者体温下降不明显,考虑胰腺坏死感染可能。
2016年1月15日在CT引导下行胰周脓肿经皮穿刺引流术,置入长25 cm、直径16 F单猪尾引流管2根,穿刺液培养为铜绿假单胞菌。此后患者体温稍下降,1个月后患者再次出现高热,伴有血压下降,联合使用去甲肾上腺素、多巴胺等血管活性药物维持血压。复查血常规示白细胞计数19.7×109/L、中性粒细胞百分比89.8%,血清降钙素原20.94 μg/L;腹部CT检查提示胰周仍有大范围脓肿(图1)。经胰腺外科等多学科会诊认为患者目前肾功能衰竭尚未恢复,且伴有感染性休克,手术风险高,建议行内镜下治疗。遂于2016年2月25日在内镜引导下行经皮内镜胰周脓肿清除术。气管插管麻醉成功后,患者仰卧位,取原腹部左侧引流管窦道,使用经皮肾镜皮肤扩张器将窦道口扩至1 cm,置入直径12 mm Trocar,置入电子胃镜,可见腹膜后大量坏死组织及脓液(图2),用网篮及三爪钳清除坏死组织,术毕置入双套管引流。此后患者体温仍有波动,于2016年3月8日及17日再次行经皮内镜胰周脓肿清除术,经治疗后患者体温恢复正常,复查降钙素原为0.747 μg/L,CT检查提示胰周脓腔基本消失。此后患者尿量逐渐增加,至2周后尿量>2 000 ml/d,先后拔除腹腔引流管、血液滤过置管和空肠营养管,于2016年5月12日痊愈出院。
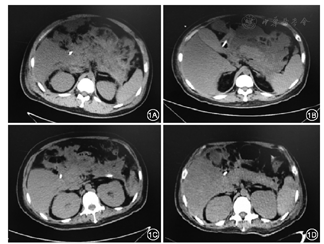

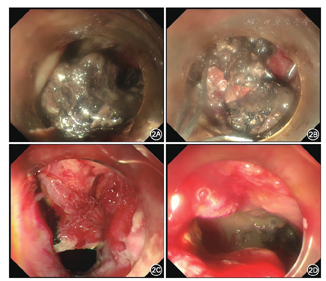

本例患者在病程中出现急性胰腺炎的两个严重并发症:(1)急性肾功能损伤基础上发生RM并导致急性肾功能衰竭,无尿时间持续3个月(2015年12月30日至2016年3月30日);(2)胰腺坏死组织感染持续2.5个月(2016年1月13日至3月30日)。上述两种严重并发症分别可导致50%和30%的病死率,治疗过程中涉及肾内科指导下的肾功能维持、放射医学科实施的CT引导下经皮穿刺引流和胰腺外科指导下的经皮内镜脓肿清除术,最终患者救治成功,充分体现出多学科协作的优势。
本例患者的肾功能衰竭由RM引起,RM指横纹肌细胞受损后细胞膜的完整性受到破坏,细胞内一些蛋白、离子、酶等物质释放入血,使血清肌红蛋白、肌酸磷酸激酶等异常上升,损伤的肌肉组织水肿挤压局部血管引起循环低血容量、肌红蛋白阻塞并损害肾小管、血管活性物质引起肾脏缺血和肾小球滤过率下降等原因导致急性肾功能损伤[1,2,3]。RM多发生于肌肉受到大力撞击、长时压迫或过度使用之后,也可由某些特殊药物诱发[4]。本例发生RM的原因可能是药物(非诺贝特、血脂康)、代谢异常、感染、高热等协同作用的结果。降脂药引起RM已有较多报道,目前发现多由他汀类降脂药引起[5,6]。非诺贝特基本通过肾脏排泄,其常规剂量对肾功能不全的患者来说可能剂量相对过大[7,8],对肾功能正常患者,单独应用非诺贝特引起的RM病例的报道很少[9]。提示肾功能不全患者应用非诺贝特时应慎重并适当减量,用药时应注意监测血清肌酸激酶,防止发生RM。血脂康成分中也含有天然复合他汀类成分,他汀类药物与贝特类药物联用时将增加RM发生的危险。
急性胰腺炎后期的感染是对患者而言的"二次打击",如果治疗中未能彻底清除胰腺坏死感染病灶,随后发生多器官功能衰竭的概率>90%[10]。因此,一旦发现感染迹象,需要及时干预。确诊胰周脓肿的方法包括穿刺获得的胰腺或胰周坏死组织的细菌培养阳性、增强CT检查发现"气泡征"[11]。本例经皮穿刺引流后,效果欠佳,需要"升阶梯"治疗。通过联合我院胰腺外科、肾内科及放射科,我们开展了首例经皮穿刺和内镜清创这两种微创方法循序加强的治疗方法。"升阶梯"疗法在国外已被广泛推荐用于胰腺感染的治疗,一方面提倡在感染早期先建立引流通道,控制局部感染对全身情况的影响,避免感染时间长引发的脓毒症休克和多器官功能损伤;另一方面,阶梯清创方法可以根据脓腔部位、范围等提供多个微创引流腔道(如CT引导下经皮后腹膜穿刺置管引流、腹腔镜下经皮或经胃壁后腹膜清创、内镜下经皮、胃后壁或十二指肠壁后腹膜清创等),提高了清创效率,避免了长时间单一治疗引起的不良事件[12,13,14,15,16]。
国内目前"升阶梯"疗法的临床经验还较少,大部分是外科专家采用经皮的硬镜(如肾镜、腹腔镜)来完成,而软镜(胃镜)有其先天优势,可以循腔进镜,容易达到硬镜所不能到达的部位。在手术操作的过程中,需要胰腺外科团队对术中腹腔器官解剖加以确认,并为术中不可预见的出血做好准备。目前对重症急性胰腺炎的救治更强调多学科协作,在出现感染坏死性胰腺炎后,多科参与诊治,但总体方向是微创。目前常用的微创手术入路包括:(1)经胃入路:此方式内镜医师常用,但经胃手术增加了额外创伤且患者进食时间会延迟;(2)经腹膜后入路:此方式对腹腔干扰小,目前最为常用,也是最佳路径。但行腹膜后入路手术,需与影像科充分沟通,避开消化道以保证安全。就该患者而言,在出现感染迹象后,经皮穿刺置管引流治疗并未使患者的感染得到完全控制。胃镜的清创能力有限,但可以到达一些硬镜不能到达的复杂脓腔,肾镜下视野更为开阔,可以使用腹腔镜下器械经由工作通道进行胰腺坏死组织清除。腹腔镜手术可经腹腔或腹膜后小切口进行,同样具有很好的坏死组织清除能力。可考虑将软镜与硬镜结合起来,发挥各自优势,可能具有更好效果。
综上所述,本例患者经皮内镜胰周脓肿清除术取得成功,是多学科团队协作救治的成果,对于推广重症急性胰腺炎的救治新方法,探索急性胰腺炎的救治新模式有积极意义。


























