
随着全直肠系膜切除术和新辅助放化疗的广泛应用,中低位直肠癌患者的预后明显改善。近年来随着腹腔镜和机器人手术系统等微创技术应用于直肠癌根治性手术,以及肿瘤分子标志物和基因测序技术的发展,直肠癌治疗已进入个体化精准医疗时代。在这样的时代背景下,关于中低位直肠癌侧方淋巴结清扫必要性的争议愈发引人注目,其包括与新辅助治疗的关系,侧方淋巴结清扫的手术指征、范围及神经保护等多个方面。作为进展期中低位直肠癌重要治疗手段,直面争议,增加侧方淋巴结清扫相关循证医学证据是当务之急。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
对发生侧方淋巴结转移的中低位直肠癌进行侧方淋巴结清扫始于20世纪中叶。但由于清扫范围解剖结构复杂且深窄,淋巴结毗邻重要血管及神经束,清扫具有相当高的难度和风险,易引起性功能、排尿功能障碍或出血等较严重的并发症,因此即使进入微创和个体化精准医疗时代,中低位直肠癌侧方淋巴清扫仍在世界范围内存在较大的争议,东西方学者对其态度也有所不同[1,2,3,4]。本文结合实践经验和循证医学证据,通过讨论如何合理地选择侧方淋巴结的治疗策略,是否进行侧方淋巴结清扫及其清扫范围,微创手术的侧方淋巴结清扫等问题,探讨中低位直肠癌侧方淋巴结清扫的临床价值。
直肠癌侧方淋巴结转移途径的研究,最早可追溯至19世纪末西方学者对直肠淋巴回流的上、中(侧方)、下理论,其中的中间回流方向为沿直肠中动脉至髂内动脉分支上行,但侧方淋巴回流的淋巴结定位模糊,认为在直肠中动脉根部结扎或者沿着髂内动脉沿线分离就可完成直肠癌侧方淋巴结清扫。此后,日本学者采用色素注射法对直肠淋巴回流进行了形态学研究,并据此进行了东亚最早的直肠癌侧方淋巴结清扫。至20世纪中叶,基本形成了直肠侧方淋巴回流的解剖学理论体系,即淋巴管通过侧方沿着髂内动脉分支回流至髂内动脉周围及髂总动脉周围的淋巴结,进而回流至腹主动脉周围淋巴结。侧方回流是中低位(或腹膜反折以下)直肠和肛管淋巴回流的重要途径。直肠的侧方淋巴结回流大致可分为3个方向:(1)向前外侧沿膀胱上动脉、膀胱下动脉、闭孔动脉到髂外动脉内侧缘的淋巴结;(2)向外侧沿直肠中动脉至髂内血管周围淋巴结,然后经髂总淋巴结上行至腹主动脉旁淋巴结;(3)向后沿骶中动脉和骶外侧动脉入骶淋巴结,再向上至腹主动脉分叉处淋巴结[5]。日本结直肠癌学会(Japanese Society for Cancer of the Colon and Rectum,JSCCR)的指南中又将侧方淋巴回流细分为5个区域,分别为髂总血管区、髂内近端血管区、髂内远端血管区、闭孔区及髂外血管区(图1)[5]。这些淋巴回流区域是侧方淋巴结转移的主要部位,也是理论上进行侧方淋巴结清扫的手术范围。
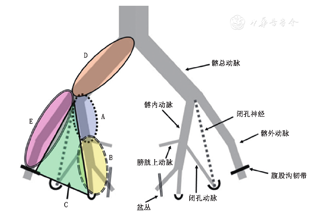

A示髂内近端血管区,B示髂内远端血管区,C示闭孔区,D示髂总血管区,E示髂外血管区
然而,对于侧方淋巴结清扫的必要性东西方学者的态度明显不同。许多西方学者认为,侧方淋巴结转移(髂内淋巴结除外)属于远处全身转移,即使手术行完全性清扫,预后仍然很差,反而可能增加术中及术后副损伤。最新的AJCC第8版分期系统中指出,侧方淋巴结中仅有髂内动脉周围淋巴结被定义为直肠癌的区域淋巴结,纳入N分期进行考量,髂外动脉和髂总动脉周围淋巴结转移则考虑为M1a期,临床分期至少为ⅣA期,即为远处转移。NCCN、ESMO等颁布的相关诊疗指南中均推荐将新辅助放化疗+标准化全直肠系膜切除术作为进展期直肠癌的标准治疗模式,而不建议单纯手术行预防性侧方淋巴结清扫。
在2019年JSCCR颁布的最新版《大肠癌处理规约》中,将直肠癌侧方淋巴结中的髂总、髂内、髂外及闭孔动脉周围等处淋巴结视为区域淋巴结,作为N3期考量的范围。JSCCR的指南中明确描述了侧方淋巴结清扫的适应证:腹膜反折以下的直肠肿瘤,肿瘤浸润深度超过固有肌层,即T3~T4期;并推荐对腹膜反折以下直肠癌进行预防性清扫(Ⅱ类推荐,B级证据)。因此,日本学界一般认为,即使临床无侧方淋巴结转移证据,也应行预防性清扫,清扫双侧髂内、髂总、髂外及闭孔动脉周围等处淋巴结,术中保留盆腔自主神经。
对于上述东西方观点之差异,我们需客观看待。这种争论和争议不仅体现在侧方淋巴结清扫领域,在结肠癌诊治方面存在完整结肠系膜切除和D3淋巴结清扫的差异,在中低位直肠癌治疗方面存在对于经肛全直肠系膜切除术和机器人手术的争议等。东西方观点的差异,实际上源于从不同角度对同一种诊疗方法进行的实践和探讨,共同的出发点都是为了提高临床疗效,因此,未来都需要更多的循证医学证据的支持。
中低位直肠癌侧方淋巴结转移率各文献报道也存在着较大的差异。早期少数西方学者报告的侧方淋巴结转移率较低,仅为0.5%~1.9%,该数据应与早期手术方式不同及患者体形肥胖,侧方淋巴结完全清扫难度大有关。现在多数研究学者认可中低位直肠癌患者的侧方淋巴结转移率为10%~25%[6],其中T3期患者侧方淋巴结转移率为13.5%,T4期则为29.0%,而且常规检查无侧方淋巴结转移患者中仍有约4%存在隐匿转移灶[7]。另有文献报道,在所有危险因素中,直肠系膜内淋巴结转移与侧方淋巴结转移最相关,约30%直肠系膜淋巴结转移的直肠癌患者同时存在侧方淋巴结转移[8]。
侧方淋巴结清扫区域血管神经密布,对手术技巧的要求高,有术后发生严重并发症的风险。侧方淋巴结清扫可降低患者的术后局部复发率,但同时也可能损伤患者自主神经,造成排尿障碍和性功能障碍,这也是部分西方学者对此术式抱有怀疑态度的原因之一。因此,以日本学者为首的亚洲学者们相继提出保留单侧或双侧自主神经的侧方淋巴结清扫技术,使患者术后排尿功能障碍和性功能障碍都得到很大的改善[9,10],而且保留神经的手术并不降低生存获益。侧方淋巴结清扫的上述风险使手术指征的把握显得尤为重要,侧方淋巴结转移率成为重要的参考指标。中低位直肠癌东西方的不同定义、侧方淋巴结清扫术手术指征、侧方淋巴结清扫范围、术前是否行新辅助治疗等诸多因素,均影响着我们从有限临床样本中获得的侧方淋巴结转移率能否真实地反映总体。因此,在未来开展关于侧方淋巴结转移率的多中心大样本的可提供高级别循证医学证据的临床研究就显得尤为迫切。
腹腔镜和机器人手术技术的出现和逐步成熟,让外科进入了微创时代,这些技术在直肠癌侧方淋巴结清扫中也获得了尝试和推广[11]。同时,新辅助放化疗等辅助治疗手段的出现,为直肠癌侧方淋巴结转移的治疗提供了新的选择,同时也提出了新的问题。
微创侧方淋巴结清扫手术优点明显,如手术切口小、术中出血少、术后炎性反应轻等,特别是腔镜技术因视野清晰且具有放大效果,在狭窄骨盆手术中有助于保护盆腔自主神经,成为可推荐的手术策略。有研究结果支持腹腔镜手术方式可安全用于直肠癌侧方淋巴结清扫[12]。当然,腹腔镜手术也存在学习曲线长、器械无法弯曲、对助手要求较高的不足。而机器人手术系统的三维手术视野和手术器械腕部可旋转等优势,可更好地显露并保护盆腔自主神经,更容易在盆腔侧方的深窄空间进行操作。有研究结果显示,在保证肿瘤根治性的基础上,机器人与开腹侧方淋巴结清扫相比,术中出血量及围手术期并发症发生率方面可能存在优势[13,14]。机器人手术系统可能在侧方淋巴结清扫中发挥更大的作用,但尚需前瞻性大样本研究结果来证实[11]。
随着新辅助放化疗实践的不断深入,许多学者比较了新辅助放化疗+TME(西方模式)与TME+单纯侧方淋巴结清扫(日本模式)的效果,发现两者的无进展生存率和总体生存率差异均无统计学意义,而且新辅助治疗后患者的局部复发率明显降低[15]。但另有研究结果显示,对于局部进展期直肠癌患者,特别是影像学检查提示存在可疑侧方淋巴结转移者,即使接受新辅助放化疗,术后侧方淋巴结转移率仍为40%~64%[16]。
一项日本的多中心随机对照试验(JCOG0212研究)结果显示,单纯标准TME和TME+侧方淋巴结清扫的5年无复发生存率和5年总体生存率无明显差异,而侧方淋巴结清扫组的局部复发率明显降低(7.4%比12.6%)[17]。但这项研究的设计存在较大争议,其入组患者均未接受新辅助治疗,有明显的选择偏倚。另外,在排除了临床侧方淋巴结阳性(最小径>10 mm)的患者后,该研究侧方淋巴结清扫组术后局部复发率仍为7%左右,与文献[18]报道的新辅助治疗+TME的复发率类似。这提示对于侧方淋巴结可能存在转移的患者,无论单纯行预防性侧方淋巴结清扫或单纯行新辅助治疗,均有相当比例的患者发生局部复发,都不是完美的治疗策略。
侧方淋巴结转移的术前诊断依靠常规的病理学活检及细胞学检查难以实现,目前主要的手段仍是影像学检查。大多数学者支持将高分辨率MRI作为诊断侧方淋巴结转移的首选措施[19]。根据可疑侧方淋巴结的大小(长短径)、截面边界外形及内部MRI信号特征来判断侧方淋巴结转移与否。MRI弥散加权成像诊断侧方淋巴结可能有更高的灵敏度[20]。大多数学者推荐术前完善MRI薄层成像联合弥散加权成像的精准影像学检查,提高侧方淋巴结诊断准确率,并进行转移淋巴结的预测或判断,从而实施个体化选择性侧方淋巴结清扫。
CT检查受运动伪影及影像技术的影响小,有较高的空间分辨率,文献报道诊断侧方淋巴结转移的准确率可达77%[21]。考虑其价格低廉及操作简易,CT仍可作为监测及诊断直肠癌侧方复发的影像学检查。PET-CT对小淋巴结的诊断灵敏度低,不应作为常规诊断手段,但如果PET-CT显示淋巴结存在高摄取,对于判断放化疗后淋巴结是否转移有较大价值。此外,特异性造影剂超小型超顺磁性氧化铁胶样体等技术的应用也可能有助于提高阳性淋巴结的检出率。
虽然新辅助放化疗难以真正消除所有的侧方淋巴结转移,但治疗后淋巴结在影像学上均有一定程度的体积及信号变化。但淋巴结转移最大径界值的选择,各项研究结果为5~12 mm,存在很大差异[22,23,24]。提高最大径界值,尽管可提高阳性预测值但会降低阴性预测值,并且很难兼顾灵敏度、特异度及准确率;目前应用较多的界值是7 mm或10 mm。
我们和美国Chang教授、Malakorn教授等共同研究发现,对于接受标准新辅助治疗的中晚期直肠癌患者,影像学相关数据分析对提示侧方淋巴结的预后有重要意义:比较新辅助治疗前及治疗后1~2周MRI结果,侧方淋巴结最小径变化非常大[(12.6±9.5)mm比(8.5±5.4)mm];接受新辅助放化疗+标准TME+侧方淋巴结清扫的患者,39个月随访结果显示无局部侧方复发;新辅助治疗后的转移侧方淋巴结的最小径为5 mm,且病理学检查结果证实,最小径<5mm的侧方淋巴结均为阴性,最小径≥5mm者转移比例高达64.7%[25]。因此,我们提出以新辅助治疗后MRI淋巴结最小径5 mm作为淋巴结转移的推荐界值,建议对新辅助治疗后仍存在最小径≥5mm的侧方淋巴结的直肠癌患者,在标准TME的基础上加行同侧的侧方淋巴结清扫,即选择性侧方淋巴结清扫;对于新辅助治疗后最小径<5mm的侧方淋巴结则可严密观察随访。该研究结果在今年的美国结肠和直肠外科医师学会年会做了专题报告,得到世界范围内众多专家的关注和认可,有望为精准影像下侧方淋巴结治疗策略选择提供新的证据支持。
国内其他学者也对侧方淋巴结清扫进行了相关的临床研究。四川大学华西医院王自强教授团队自2011年起一直致力于侧方淋巴结转移的临床研究,前瞻性纳入侧方淋巴结最小径超过5 mm的患者,在新辅助放化疗后行侧方淋巴结清扫,以期发现新辅助放化疗联合选择性侧方淋巴结清扫的价值。该团队目前也正在开展侧方淋巴结转移特征的回顾性分析研究,以期及时有效地发现和处理侧方淋巴结转移;以及通过术前三维影像检查准确评价目标淋巴结转移情况,以指导侧方淋巴结清扫。另外,中山大学附属第六医院骆衍新教授目前也正在开展侧方淋巴结与新辅助放疗的随机对照研究。
目前在世界范围内,对于侧方淋巴结转移诊断标准、新辅助治疗、侧方淋巴结清扫的手术指征、侧方淋巴结清扫范围及神经保护等问题仍存在许多争议,越来越多的研究结果显示,基于影像学证据,针对可能存在侧方淋巴结转移患者行新辅助放化疗与选择性侧方淋巴结清扫术的综合治疗策略可能是更加有效的。在我国,新辅助放化疗+TME仍是进展期直肠癌的主流治疗策略,但已有相当多的中心相继采取包括选择性侧方淋巴结清扫的新的治疗策略。积累高级别循证医学证据,进一步细化这一策略乃当务之急。
所有作者均声明不存在利益冲突



























