
1例69岁男性患者因胃腺癌伴肝脏、胰腺及腹腔淋巴结转移,在完成奥沙利铂联合雷替曲赛化疗4个周期后,改用纳武利尤单抗联合替吉奥治疗。10 d后患者全身出现严重皮疹,考虑为纳武利尤单抗和替吉奥所致皮肤不良反应,停用2药,给予甲泼尼龙和抗过敏药物治疗。皮疹逐渐好转,糖皮质激素逐步减量至停药。但停药当日患者出现发热、寒战、严重呼吸衰竭,结合临床治疗情况、实验室检查结果及影像学改变,考虑为纳武利尤单抗所致免疫相关性肺炎。给予甲泼尼龙、抗感染、经鼻高流量氧疗等治疗,4 d后患者喘憋症状较前明显好转,28 d后复查CT肺部炎症较前明显好转。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,69岁,胃癌术后抗肿瘤治疗5个月,高热、咳嗽3 d,于2021年12月8日入住我院急诊内科。患者于8个月前出现腹痛症状,5个月前在外院确诊为胃腺癌伴肝脏、胰腺及腹腔淋巴结转移,7月13日行腹腔镜下探查术。术中发现肿瘤无法切除,改行胃空肠吻合术+空肠造瘘术。7月29日患者转入我院行奥沙利铂联合雷替曲赛方案化疗4个周期。11月2日改用纳武利尤单抗(200 mg静脉滴注、1次/2周)联合替吉奥(60 mg口服,第1~14天,间隔7 d)治疗。10 d后患者全身皮肤出现散在大片暗红色丘疹,伴瘙痒及脱屑,给予氯雷他定及地塞米松口服治疗未见好转,11月19日再次入院。入院后经皮肤科医师会诊考虑为抗肿瘤药物所致皮肤不良反应,停用替吉奥,未行第2次纳武利尤单抗治疗,给予甲泼尼龙琥珀酸钠40 mg静脉注射、2次/d,依巴斯汀10 mg口服、1次/d,糠酸莫米松乳膏1次/d外用。7 d后患者皮肤瘙痒明显减轻,胸背部及四肢暗红色丘疹明显减少,伴有少量脱屑,激素逐渐减量;9 d后停药(甲泼尼龙琥珀酸钠40 mg/d,静脉滴注3 d;20 mg/d,静脉滴注3 d;甲泼尼龙4 mg/d口服3 d)。停药当日患者出现发热、寒战,体温最高39.0 ℃,伴有咳嗽、咳痰,偶有轻度腹痛,遂来我院就诊,并收入院。患者既往有冠状动脉粥样硬化性心脏病史半年余,未规律治疗;否认高血压病、糖尿病史,否认肝炎、肺结核等传染病史,否认药物及食物过敏史。
入院体检:体温38.6 ℃,心率70次/min,呼吸20次/min,血压132/78 mmHg(1 mmHg=0.133 kPa)。胸背部皮肤可见多处散在色素沉着,无皮疹及脱屑;口唇无紫绀,呼吸节律正常,双肺呼吸音粗,可闻及散在湿性啰音;心律齐,各瓣膜听诊区未闻及病理性杂音;腹部平坦,脐上可见长约8 cm纵行手术瘢痕,左上腹可见空肠造瘘管,腹部柔软无压痛,肝脾肋下未触及,余未见异常。实验室检查:白细胞计数(white blood cell,WBC)5.6×109/L,中性粒细胞0.89,嗜酸粒细胞0.005;C反应蛋白(C-reactive protein,CRP)110.4 mg/L,降钙素原(procalcitonin,PCT)4.91 μg/L;丙氨酸转氨酶(alanine aminotransferase,ALT)25 U/L,天冬氨酸转氨酶(aspartate aminotransferase,AST)39 U/L,总胆红素(total bilirubin,TBil)19.7 μmol/L,γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,γ-GT)107 U/L,白蛋白25.5 g/L。胸腹部CT示双肺多发斑片影,胆囊炎。入院诊断:(1)胃腺癌(腹腔淋巴结转移、锁骨上淋巴结转移、侵犯胰腺及肝脏,T4N3M1 Ⅳ期);(2)肺部感染;(3)胆囊炎;(4)冠状动脉粥样硬化性心脏病。入院当日予哌拉西林钠他唑巴坦钠4.5 g静脉滴注、1次/8 h。入院第2天,患者出现明显胸闷、憋气,频繁咳嗽,咳出少量暗红色血性痰,体温正常。面罩吸氧(10 L/min)时脉搏血氧饱和度0.93,血气分析示pH 7.4,动脉血氧分压60 mmHg,动脉血二氧化碳分压32 mmHg,氧合指数(动脉血氧分压/吸入氧浓度)100 mmHg(参考值:400~500 mmHg);WBC 6.1×109/L,中性粒细胞0.91,嗜酸粒细胞0.003;CRP 162.4 mg/L,PCT 4.11 μg/L;B型钠尿肽168.5 ng/L,肌钙蛋白I 0.03 μg/L,D-二聚体2.88 mg/L。CT肺血管造影示双肺广泛磨玻璃样渗出,双侧胸腔积液(图1 A)。立即给予无创呼吸机辅助呼吸,转入重症医学科。转科后给予经鼻高流量氧疗(氧浓度55%,流量40 L/min),脉搏血氧饱和度0.96。根据患者病史及肺部影像学表现考虑为纳武利尤单抗所致免疫相关性肺炎,给予甲泼尼龙琥珀酸钠40 mg静脉注射、2次/d,氧驱雾化吸入性布地奈德混悬液(1 mg、3次/d)、乙酰半胱氨酸溶液(0.3 g、2次/d)。因患者有胆囊炎,且不能排除肺部细菌感染及肺孢子菌感染,在继续哌拉西林钠他唑巴坦钠治疗的基础上,加用卡泊芬净静脉滴注(首剂量70 mg,维持剂量50 mg/d)和复方新诺明5片口服、1次/6 h。12月12日,痰细菌培养回报肺炎克雷伯杆菌阳性,曲霉菌甘露聚糖检测阴性,真菌D-葡聚糖检测阳性。12月13日痰液病原体高通量测序示主要病原体为肺炎克雷伯杆菌、鲍曼不动杆菌、白色念珠菌及人类疱疹病毒4型。治疗4 d后,患者自觉喘憋较前明显减轻,血气分析(氧浓度50%,流量40 L/min)示氧分压113 mmHg,氧合指数226 mmHg;WBC 8.0×109/L,中性粒细胞0.87,CRP 4.4 mg/L,PCT 0.31 μg/L,B型钠尿肽114.3 ng/L。排除肺孢子菌感染可能,停用复方新诺明。12月17日,患者体温正常,咳嗽明显减轻,痰量减少,痰中带有少量暗红色血,血气分析(氧浓度35%,流量30 L/min)示氧分压85 mmHg,氧合指数242 mmHg,改为鼻导管吸氧(3 L/min)。胸部CT示双肺见网格样影、磨玻璃影及索条影,呈间质性改变,较前明显好转(图1 B)。12月21日,患者咳嗽及喘憋症状消失,血气分析(鼻导管3 L/min)示氧分压102 mmHg,氧合指数309 mmHg。当日停用卡泊芬净及哌拉西林钠他唑巴坦钠。12月24日,患者好转出院,停用甲泼尼龙琥珀酸钠,改为甲泼尼龙80 mg/d口服。2022年1月5日门诊随访,胸部CT示双肺网格及磨玻璃影,较前好转(图1 C),甲泼尼龙减量为40 mg/d口服,持续7 d后减量为20 mg/d,再7 d后改为8 mg/d。1月22日门诊随访,胸部CT较前无明显变化,停用糖皮质激素。患者后续未再行抗肿瘤治疗,2月5日因急性消化道出血合并肝衰竭死亡。
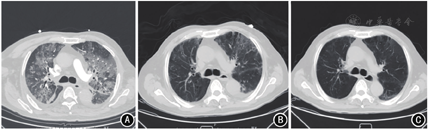

本例患者胃腺癌伴肝脏、胰腺及腹腔淋巴结转移行胃空肠吻合术+空肠造瘘术后给予奥沙利铂联合雷替曲赛方案化疗,4个周期后改为纳武利尤单抗联合替吉奥治疗,10 d后发生全身皮疹,34 d后出现发热、咳嗽症状,并迅速发展为呼吸衰竭,需氧气和呼吸支持治疗,CT肺血管造影示双肺广泛磨玻璃样渗出,双侧胸腔积液。患者奥沙利铂联合雷替曲赛化疗4个周期未发生皮疹和肺炎。既往已有纳武利尤单抗导致皮肤反应的报道,可表现为Steven-Johnson综合征[1]、鳞屑样皮炎[2]和扁平苔藓[3,4],而替吉奥相关皮肤损伤也包括Steven-Johnson综合征[5,6]、红斑狼疮样病变[7]和急性苔藓样痘疮样糠疹(Mucha-Habermann病)[8]等。因此,本例患者引起皮疹的原因两药均不能排除。
抗肿瘤药物治疗后的肺损伤可表现为感染、肺纤维化、嗜酸粒细胞性肺炎和免疫相关性肺炎等。本例患者的CT肺血管造影不符合肺纤维化改变,可排除抗肿瘤药物引起的肺纤维化。替吉奥有导致嗜酸粒细胞性肺炎的报道[9,10],但本例患者无嗜酸粒细胞增多,可以排除。患者痰培养为肺炎克雷伯杆菌阳性,痰液病原体高通量测序技术检测提示多种微生物感染,但患者WBC在正常范围,入院后体温基本正常,给予哌拉西林钠他唑巴坦钠抗感染治疗,但咳嗽、喘憋加重,迅速发展为呼吸衰竭,细菌和真菌感染的证据不足。纳武利尤单抗属于免疫检查点抑制剂(immune checkpoint inhibitors,ICI),可引起免疫相关性肺炎[11]。Delaunay等[12]研究发现,免疫相关性肺炎可能发生在用药后9 d~19.2个月,中位发生时间2.8个月。免疫相关性肺炎的临床表现主要为呼吸困难、咳嗽和发热等肺炎常见症状,影像学检查最主要的特征为肺部磨玻璃样影改变,也可表现为网格状阴影、实变影、小叶结节和胸腔积液[11]。本例患者肺炎的发病时间、临床表现及影像学表现均符合免疫相关性肺炎的诊断,应用糖皮质激素后肺炎逐渐好转,提示患者很可能为纳武利尤单抗所致严重免疫相关性肺炎。根据美国国立癌症研究所通用不良事件术语标准5.0版[13],本例患者皮肤不良反应分级为3级,免疫相关性肺炎分级为4级。
一项meta分析显示,免疫相关性肺炎是ICI的主要致死原因之一,病死率达35%(115/333),患者一旦出现应永久停用该类药物[14]。近期有文献报道,PD-1/PD-L1抑制剂相关肺损伤主动监测方法能有效提高相关不良反应/事件的检出率,且能更多地预警初期或轻度不良反应/事件、将用药风险的发现和干预时间前移,降低患者的用药风险[15]。
本例提示,虽然纳武利尤单抗联合化疗用于一线治疗晚期胃癌及食管癌与单纯化疗相比能显著提高总生存期,但应警惕其严重不良反应的发生,对于出现免疫相关严重不良反应的患者,应及时给予糖皮质激素治疗。
所有作者均声明不存在利益冲突



























