
探讨miR-155对人类含SH2区域的肌醇5'磷酸酶1(SHIP1)的转录后调控在急性髓系白血病(AML)发病机制中的作用。
应用反转录聚合酶链反应(RT-PCR)法检测30例AML患者miR-155、SHIP1的mRNA表达水平,选取同年龄健康人骨髓为对照组。人白血病U937细胞转染miR-155类似物后,RT-PCR法检测转染细胞中miR-155、SHIP1的mRNA表达水平。Western blot法检测转染后细胞SHIP1、AKT、pAKT蛋白水平。流式细胞术检测转染后细胞凋亡的变化。
30例AML患者中,15例AML-M4及AML-M5患者SHIP1蛋白水平较非AML-M4及AML-M5患者明显降低,而miR-155表达水平相应升高(均P<0.05)。U937细胞转染miR-155后,SHIP1蛋白水平较转染阴性对照组降低(P<0.05),而p-AKT水平较转染阴性对照组明显升高,转染后细胞凋亡明显受抑(P<0.05)。
miR-155可对SHIP1进行转录后调控,miR-155可能通过降低SHIP1活性而激活PI3K-AKT途径,抑制白血病细胞的凋亡,从而促进AML的发生。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
人类含SH2区域的肌醇5'磷酸酶1(SHIP1)基因属于肌醇5'磷酸酶家族,是抑制PI3K-AKT途径活化的重要负性调控因子,已有研究证实SHIP1基因的点突变在急性髓系白血病(AML)中导致SHIP1抑癌活性降低[1,2],促进AML发病。而SHIP1是miR-155的目标基因之一[3],在AML中可能存在SHIP1的转录后调控。本研究对AML患者及白血病细胞系的SHIP1活性及miR-155的表达进行了检测,并通过在白血病细胞系中转染miR-155类似物,对SHIP1活性的变化在AML发病机制中的作用进行了研究。
miR-155前向引物:5'-CCCCTATCACGATTAGCA TTAA-3' ;U6前向引物:5'-GCAGGGGCCATGCTAATC TTCTCTGTATCG-3' ;SHIP1前向引物:5'-GCGTGCTGT ATCGGAATTGC-3' ,反向引物:5'-TGGTGAAGAACCT CATGGAGAC-3' ;GAPDH前向引物:5'-ACCACAGTCC ATGCCATCACT-3' ,反向引物:5'-TCCACCACCCTGTT GCTGTA-3' ;miR-155-5p类似物(mimic)序列:5'-UA AUGCUAAUCGUGAUAGGGGU-3' ,5'-CCCUAUCACG AUUAGCAUUAAUU-3' ;miR-155-5p类似物的阴性对照序列:5'-UUCUCCGAACGUGUCACGUTT-3' ,5'-ACG UGACACGUUCGGAGAATT-3'。引物及类似物、阴性对照均由美国Invitrogen公司合成。X-treme GENE siRNA Transfection Reagent(瑞士Roche公司产品),TRIzol Reagent(美国Invitrogen Life Technologies公司)、荧光时实定量PCR仪(美国ABI公司),All-in-One miRNA定量反转录(qRT)-PCR Detection System(广州复能基因公司);Nanodrop微量分光光度计(美国Thermo公司);抗SHIP1、AKT、p-AKT单抗(美国CST公司),抗β-actin抗体(美国Santa Cruz公司),抗兔rabbit抗体(英国Abcam公司),流式细胞仪(美国BD公司)。Annexin V FITC细胞凋亡检测试剂盒(中国碧云天公司)。
骨髓或外周血标本取自2012年10月至2013年10月在河北大学附属医院住院的30例初诊AML患者,经MICM分型确诊。其中男性18例,女性12例;中位年龄36岁(22~ 55岁),中位白细胞计数(WBC)34.6×109/L(1.0×109~138.0×109/L)。WHO分型:伴有重现性细胞遗传学异常的AML 4例,伴有多系病态造血的AML2例,不另作分类的AML 24例。不另作分类的24例AML患者FAB分型:M1 3例,M2 5例,M4 6例,M5 9例,M6 1例。收集10名健康人骨髓作为对照。骨髓或外周血单个核细胞离心后提取RNA及蛋白质,实时PCR检测miR-155与SHIP1的表达,Western blot法检测SHP1蛋白表达水平。RNA提取、反转录聚合酶链反应(RT-PCR)以及实时PCR具体方法同本研究中的细胞实验方法。本研究得到医院伦理委员会批准,并得到患者及家属知情同意。
人白血病U937细胞系购自天津中国医学科学院血液学研究所,用含10%血清、2 mmol/L谷氨酰胺及链霉素的RPMI 1640培养液,在37 ℃、5 % CO2的细胞培养箱中培养。U937细胞分三组:未转染对照组(U937c)、转染阴性对照组(U937mc)和转染miR-155类似物组(U937m),U937m组根据X-treme GENE siRNA Transfection Reagent说明书进行miR-155类似物的转染。U937c组和U937mc组分别用无血清RPMI 1640培养液或miR-155类似物的阴性对照试剂转染,转染终浓度均为50 nmol/L。在细胞转染48 h后检测基因表达以及细胞凋亡。实验均重复3次。
细胞转染48 h后应用TRIzol提取各组细胞总RNA。应用Nanodrop微量分光光度计检测RNA质量。PCR实验均重复3次。
miR-155基因表达检测:应用All-in-One miRNA qRT-PCR试剂盒进行反转录和基因扩增。选取U6为内参基因。所有反应在ABI Prism 7000 PCR仪中进行。应用2-ΔΔCt法计算miR-155相对表达量。
SHIP1基因表达的检测:应用Quant One Step SYBR qRT-PCR Master进行RNA的反转录以及cDNA扩增。其中50 μl的PCR体系包括:25 μl 2×Quant One Step SYBR qRT-PCR Master mix,2.5 μl 2.5 U/μl Hot master Taq聚合酶,0.4 μl Quant RNA酶,2 μl前向引物(10 pmol/L),2 μl反向引物(10 pmol/L)以及2 μg总RNA,加入蒸馏水至50 μl。所有反应在ABI Prism 7000 PCR仪中进行。选取GAPDH为内参基因,应用2-ΔΔCt法计算SHIP1相对表达量。
应用RIPA蛋白裂解液对细胞进行消化和蛋白提取,应用Bradford方法检测蛋白浓度。20 μg总蛋白提取物经电泳、转膜、封闭后,分别加入针对SHIP1、AKT、p-AKT的抗体(浓度均为1∶1 000)和抗β-actin抗体(1∶1 000)4 ℃过夜,随后予以抗兔二抗(1∶10 000)反应,ECL显色后应用Quantity One软件分析数据,以β-actin为内参计算基因在蛋白水平的相对表达。实验重复3次。
参照Annexin V FITC细胞凋亡检测试剂盒说明对细胞进行处理,通过流式细胞术检测三组细胞的凋亡情况。应用FACS Diva软件进行数据分析。
应用SPSS 13.0软件进行统计学分析。计量资料用均数±标准差( ±s)表示,对其分析采用单因素方差分析和Student'st检验,以P<0.05为差异有统计学意义。
±s)表示,对其分析采用单因素方差分析和Student'st检验,以P<0.05为差异有统计学意义。
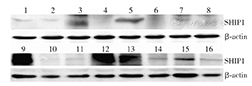
AML患者骨髓SHIP1蛋白表达情况见图1。在各AML亚型中,AML-M4和AML-M5亚型患者(1组)SHIP1蛋白表达较非AML-M4或AML-M5亚型的AML患者(2组)明显降低。1组患者15例,SHIP蛋白表达水平0.93±0.11;2组患者15例,SHIP1蛋白表达水平2.55±1.13;健康对照组(3组)10名,SHIP蛋白水平为8.32±2.14。1组和2组比较,差异有统计学意义(P<0.05)。与2组比较,1组患者尽管骨髓SHIP1的蛋白量低,但二组SHIPI在mRNA水平差异无统计学意义(P>0.05),而1组miR-155表达水平较2组升高(P<0.05)(表1)。
初诊急性髓系白血病(AML)患者骨髓miR-155与SHIP1 mRNA表达水平( ±s)
±s)
初诊急性髓系白血病(AML)患者骨髓miR-155与SHIP1 mRNA表达水平( ±s)
±s)
| 组别 | 例数 | SHIP1 | miR-155 | |
|---|---|---|---|---|
| AML组 | ||||
| AML-M4+AML-M5 | 15 | 0.021±0.009 | 5.50±1.40 | |
| 非AML-M4+AML-M5 | 15 | 0.018±0.007 | 2.75±0.48 | |
| 健康对照组 | 10 | 0.112±0.028 | 0.00±0.00 | |
| t值a | 1.052 | 1.960 | ||
| P值a | 0.305 0 | 0.040 9 | ||
注:SHIP1为含SH2区域的肌醇5'磷酸酶1;aAML-M4+AML-M5组和非AML-M4+AML-M5比较;用2-ΔΔCt法表示基因mRNA表达水平

相对于U937c组以及U937mc组,转染miR-155类似物可导致U937细胞中miR-155的表达升高(P<0.05)(表2),提示转染成功。与U937c组以及U937mc组相比,转染U937m组细胞未见SHIP1在mRNA水平的改变,但SHIP1蛋白表达水平降低(P<0.05),提示miR-155对SHIP1可能存在转录后的基因表达调节,SHIP1是miR-155的靶基因。相对于U937c组以及U937mc组,miR-155类似物转染并未导致AKT蛋白水平的变化,但p-AKT蛋白含量升高(P<0.05)(表2、图2),提示miR-155表达增加可以导致活化的AKT增加。
不同处理组人白血病U937细胞各基因mRNA及蛋白表达水平比较( ±s)
±s)
不同处理组人白血病U937细胞各基因mRNA及蛋白表达水平比较( ±s)
±s)
| 组别 | 样本数 | miR-155 | SHIP1 | AKT蛋白 | PAKT蛋白 | |
|---|---|---|---|---|---|---|
| mRNA | 蛋白 | |||||
| 未转染对照组 | 3 | 1 | 1 | - | - | - |
| 转染阴性对照组 | 3 | 0.33±0.13 | 0.95±0.29 | 0.77±0.27 | 91.10±15.02 | 22.05±15.42 |
| 转染miR-155类似物组 | 3 | 85.50±6.43 | 0.91±0.25 | 0.32±0.19 | 86.09±13.80 | 57.23±8.80 |
| t值a | 22.750 | 0.675 | - | - | - | |
| P值a | <0.000 1 | 0.537 0 | - | - | - | |
| t值b | 22.930 | 0.211 | 3.568 | 0.426 | 3.424 | |
| P值b | <0.000 1 | 0.843 5 | 0.023 4 | 0.691 9 | 0.026 7 | |
注:SHIP1为含SH2区域的肌醇5'磷酸酶1:a转染miR-155类似物组与未转染对照组比较;b转染miR-155类似物组与转染阴性对照组比较;用2-ΔΔCt法表示基因mRNA表达水平;用相对于β-actin表示各蛋白水平
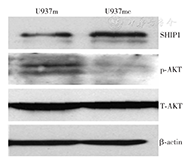

U937m:转染miR-155类似物组;U937mc:转染阴性对照组
U937c、U937mc、U937m组细胞凋亡率分别为(2.080 ± 0.684)%、(0.306±0.196)%、(0.187±0.977)%,同U937mc相比,U937m细胞凋亡率下降,差异有统计学意义(t=4.314,P= 0.012 5)(图3)。


U937c:未转染对照组;U937m:转染miR-155类似物组;U937mc:转染阴性对照组
PI3K-AKT信号通路是细胞内重要的信号转导通路之一,其过度激活会影响下游多种效应分子的活化状态,在细胞内发挥抑制凋亡、促进增殖的关键作用[4]。PI3K-AKT途径在50 %~ 70%的AML发病中发挥重要作用,但其具体机制不详。人类SHIP1基因是抑制PI3K-AKT途径活化的重要负性调控因子[5,6,7]。我们在前期工作中发现,AML患者SHIP1基因的点突变导致其功能失活,促进了AML发病[1,2]。但SHIP1的点突变发生率并不高,我们的研究首次报道了在AML中除了点突变的其他机制对SHIP1功能的抑制。
与Metzner等[6]的研究一致,本研究发现AML患者中SHIP1的蛋白表达水平异质性较强。蛋白表达水平显著下降的发生机制可能为:高甲基化修饰、蛋白酶体降解增加、微小RNA的转录后调控。Lee等[8]的研究表明,人类SHIP1的启动子上没有CpG岛,而将去甲基药物或蛋白酶体抑制剂作用于SHIP1缺失的细胞系,均未导致SHIP1蛋白表达明显增加。因此我们推测微小RNA的调控可能是AML中SHIP1蛋白表达水平显著下降的主要机制。目前相关研究已证实SHIP1是miR-155的目标基因之一[3, 9]。我们进一步检测了SHIP1蛋白表达明显下降的AML患者中miR-155的表达水平,结果证实miR-155表达水平明显上升,二者表现为负相关性。
随后我们的体外研究表明,白血病细胞系中转染miR-155类似物后,SHIP1 mRNA水平较转染前无明显变化,而蛋白水平表达明显下降,证实了SHIP1在AML中也为miR-155的靶标,miR-155对SHIP1的转录后调控是使AML SHIP1失活的原因。这一点在B细胞淋巴瘤、NK/T细胞白血病及急性淋巴细胞白血病中已被证实[10,11,12,13]。
在白血病细胞系U937中,过表达miR-155使SHIP1蛋白水平下降,活化的AKT增加,激活了PI3K-AKT途径,抑制了白血病细胞的凋亡。SHIP1抑癌活性的缺失导致了PI3K-AKT途径的激活,这可能是PI3K-AKT信号通路参与AML发病机制的重要途径。
CALGB等大系列研究证实FMS样的酪氨酸激酶3/内在重复序列(FLT3/ITD)突变阳性的AML患者miR-155水平升高[14,15],也有研究发现SHIP1蛋白水平明显下降的AML为FLT3/ITD阳性[6]。O'Connell等[16]研究发现miR-155在AML-M4或AML-M5中表达水平明显升高,我们的结果与此结论相符。我们的研究中,SHIP1活性降低的15例AML-M4或AML-M5患者中10例为正常核型,共有8例行FLT3/ITD检测,其中6例阳性。FLT3/ITD的突变可能是调控miR-155的上游机制[17]。单核细胞白血病与miR-155/SHIP1及FLT3/ITD的关系,尚待扩大病例数进一步研究。
我们的研究证实了miR-155对SHIP1的转录后调控是使SHIP1失活的原因之一。miR-155通过降低SHIP1活性从而激活PI3K-AKT通路,抑制了白血病细胞的凋亡,从而促进了AML的发生。



























