
为了提高非内分泌专业儿科医师对儿童及青少年住院高血糖的科学管理能力,特制定本专家共识。在住院高血糖管理中,应坚持以不同病情人群为标准的分层血糖管理原则。胰岛素静脉输注和多次皮下注射(如基础-餐时胰岛素)方案简明易懂,可操作性强,方便非内分泌专业儿科医生对相关科室患者及时处理,使血糖得以安全、有效地控制达标。以内分泌专业医师为核心,通过科室间会诊或网络技术等手段实时互动调整血糖管理方案的院内信息化血糖管理模式可以提高治疗效果、节省住院时间并减少院内交叉感染,推荐有条件的医疗单位积极摸索开展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
围手术期、创伤、感染、应激等状态以及因其他系统疾病接受如类固醇激素、化疗药物、奥曲肽、肠内外营养等住院治疗时,常常会出现高血糖的情况;儿童及青少年糖尿病患者因患其他疾病住院时也会出现血糖波动。这些患者主要分布在非内分泌科室住院治疗,而相关科室对血糖重视程度不够且管理能力存在不足。很多国家已制定了针对此类患者的血糖管理指南[1, 2],我国也制定了成人住院高血糖和围手术期血糖管理的专家共识[3, 4, 5],而针对儿童及青少年人群,国内仅有少数几篇继发性糖尿病和应激性高血糖的文章可供参考[6, 7, 8, 9],尚缺乏儿童及青少年患者特殊情况下的住院高血糖管理指南或共识。儿童及青少年处于生长发育的关键时期,血糖控制及达标要求与成人不同,亟需制定一部能够指导儿科临床实践的、科学的、可操作性强的住院高血糖管理指导建议。为进一步做好儿童及青少年患者特殊情况下住院血糖管理,促进规范化诊疗,中国医师协会儿科学分会内分泌遗传代谢学组联合中华医学会儿科学分会急救学组基于国内外相关指南和国内儿童青少年血糖管理的临床研究[6, 7, 8, 9]和实践经验,制定了本版儿童及青少年特殊情况下住院高血糖管理指导建议,供广大医师,特别是非内分泌专业儿科临床医师参考借鉴。
成人住院高血糖是指住院期间任意时点的血浆葡萄糖水平>7.8 mmol/L[4, 5],儿童尚无明确定义。但儿童的血糖分布规律提示,正常儿童不同年龄段血糖水平随年龄增长呈增高的趋势[9]。针对重症儿童高血糖的定义为间隔1 h连续2次血浆葡萄糖水平>8.3 mmol/L[10]。
儿童及青少年非内分泌科室住院高血糖患者血糖升高的原因主要包括:应激性高血糖(如急重症、手术等)、接受某些药物(如类固醇激素、肿瘤化疗、奥曲肽、肠内外营养)可能导致的药源性高血糖、新诊断和已经诊断的糖尿病患者因罹患其他疾病致血糖控制不佳等。不论高血糖的原因如何,也不论患儿既往是否合并糖尿病,高血糖均会导致白细胞功能受损、免疫球蛋白功能下降,从而降低机体的免疫应答,加重患者的基础疾病。高血糖除了导致术后伤口易患感染、不愈合、伤口裂开外,常常会导致住院时间延长,院内感染机会、住院费用、远期后遗症发生率和病死率增加。此外,低血糖以及血糖波动造成的危害也不应忽视,对于儿童及青少年患者,轻度的低血糖会造成认知功能障碍,而严重低血糖可能会造成不可逆的脑损伤,遗留永久的后遗症。
住院高血糖管理应坚持根据不同病情进行分层管理的原则,即强调设定个体化的血糖控制目标。既避免因高血糖增加感染和急性代谢危象的发生风险,也应尽量避免降糖治疗中低血糖和血糖大幅波动的发生。总体而言,住院期间不求快速降糖,而是求稳达标。
高血糖是围手术期的常见问题。不同病情高血糖患者血糖控制目标及管理策略有所不同。一方面,手术创伤、应激会诱发机体分泌儿茶酚胺、皮质醇和炎性介质等胰岛素拮抗因子,促使血糖升高[1, 3];另一方面,合并糖尿病、胰腺炎、代谢综合征等胰岛素抵抗或分泌障碍性疾病的患者更容易发生围手术期高血糖。此外,围手术期经常使用的糖皮质激素、含糖液体等进一步增加了高血糖的发生风险。同时,长时间禁食和不恰当的降糖治疗也会导致低血糖和血糖的剧烈波动,需要警惕。
控制高血糖(维持血糖在5~10 mmol/L),维持血糖平稳,同时避免发生低血糖和糖尿病酮症酸中毒(diabetic ketoacidosis,DKA)[1]。其中,血糖在7.8~10.0 mmol/L者可以通过单纯调整饮食得到控制。若术前禁食需补液,应选择无糖液体[8]。在此强调,因禁食、降糖方案未及时调整或降糖治疗中断等因素所造成的围手术期血糖大幅波动比高血糖危害更大[2]。
所有患者在术前均应评估血糖状况。对患儿进行心理疏导和安抚以辅助减少血糖波动。择期手术的糖尿病患儿,还应系统评估血糖和糖化血红蛋白测定血、尿酮体水平,获得连续3 d的血糖监测结果,并制定术前血糖管理方案。术前将血糖控制在目标范围内以避免低血糖或高血糖,当血糖水平>14.0 mmol/L时,应立即测定血和尿酮体、血气。血糖达标则按期手术,不达标则需推迟手术直至血糖达标。所有患儿需建立静脉通路以备低血糖时用以输注葡萄糖。
推荐手术安排优先原则,即糖尿病患儿择期手术应安排在当日第1台进行,并根据手术操作时间采用不同的血糖管理方案,即大、中、小手术分级管理方案[1, 3]。
1.小手术:手术时间<2 h,如牙科治疗、皮肤或淋巴结活检手术以及包皮或隐睾等不需要长时间禁食的手术。术前监测空腹血糖、三餐前后血糖和睡前血糖。可继续给予基础-餐时胰岛素方案,根据情况制定胰岛素治疗方案(表1)。对于术前采用持续胰岛素皮下注射(continuous subcutaneous insulin infusion,CSII)的择期手术患儿,若血糖控制平稳且在目标范围内,可继续术前的CSII方案。胰岛素泵安装部位若与术野范围或手术所需金属套管位置发生冲突,则需要停用胰岛素泵更换为静脉胰岛素输注方案。对于术前采用口服药控制血糖的2型糖尿病患儿,在手术当天停用口服药物,改为胰岛素输注[1]。
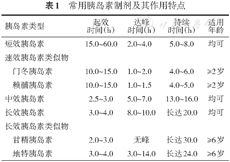
常用胰岛素制剂及其作用特点
常用胰岛素制剂及其作用特点
| 胰岛素类型 | 起效 时间(h) | 达峰 时间(h) | 持续 时间(h) | 适用 年龄 | |
|---|---|---|---|---|---|
| 短效胰岛素 | 15.0~60.0 | 2.0~4.0 | 5.0~8.0 | 均可 | |
| 速效胰岛素类似物 | |||||
| 门冬胰岛素 | 10.0~15.0 | 1.0~2.0 | 4.0~6.0 | ≥2岁 | |
| 赖脯胰岛素 | 10.0~15.0 | 1.0~1.5 | 4.0~5.0 | ≥2岁 | |
| 中效胰岛素 | 2.5~3.0 | 5.0~7.0 | 13.0~16.0 | 均可 | |
| 长效胰岛素 | 3.0~4.0 | 8.0~10.0 | 长达20.0 | 均可 | |
| 长效胰岛素类似物 | |||||
| 甘精胰岛素 | 2.0~3.0 | 无峰 | 长达30.0 | ≥6岁 | |
| 地特胰岛素 | 3.0~4.0 | 3.0~14.0 | 长达24.0 | ≥6岁 | |
2.中手术:手术时间2~4 h以及胃镜、肠镜等需要严格禁食的操作。术前1 d继续给予睡前基础胰岛素(剂量减少50%)皮下注射或采用胰岛素持续静脉输注。采用CSII方案者可将凌晨3点以后基础率降低20%以避免低血糖。因禁食或静脉滴注抗生素等其他原因需输注含糖液体者,建议液体中按葡萄糖(单位g)/胰岛素(单位U)=4的比例加用胰岛素。手术当日暂停晨起胰岛素皮下注射,CSII者停用胰岛素泵,并开始给予含糖液及胰岛素静脉输注,至少每30~60分钟监测1次血糖来获得血糖变化趋势,调节葡萄糖和胰岛素的输注速度以维持血糖平稳。对于术前采用口服药控制血糖的2型糖尿病患儿,二甲双胍需在术前24 h停用,同时改为胰岛素输注控制血糖。
3.大手术:手术时间需4~8 h或以上。进食睡前点心后开始禁食及补液,推荐静脉输注胰岛素,胰岛素给药方法及血糖监测参照中手术的处理[1, 3]。口服药物处理原则亦同中手术。
应继续维持术前血糖监测方案,严格执行每小时甚至每30分钟监测血糖以避免低血糖和高血糖。大、中手术一般同时输注含糖液,调整含糖液和胰岛素输注速度以维持血糖在5.0~10.0 mmol/L。小手术可以继续术前的基础-餐时胰岛素方案,无需常规输注含糖液。术中若出现低血压,立即给予0.9%氯化钠注射液10~20 ml/kg扩容,避免使用含钾液[1]。
术后禁食阶段,沿用术中血糖管理方案。在术后24~48 h建议每1~2小时监测1次血糖,根据血糖结果及时调整胰岛素剂量。一旦可以胃肠营养,可逐步过渡为术前的糖尿病治疗方案。若术前服用二甲双胍,需至少术后48 h且复查肾功能正常后方可更换回二甲双胍口服。由于应激、疼痛以及活动量减少,胰岛素剂量可能会有所增加。胃肠疾病手术因术后禁食时间相对长,多数需要给予肠外营养,可参照下文中肠外营养患者的血糖管理方案进行处理。
应首先立即检测血糖、血电解质、血及尿酮体、血气分析,如果出现DKA,即pH<7.3和(或)HCO-3 <15 mmol/L,应尽量推迟手术,先纠正DKA,待代谢紊乱、循环状态纠正后再行手术-3。若未并发DKA,立即给予静脉输注含糖液和胰岛素,调整二者输注速度以使血糖达到5.0~10.0 mmol/L之后再进行手术,术中及术后管理同大、中手术管理。
1.血糖控制目标:重症患者的血糖通常会升高,即应激性高血糖,高血糖又会增加重症监护室(intensive care unit,ICU)患者感染和急性代谢紊乱的发生风险,该类患者应该严格控制血糖[11]。而针对成人ICU患者进行的NICE-SUGAR研究[12]及荟萃分析[13, 14]结果显示,ICU患者胰岛素强化治疗使血糖正常或接近正常范围并不能减少病死率和并发症的发生风险,反而会增加严重低血糖发生率、延长住院时间、增加住院费用。这导致对于ICU患者血糖控制到底严格还是宽松颇受争议。2009年针对以需要机械通气和(或)应用血管活性药物为是否进入儿科ICU界定标准的Leuven Ⅲ研究[15]结果显示,严格控制血糖(婴儿2.8~4.4 mmom/L、儿童3.9~5.6 mmom/L)可缩短ICU住院时间,对患儿有益。但是,后续针对重症儿童进行的SPECS研究[16](严格血糖目标为4.4~6.1 mmol/L)、CHiP研究[17](严格血糖目标为4.0~7.0 mmol/L)、HALF-PINT研究、随访研究[9, 18, 19](严格血糖目标为4.4~6.1 mmol/L)以及荟萃分析[20, 21, 22]结果,却并未观察到严格控制血糖可以带来临床获益,相反认为严格降糖增加了低血糖的发生风险。
基于上述研究结果,美国糖尿病协会建议成人ICU患者血糖控制目标为7.8~10.0 mmol/L[23];中华医学会内分泌学分会推荐对于成人ICU患者采用宽松控制目标,即空腹血糖或餐前血糖控制在8.0~10.0 mmol/L,餐后2 h血糖或不能进食时任意时点血糖水平控制在8.0~12.0 mmol/L,特殊情况可放宽至13.9 mmol/L[4, 5];美国医师协会也推荐ICU患者血糖控制目标为7.8~11.1 mmol/L,而且强调不应低于7.8 mmol/L,并且未强调血糖上限值[24]。最新的美国重症医学学会、欧洲重症医学学会和国际儿童重症医学联盟在拯救脓毒症运动国际指南中对于儿童脓毒性休克并未做出具体血糖控制目标的建议,但是同样强调血糖≤7.8 mmol/L者不推荐给予胰岛素治疗[25]。中国严重脓毒症/脓毒性休克治疗指南以及中国急诊感染性休克临床实践指南中对成年患者均明确指出,连续2次血糖≥10.0 mmol/L应给予胰岛素治疗以维持血糖低于10.0 mmol/L[26, 27]。因为儿童与成人疾病特点不同,儿童大都器官功能的耐受性良好,因此,建议对于儿童及青少年ICU患者也采用围手术期的血糖目标值(即5.0~10.0 mmol/L),血糖在7.8~10.0 mmol/时,仅仅高度警惕可能发生高血糖,不采取胰岛素干预。当血糖连续2次>10.0 mmol/L时开始静脉胰岛素输注降低血糖。
2.血糖监测:重症患者病情瞬息万变,每1~2小时监测1次血糖,警惕低血糖造成的脑损伤和高血糖造成的循环和渗透压改变,特别应注意血糖的大幅度波动。当血糖持续24 h控制在5.0~10.0 mmol/L且相对平稳后可调整为每4小时监测一次[26, 27]。血糖监测频次还需要考虑患儿采用何种营养治疗模式。某些患者血流动力学不稳定、末梢循环差、代谢不稳定、严重水肿,此时末梢血糖不能精确反映静脉血糖,故对于重症患者的血糖测定血样应优先采用动脉血,其次是静脉血,不建议采用末梢毛细血管血监测。持续葡萄糖监测是通过葡萄糖感应器监测皮下组织间液的葡萄糖浓度而反映血糖水平的监测技术,对于血流动力学不稳定、末梢循环差、代谢不稳定、严重水肿患儿,亦不推荐选用。另外,对所有患者,建议测定糖化血红蛋白评估近3个月的血糖情况。
3.重症患者高血糖的处理:持续高血糖的患儿一般输注无糖液体,如因病情需输注含糖液体者(如某些药物需要葡萄糖配制[7]),建议液体中按葡萄糖(单位g)/胰岛素(单位U)=4的比例(根据机体胰岛素的敏感性酌情调整)配制。若患者采用肠内、外营养供能,且摄取的肠内、外营养热量适量,如果血糖在7.8~10.0 mmol/L,可以采取调整胃肠、胃肠外营养配比;如果血糖超过10.0 mmol/L,应启动胰岛素静脉输注治疗。
糖尿病患儿因其他系统疾病在相关科室就诊住院的情况并不少见,对这部分患儿管理的重点是控制血糖、避免出现DKA和低血糖。建议血糖控制目标:空腹血糖或餐前血糖4.0~7.0 mmol/L,餐后2 h血糖或不能进食时任意时点血糖5.0~10.0 mmol/L。但应注意血糖控制目标需个体化,对于低血糖发生风险低的患者,目标可以适当严格,对于低血糖发生风险高者,目标可以适当放宽。因其他疾病在非内分泌专科住院的这部分患儿的管理,重点强调以下几点[2]:(1)医学营养治疗和糖尿病教育应贯穿治疗的始终;(2)血糖监测频次和胰岛素剂量均需要确定个体化的管理目标;(3)对于出现恶心、呕吐、腹痛的糖尿病患儿,应警惕DKA,并检测血糖、血酮体以及尿酮体协助诊断;(4)发热、急性感染以及急性应激状态下,需增加胰岛素剂量,剂量调整见表2;(5)定期内分泌专科医生随访、制定及调整方案。

糖尿病患儿出现发热、应激、感染时高血糖的管理策略
糖尿病患儿出现发热、应激、感染时高血糖的管理策略
| 酮体 | 血糖(mmol/L) | |||
|---|---|---|---|---|
| 血(mmol/L) | 尿 | 10.0~14.0 | 14.1~22.0 | >22.0 |
| <0.6 | 阴性~微量 | 维持原日常胰岛素总剂量 | 原日常胰岛素总剂量增加5%,或餐时胰岛素剂量增加0.05 U/kg,或按照105%矫正餐时胰岛素剂量 | (1)原日常胰岛素总剂量增加10%,或餐时胰岛素剂量增加0.10 U/kg;(2)适量口服无糖补液 |
| 0.6~0.9 | 微~少量 | (1)原日常胰岛素总剂量增加5%,或餐时胰岛素剂量增加0.05 U/kg,或按照105%矫正餐时胰岛素剂量;(2)适量口服含糖液 | (1)原日常胰岛素总剂量增加5%~10%,或餐时胰岛素剂量增加0.05~0.10 U/kg,或按照105%~110%矫正餐时胰岛素剂量;(2)适量口服无糖液体 | (1)原日常胰岛素总剂量增加10%,或餐时胰岛素剂量增加0.10 U/kg;(2)适量口服无糖补液 |
| 1.0~1.4 | 少~中量 | (1)原日常胰岛素总剂量增加5%~10%,或餐时胰岛素剂量增加0.05~0.10 U/kg,或按照105%~110%矫正餐时胰岛素剂量;(2)适量口服含糖液;(3)如果可以进食,建议额外补充碳水化合物 | (1)原日常胰岛素总剂量增加10%,或餐时胰岛素剂量增加0.10 U/kg,或按照110%矫正餐时胰岛素剂量;(2)适量口服无糖补液 | (1)原日常胰岛素总剂量增加10%,或餐时胰岛素剂量增加0.10 U/kg;(2)适量口服无糖补液 |
| 1.5~2.9 | 中~大量 | (1)原日常胰岛素总剂量增加5%~10%,或餐时胰岛素剂量增加0.05~0.10 U/kg,或按照105%~110%矫正餐时胰岛素剂量;(2)适量口服含糖液;(3)如果可以进食,建议额外补充碳水化合物 | (1)原日常胰岛素总剂量增加20%,或餐时胰岛素剂量增加0.10~0.20 U/kg,或按照120%矫正餐时胰岛素剂量;(2)适量口服无糖补液 | (1)原日常胰岛素总剂量增加20%,或餐时胰岛素剂量增加0.10~0.20 U/kg;(2)适量口服无糖补液;(3)如果出现呕吐,考虑静脉输注生理盐水+5%葡萄糖液 |
| ≥3.0 | 大量 | (1)原日常胰岛素总剂量增加10%,或餐时胰岛素剂量增加0.10 U/kg,或按照110%矫正餐时胰岛素剂量;(2)适量口服含糖液;(3)如果可以进食,建议额外补充碳水化合物 | (1)原日常胰岛素总剂量增加20%,或餐时胰岛素剂量增加0.10~0.20 U/kg,或按照120%矫正餐时胰岛素剂量;(2)适量口服无糖补液 | (1)原日常胰岛素总剂量增加20%,或餐时胰岛素剂量增加0.10~0.20 U/kg;(2)适量口服无糖补液;(3)如果出现呕吐,考虑静脉输注生理盐水+5%葡萄糖液 |
注:血酮体≥3.0 mmol/L、尿酮体为大量时,需警惕发生糖尿病酮症酸中毒的风险。每2小时监测1次血糖和血、尿酮体,若仍异常,间隔2~4 h可再次给予1次胰岛素
1.糖皮质激素治疗所致高血糖(类固醇糖尿病)管理策略:很多疾病(如自身免疫性疾病、肾脏疾病、哮喘、支气管肺发育不良等)以及肿瘤辅助化疗等均可能应用糖皮质激素[6, 28]。糖皮质激素本身可导致血糖升高及增加感染风险,长期使用也会导致继发性糖尿病[6]。此类患者因使用的药物不同,血糖升高的节律有所不同,但控制目标是相同的,空腹血糖或餐前血糖4.0~7.0 mmol/L,餐后2 h血糖或不能进食时任意时点血糖5.0~10.0 mmol/L。建议根据糖皮质激素剂型特点和使用方案制定胰岛素治疗方案。对于早上1次顿服糖皮质激素的患者,可以给予早餐前中效胰岛素,其起效时间和达峰时间正好与糖皮质激素血药浓度变化一致。一日多次服用糖皮质激素的患者可使用一日多次注射短效或速效胰岛素联合基础胰岛素方案。对于应用长效糖皮质激素者,可以选择长效胰岛素控制血糖。对于正在使用胰岛素降糖治疗的糖尿病患者,若需要口服糖皮质激素,可在原方案基础上加用中效胰岛素。每日胰岛素使用剂量可根据糖皮质激素总量进行估算:波尼松用量≥40 mg/d对应的胰岛素剂量为0.4 U/kg;波尼松用量30、20、10 mg/d对应的胰岛素剂量分别为0.3、0.2、0.1 U/kg[29]。二甲双胍是常用的治疗糖尿病的口服降糖药物,可以增加胰岛素敏感性、延缓糖异生,其用于糖皮质激素所致的高血糖患者可以改善代谢指标,减少胰岛素剂量,在降糖方面安全有效,故推荐用于肥胖的2型糖尿病患儿,但应注意观察其胃肠道不良反应[30, 31]。除药物治疗外,对于应用类固醇激素的患者,若病情允许,建议适当增加活动量,有条件者可请营养科协助制定膳食方案,采用低升糖指数且同时兼顾患儿生长发育的食谱以协助预防高血糖及减少血糖波动。
2.恶性肿瘤患儿住院期间高血糖管理策略:恶性肿瘤(如白血病、实体瘤等)在治疗期间常常会合并高血糖,患病率为10%~20%[32, 33]。主要与化疗药物(门冬酰胺酶、雷帕霉素靶蛋白抑制剂、酪氨酸激酶抑制剂、免疫抑制剂等)以及辅助化疗药物(主要是地塞米松、泼尼松等)有关[28]。早期识别和发现高血糖有助于预防酮症酸中毒和高血糖高渗状态[34],此外,与成人类似,肿瘤患儿治疗期间合并高血糖会增加感染风险、降低生存率[35]。急性淋巴细胞白血病患儿若具备年龄(≥10岁)、合并Down综合征以及中枢神经系统受累等因素,化疗期间更易出现高血糖[32, 36]。恶性肿瘤化疗期间高血糖很常见,但是除辅助化疗药物类固醇所致糖尿病外,国际上尚无儿童恶性肿瘤患儿住院期间合并高血糖的管理指南和共识。成人对于肿瘤患者建议选择相对宽松的血糖控制目标[4, 5],与成人不同的是,儿童血液肿瘤(如急性淋巴细胞白血病)治疗缓解率高,故建议对于儿童恶性肿瘤患儿应综合考虑肿瘤类型、预期寿命、家庭及自我看护条件、低血糖的风险等设定个体化血糖控制目标。在血糖监测方面,因可能处于贫血状态及属于急性高血糖,故不推荐采用糖化血红蛋白作为监测指标,可采用糖化白蛋白监测血糖。恶性肿瘤患儿因机体处于消耗状态,且化疗药物易造成恶心、呕吐等消化道不适,既需要增加营养也需控制碳水化合物摄入,故更需要加强膳食营养管理。
3.接受肠外、肠内营养患者高血糖管理策略:此类患者发生低血糖的风险大,对血糖控制方案的执行较为困难,因此,严格控制血糖的获益/风险比下降。对此类患者,治疗期相对短,因此,首要目的是防止低血糖,其次才是控制高血糖[4]。但是,对于诊断糖尿病者,即使完全不进食也需要给予基础胰岛素,切勿自行停止胰岛素注射。临床上,一旦接受肠内或肠外营养,就应当进行常规血糖监测。每4~6小时监测1次血糖,若24~48 h的血糖值均低于7.8 mmol/L,可以停止血糖监测。如果发现高血糖,血糖在7.8~10.0 mmol/L,可以采取调整胃肠/胃肠外营养配比;如果血糖持续超过10.0 mmol/L,无论既往有无糖尿病病史,均应启动胰岛素治疗计划,可给予持续胰岛素静脉输注。
如下处理策略更为灵活简便,可供选用:(1)持续肠内、肠外营养者:每日1次或2次皮下注射基础胰岛素,同时,根据每时间段肠内营养的热卡量及营养素内容,加用不同的胰岛素,根据胰岛素起效时间、达峰时间、持续时间个体化选择,例如每6~8小时给予中效胰岛素,或必要时予短效或速效胰岛素皮下注射;(2)分次肠内营养:基础胰岛素方案同持续肠内营养,同时,在每次进行肠内营养时,给予短效或速效胰岛素皮下注射[5]。
已诊断糖尿病的患者出院后继续内分泌专科随诊,监测血糖和调整药物剂量。未达到糖尿病诊断标准的患者,建议1个月后在内分泌专科医师处进行评估和随访。
综上所述,对于所有住院患者,高血糖是常见的、严重的、花费巨大的健康问题,不容忽视。住院患者高血糖管理,应坚持以不同病情人群为标准的分层血糖管理原则。胰岛素静脉输注和胰岛素多次皮下注射(基础+餐时胰岛素)方案简明易懂,可操作性强,方便非内分泌专业医生对相关科室患儿的及时处理,使血糖得以安全、有效地控制达标。然而,尚有部分患者集多种复杂因素于一身,血糖管理难度大,需要包括内分泌医师在内的多学科共同参与管理,及时多学科会诊有助于院内血糖控制平稳达标。以内分泌专业医师为核心,集合临床药师、营养师、专科护理为团队,通过网络技术等手段实时互动,便于及时调整血糖管理方案的院内信息化管理模式可以提高治疗效果、节省住院时间[37]并减少院内交叉感染,推荐有条件的医疗单位积极摸索开展。
执笔者:李乐乐,国家儿童医学中心(北京),首都医科大学附属北京儿童医院内分泌遗传代谢科,100045,Email:lilele2006@163.com;钱素云,国家儿童医学中心(北京),首都医科大学附属北京儿童医院重症医学科,100045,Email:syqian1211@163.com;巩纯秀,国家儿童医学中心(北京),首都医科大学附属北京儿童医院内分泌遗传代谢科,100045,Email:chunxiugong@sina.com
专家委员会名单(按姓氏拼音排序):陈临琪(苏州大学附属儿童医院);陈瑞敏(福建医科大学附属福建省福州儿童医院);陈晓波(首都儿科研究所附属儿童医院);程昕然(电子科技大学医学院附属妇女儿童医院,成都市妇女儿童中心医院);杜宏伟(吉林大学第一医院);范歆(广西医科大学第二附属医院);傅君芬(国家儿童健康与疾病临床医学研究中心,浙江大学医学院附属儿童医院);巩纯秀[国家儿童医学中心(北京),首都医科大学附属北京儿童医院];顾威(南京医科大学附属儿童医院);李嫔(上海交通大学附属儿童医院);刘春峰(中国医科大学附属盛京医院);刘戈力(天津医科大学总医院);刘霞(深圳市儿童医院);陆国平[国家儿童医学中心(上海),复旦大学附属儿科医院];罗飞宏[国家儿童医学中心(上海),复旦大学附属儿科医院];罗小平(华中科技大学同济医学院附属同济医院);钱素云[国家儿童医学中心(北京),首都医科大学附属北京儿童医院];卫海燕(郑州大学附属儿童医院);吴迪[国家儿童医学中心(北京),首都医科大学附属北京儿童医院];杨玉(江西省儿童医院);郑荣秀(天津医科大学总医院);张会丰(河北医科大学第二医院);许峰(国家儿童健康与疾病临床医学研究中心,重庆医科大学附属儿童医院)
所有作者均声明不存在利益冲突



























