
观察无创正压通气(NIPPV)和经鼻高流量氧疗(HFNC)对新型冠状病毒肺炎(新冠肺炎)并发急性呼吸窘迫综合征(ARDS)患者预后的影响。
采用回顾性研究方法,选择2020年2月至4月作者援鄂期间在华中科技大学同济医学院附属同济医院收治的脉搏血氧饱和度/吸入氧浓度比值(SpO2/FiO2,S/F)<235〔利用S/F比值代替氧合指数(PaO2/FiO2)诊断ARDS〕的新冠肺炎患者。按氧疗模式不同将患者分为NIPPV组和HFNC组。收集患者的临床资料,包括:一般特征、呼吸频率(RR)、FiO2、SpO2、心率(HR)、平均动脉压(MAP),最初72 h S/F比值、入院/出院前/死亡前淋巴细胞计数(LYM)、淋巴细胞比例(LYM%)、白细胞计数(WBC)、通气前呼吸困难病程、发病至入院时间等,比较不同氧疗模式患者需要插管率、全因病死率、S/F比值和RR改善情况的差异。采用单因素分析和广义估计方程(GEE)方法分析影响S/F比值的危险因素。
41例患者中男性比例较高(占68.3%,28例),中位年龄68(58~74)岁,28例有合并症(占68.3%),发生多器官功能障碍综合征(MODS)34例(占82.9%)。与HFNC组比较,NIPPV组合并症更多〔87.5%(21/24)比41.2%(7/17),P<0.05〕,LYM%更低〔5.3%(3.4%~7.8%)比10.0%(3.9%~19.7%),P<0.05〕,血液净化治疗率也更低〔0%(0/24)比29.4%(5/17),P<0.05〕。随时间延长,NIPPV组治疗2 h后S/F比值逐渐升高,RR逐渐下降;HFNC组S/F比值较基线有下降趋势,两组各时间点S/F比值比较差异均无统计学意义,而RR则较基线有上升趋势,治疗2 h NIPPV组RR明显高于HFNC组〔次/min:30(27~33)比24(21~27),P<0.05〕。NIPPV组与HFNC组需要插管率和病死率比较差异均无统计学意义〔66.7%(16/24)比70.6%(12/17),58.3%(14/24)比52.9%(9/17),均P>0.05〕。分析影响氧疗过程中S/F比值的因素显示:氧疗方式和入院时病程是影响患者S/F比值的因素〔β值分别为-15.827、1.202,95%可信区间(95%CI)分别为-29.102~-2.552和0.247~2.156,P值分别为0.019、0.014〕。
与HFNC相比,NIPPV未显著降低新冠肺炎合并ARDS患者的需要插管率和病死率,但可显著提高新冠肺炎患者的S/F比值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
自新型冠状病毒肺炎(新冠肺炎)在全球暴发以来,病死率高达15.6%[1],严重威胁人类生命。目前大型临床试验表明,抗病毒药物[2]、白细胞介素-6受体拮抗剂[3]并未降低新冠肺炎患者病死率,而干细胞[4]、康复期血浆[5]治疗新冠肺炎并发ARDS患者,因纳入病例数量少、混杂因素较多等无法在临床上大规模推广,目前仍无特效药物治疗,而氧疗是重症新冠肺炎患者最基本也最重要的措施,因此重症新冠肺炎患者的最佳氧疗方式一直备受人们的广泛关注。
研究表明,无创正压通气(non-invasive positive pressure ventilation,NIPPV)和经鼻高流量氧疗(high-flow nasal cannula oxygen therapy,HFNC)可以降低非新冠肺炎导致的低氧血症患者插管率[6,7]。但目前鲜见有关NIPPV和HFNC在新冠肺炎难治性低氧血症患者中优越性及安全性比较的研究。本研究通过观察NIPPV和HFNC对新冠肺炎并发急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)患者临床疗效的影响,以期为临床治疗新冠肺炎提供参考。
采用回顾性研究方法,收集2020年2月至4月作者援鄂期间在华中科技大学同济医学院附属同济医院收治的新冠肺炎并发ARDS接受NIPPV和HFNC患者的临床资料。由于新冠肺炎发病初期动脉血气值缺乏,因此,脉搏血氧饱和度/吸入氧浓度比值〔pulse oxygen saturation/fraction of inspiration oxygen,SpO2/FiO2(S/F)〕被用于替代诊断ARDS的氧合指数(PaO2/FiO2)[8,9]。
① S/F比值<235,符合ARDS诊断;②应用NIPPV和HFNC>12 h/d;③年龄>18岁。
①入院后24 h死亡;②血流动力学不稳定;③格拉斯哥昏迷评分(Glasgow coma scale,GCS)评分<12分;④不能耐受NIPPV和HFNC;⑤存在谵妄;⑥氧疗资料不完整。
本研究符合医学伦理学标准,并经北京大学第三医院伦理委员会批准(审批号:2020-047-01),对患者采取的治疗和检测均参照实时新冠肺炎诊疗方案。
将患者按氧疗模式不同分为NIPPV组和HFNC组。
① NIPPV方案:在一定程度上支持压力取决于患者耐受性,压力和FiO2滴定至SpO2≥0.94,NIPPV患者在进食时给予经鼻导管吸氧;② HFNC方案:经鼻导管持续给予高流量湿化的氧气(37 ℃,44 cmH2O/L),最初流速设定为50 L/min,如果可能可上调至70 L/min,最初FiO2为0.70,后续调整根据目标值维持SpO2≥0.94。
①患者血流动力学不稳定或心电不稳定;②意识状态恶化;③存在以下至少2条以上呼吸衰竭(呼衰)持续存在或恶化的表现:呼吸频率(respiratory rate,RR)>40次/min;呼吸肌负荷过重无明显改善;气道分泌物明显增多;酸中毒:pH值<7.35;吸入纯氧的条件下SpO2<0.90在5 min以上。
查阅电子病历系统、特护记录及实验室检查报告,收集患者一般特征、合并症、心率(heart rate,HR)、平均动脉压(mean arterial pressure,map)、RR、FiO2、SpO2、NIPPV和HFNC最初72 h S/F比值,患者入院时和出院前或死亡前淋巴细胞计数(lymphocyte count,LYM)、淋巴细胞比例(percentage of lymphocytes,LYM%)及白细胞计数(white blood cell count,WBC),NIPPV和HFNC前呼吸困难时间以及入院前病程。分析并比较NIPPV组和HFNC组患者主要研究结局(插管率、插管前NIPPV或HFNC时间、插管原因、全因病死率、死亡原因)、S/F比值和RR,以及插管前病程、次要研究结局〔血液净化治疗率、器官功能衰竭和多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)发生率〕的差异。
使用SPSS 26.0统计软件分析数据。由于小样本量评估连续变量正态性的困难,因此以中位数(范围)〔M(范围)〕来描述连续变量,采用非参数检验。分类变量以例(%)表示,采用χ2检验。采用广义估计方程(generalized estimation equation,GEE)分析吸氧过程中氧疗方式与S/F比值的关系。P<0.05为差异有统计学意义。
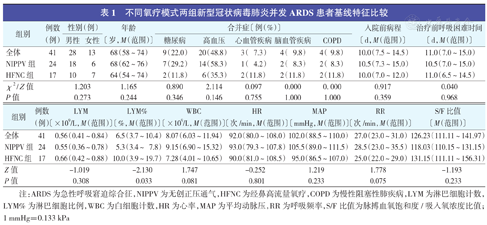
不同氧疗模式两组新型冠状病毒肺炎并发ARDS患者基线特征比较
不同氧疗模式两组新型冠状病毒肺炎并发ARDS患者基线特征比较
| 组别 | 例数(例) | 性别(例) | 年龄〔岁,M(范围)〕 | 合并症〔例(%)〕 | 入院前病程〔d,M(范围)〕 | 治疗前呼吸困难时间〔d,M(范围)〕 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 男性 | 女性 | 糖尿病 | 高血压 | 心血管疾病 | 脑血管疾病 | COPD | |||||
| 全体 | 41 | 28 | 13 | 68(58~74) | 9(22.0) | 20(48.8) | 3( 7.3) | 4( 9.8) | 4( 9.8) | 10.0(7.5~14.5) | 11.0(7.0~15.0) |
| NIPPV组 | 24 | 18 | 6 | 68(62~76) | 7(29.2) | 14(58.3) | 1( 4.2) | 2( 8.3) | 2( 8.3) | 10.5(7.3~15.0) | 10.5(7.0~15.0) |
| HFNC组 | 17 | 10 | 7 | 64(54~74) | 2(11.8) | 6(35.3) | 2(11.8) | 2(11.8) | 2(11.8) | 10.0(7.0~12.0) | 11.0(6.5~14.5) |
| χ2/ Z值 | 1.203 | 1.165 | 0.890 | 2.114 | 0.097 | 0.000 | 0. 000 | 0.917 | 0.040 | ||
| P值 | 0.273 | 0.244 | 0.346 | 0.146 | 0.755 | 1.000 | 1.000 | 0.359 | 0.968 | ||
| 组别 | 例数(例) | LYM〔×109/L,M(范围)〕 | LYM%〔%,M(范围)〕 | WBC〔×109/L,M(范围)〕 | HR〔次/min,M(范围)〕 | MAP〔mmHg,M(范围)〕 | RR〔次/min,M(范围)〕 | S/F比值〔M(范围)〕 |
|---|---|---|---|---|---|---|---|---|
| 全体 | 41 | 0.56(0.41~0.84) | 6.5(3.7~10.4) | 8.07(6.03~11.94) | 92.0(80.0~108.0) | 102.0(88.5~110.0) | 27.0(23.0~31.0) | 126.23(111.11~141.97) |
| NIPPV组 | 24 | 0.55(0.36~0.78) | 5.3(3.4~7.8) | 9.15(6.90~15.32) | 93.0(79.3~107.8) | 105.5(89.0~111.5) | 28.5(23.0~35.5) | 118.03(110.15~131.15) |
| HFNC组 | 17 | 0.66(0.42~0.88) | 10.0(3.9~19.7) | 7.28(4.01~10.65) | 90.0(81.0~108.5) | 95.0(86.5~107.0) | 25.0(22.0~29.0) | 131.15(111.11~156.31) |
| Z值 | -1.019 | -2.130 | 1.747 | -0.252 | 1.219 | 1.778 | -1.193 | |
| P值 | 0.308 | 0.033 | 0.081 | 0.801 | 0.233 | 0.075 | 0.233 |
注:ARDS为急性呼吸窘迫综合征,NIPPV为无创正压通气,HFNC为经鼻高流量氧疗,COPD为慢性阻塞性肺疾病,LYM为淋巴细胞计数,LYM%为淋巴细胞比例,WBC为白细胞计数,HR为心率,MAP为平均动脉压,RR为呼吸频率,S/F比值为脉搏血氧饱和度/吸入氧浓度比值;1 mmHg=0.133 kPa
共收治69例新冠肺炎并发ARDS患者,其中实施NIPPV 46例,HFNC患者17例,面罩给氧6例。46例NIPPV患者中排除22例:NIPPV治疗前休克3例,昏迷3例,NIPPV不能耐受5例,NIPPV<4 h 3例,S/F比值≥235 1例,NIPPV电子病历缺失6例,入院后24 h内死亡1例。最后纳入患者NIPPV组24例和HFNC组17例。41例患者大多数为男性,28例有合并症。NIPPV组合并症比例明显高于HFNC组〔87.5%(21/24)比41.2%(7/17),P<0.05〕,LYM%明显低于HFNC组(P<0.05)。两组性别、年龄、入院前病程、治疗前呼吸困难时间、LYM、WBC、HR、MAP、RR和S/F比值比较差异均无统计学意义(均P>0.05)。
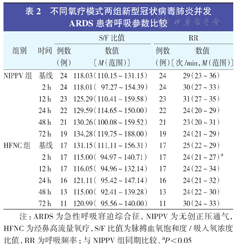
不同氧疗模式两组新型冠状病毒肺炎并发ARDS患者呼吸参数比较
不同氧疗模式两组新型冠状病毒肺炎并发ARDS患者呼吸参数比较
| 组别 | 时间 | S/F比值 | RR | ||
|---|---|---|---|---|---|
| 例数(例) | 数值〔M(范围)〕 | 例数(例) | 数值〔次/min,M(范围)〕 | ||
| NIPPV组 | 基线 | 24 | 118.03(110.15~131.15) | 24 | 29(23~36) |
| 2 h | 24 | 118.01( 97.27~154.39) | 24 | 30(27~33) | |
| 12 h | 23 | 125.29(110.41~159.58) | 23 | 31(27~35) | |
| 24 h | 22 | 129.59(114.65~150.00) | 22 | 24(20~29) | |
| 48 h | 21 | 130.26(100.08~159.52) | 21 | 23(20~31) | |
| 72 h | 19 | 134.28(119.75~188.00) | 19 | 24(21~29) | |
| HFNC组 | 基线 | 17 | 131.15(111.11~156.31) | 17 | 25(22~29) |
| 2 h | 17 | 115.00( 94.97~140.71) | 17 | 24(21~27)a | |
| 12 h | 17 | 116.05( 94.96~132.14) | 17 | 24(22~34) | |
| 24 h | 16 | 121.11( 95.42~147.14) | 16 | 24(21~32) | |
| 48 h | 13 | 115.00( 92.41~139.28) | 13 | 24(22~30) | |
| 72 h | 11 | 120.99( 95.56~140.00) | 11 | 30(24~33) | |
注:ARDS为急性呼吸窘迫综合征,NIPPV为无创正压通气,HFNC为经鼻高流量氧疗,S/F比值为脉搏血氧饱和度/吸入氧浓度比值,RR为呼吸频率;与NIPPV组同期比较,aP<0.05
与HFNC组比较,NIPPV组治疗2、12、24、48、72 h S/F比值有升高趋势,但两组比较差异均无统计学意义(均P>0.05)。而HFNC组治疗2 h RR较NIPPV组明显降低,差异有统计学意义(P<0.05),两组其余各时间点RR比较差异均无统计学意义(均P>0.05)。
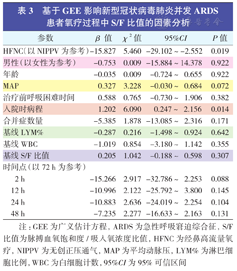
基于GEE影响新型冠状病毒肺炎并发ARDS患者氧疗过程中S/F比值的因素分析
基于GEE影响新型冠状病毒肺炎并发ARDS患者氧疗过程中S/F比值的因素分析
| 参数 | β值 | χ2值 | 95%CI | P值 | |
|---|---|---|---|---|---|
| HFNC(以NIPPV为参考) | -15.827 | 5.460 | -29.102~-2.552 | 0.019 | |
| 男性(以女性为参考) | -0.753 | 0.009 | -15.884~14.378 | 0.922 | |
| 年龄 | -0.035 | 0.009 | -0.724~0.655 | 0.922 | |
| MAP | 0.327 | 3.228 | -0.030~0.684 | 0.072 | |
| 治疗前呼吸困难时间 | 0.588 | 0.765 | -0.730~1.906 | 0.382 | |
| 入院时病程 | 1.202 | 6.090 | 0.247~2.156 | 0.014 | |
| 合并症数量 | -5.385 | 1.878 | -13.085~2.316 | 0.171 | |
| 基线LYM% | -0.287 | 0.216 | -1.498~0.924 | 0.642 | |
| 基线WBC | -1.019 | 0.854 | -3.180~1.142 | 0.355 | |
| 基线S/F比值 | 0.205 | 1.042 | -0.188~0.598 | 0.307 | |
| 时间点(以72 h为参考) | |||||
| 2 h | -15.266 | 2.917 | -32.786~2.253 | 0.088 | |
| 12 h | -10.996 | 2.122 | -25.792~3.800 | 0.145 | |
| 24 h | -10.883 | 2.636 | -24.019~2.254 | 0.104 | |
| 48 h | -7.235 | 2.277 | -16.633~2.163 | 0.131 | |
注:GEE为广义估计方程,ARDS为急性呼吸窘迫综合征,S/F比值为脉搏血氧饱和度/吸入氧浓度比值,HFNC为经鼻高流量氧疗,NIPPV为无创正压通气,MAP为平均动脉压,LYM%为淋巴细胞比例,WBC为白细胞计数,95%CI为95%可信区间
剔除缺失数据的个体后,共有184组资料(占205组资料总数的89.8%)被用于构建GEE模型。GEE结果显示,在控制其他因素后,入院时的氧疗方式及病程是影响S/F比值的因素。入院前病程越长,氧疗后S/F比值改善越好。
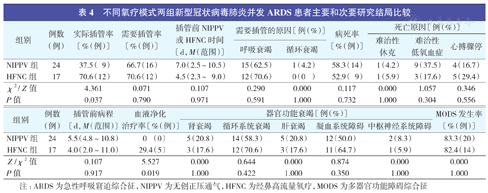
不同氧疗模式两组新型冠状病毒肺炎并发ARDS患者主要和次要研究结局比较
不同氧疗模式两组新型冠状病毒肺炎并发ARDS患者主要和次要研究结局比较
| 组别 | 例数(例) | 实际插管率〔%(例)〕 | 需要插管率〔%(例)〕 | 插管前NIPPV或HFNC时间〔d,M(范围)〕 | 需要插管的原因〔例(%)〕 | 病死率〔%(例)〕 | 死亡原因〔例(%)〕 | |||
|---|---|---|---|---|---|---|---|---|---|---|
| 难治性休克 | 难治性低氧血症 | 心搏骤停 | ||||||||
| 呼吸衰竭 | 循环衰竭 | |||||||||
| NIPPV组 | 24 | 37.5( 9) | 66.7(16) | 7.0(2.5~10.5) | 15(62.5) | 1(4.2) | 58.3(14) | 1(4.2) | 9(37.5) | 4(16.7) |
| HFNC组 | 17 | 70.6(12) | 70.6(12) | 4.5(2.3~9.0) | 12(70.6) | 0(0 ) | 52.9( 9) | 1(5.9) | 3(17.6) | 5(29.4) |
| χ2/Z值 | 4.361 | 0.071 | 0.107 | 0.290 | 0.000 | 0.117 | 0.000 | 1.057 | 0.346 | |
| P值 | 0.037 | 0.790 | 0.971 | 0.591 | 1.000 | 0.732 | 1.000 | 0.304 | 0.556 | |
| 组别 | 例数(例) | 插管前病程〔d,M(范围)〕 | 血液净化治疗率〔%(例)〕 | 器官功能衰竭〔例(%)〕 | MODS发生率〔%(例)〕 | ||||
|---|---|---|---|---|---|---|---|---|---|
| 肾衰竭 | 循环系统衰竭 | 肝衰竭 | 凝血系统障碍 | 中枢神经系统障碍 | |||||
| NIPPV组 | 24 | 5.5(4.8~10.8) | 0 (0) | 5(20.8) | 14 (58.3) | 5 (20.8) | 12 (50.0) | 2 (8.3) | 83.3(20) |
| HFNC组 | 17 | 4.0(2.0~11.0) | 29.4(5) | 3(17.6) | 12 (70.6) | 3 (17.6) | 11 (64.7) | 1 (5.9) | 82.4(14) |
| Z /χ2值 | 0.107 | 5.527 | 0.000 | 0.644 | 0.000 | 0.874 | 0.000 | 0.000 | |
| P值 | 0.917 | 0.019 | 1.000 | 0.422 | 1.000 | 0.350 | 1.000 | 1.000 | |
注:ARDS为急性呼吸窘迫综合征,NIPPV为无创正压通气,HFNC为经鼻高流量氧疗,MODS为多器官功能障碍综合征
两组总病死率为56.1%(23/41)。NIPPV组实际插管率和血液净化治疗率均显著低于HFNC组(均P<0.05)。两组需要插管率、插管前NIPPV或HFNC时间、需要插管的原因、病死率、死亡原因、插管前病程、器官功能衰竭和MODS发生率比较差异均无统计学意义(均P>0.05)。
新冠肺炎重症患者表现为严重的呼吸困难症状和免疫损伤,LYM、CD4+下降,白细胞介素-6(interleukin-6,IL-6)显著升高[12,13],透明膜形成和间质单核细胞炎性浸润是其病理特征[14,15]。Chopra等[16]报道重症新冠肺炎患者病死率高达62.5%。病情快速进展使重症患者的治疗极具挑战性。早期确定最佳治疗方案,特别是机械通气方式,可以改善由新冠肺炎引起ARDS危重患者的预后。但国内以个案报道多见,如郝泉水等[17]及何慧洁等[18]的研究表明,无创通气失败后积极有创机械通气可改善新冠肺炎患者预后,但目前尚无大宗病例报告。
与文献报告结果相似[19],本研究结果显示,NIPPV对代表PaO2/FiO2指标的S/F改善程度较HFNC更优,但NIPPV在降低新冠肺炎并发ARDS患者的插管率和病死率方面并不优于HFNC,且需要插管率高达66.7%,显著高于非新冠肺炎相关ARDS患者的无创通气失败率(31.0%~61.5%)[20,21,22],但与H1N1(94%)[23]和中东呼吸综合征(57.1%)并发ARDS [24]的NIPPV失败率基本相似。本研究显示,HFNC的需要插管率也高达70.6%,显著高于急性低氧性呼衰患者HFNC的失败率(21%~55%)[11,25,26,27,28],但与Hernandez-Romieu等[29]报告新冠肺炎患者HFNC的失败率相似(71.6%),提示以双肺弥漫性浸润为特征的流行性病毒性疾病NIPPV或HFNC失败的风险极高。本研究NIPPV组实际插管率显著低于HFNC组,分析其原因可能与NIPPV改善了患者的呼吸症状如S/F比值,从而掩盖了病情的进展有关。本研究表明,患者入院时病程越长,氧疗后S/F比值改善越好,分析可能与病情进展较慢的患者,肺部病变相对急性起病者较轻有关。
本研究NIPPV组和HFNC组病死率显著高于文献报道非新冠肺炎相关ARDS患者接受NIPPV治疗的病死率(35%)[30]和HFNC的病死率(6.8%~20.0%)[1,26,27]。本研究HFNC的插管率与Hernandez-Romieu等[29]报告新冠肺炎HFNC的插管率相似,但病死率高于Hernandez-Romieu等[29]的研究结果,NIPPV组患者病死率与Burns等[31]和Chopra等[16]报告的病死率接近(58.3%比50%、62.5%),但在Burns等[31]的研究中患者有更多合并症和更高的器官功能衰竭发生率,而Chopra等[16]的研究显示,机械通气组有更高的气压伤,认为气压伤作为肺部疾病进展的结果可能是高病死率的重要原因之一。本研究患者MODS的发生率高达82.9%,提示本研究所涉及的患者疾病严重程度较重。难治性低氧血症、LYM和LYM%下降伴随MODS及心搏骤停是本研究病死率较高的原因,与文献报道结果相似[32,33,34,35]。尽管Hernandez-Romieu等[29]发现,延迟插管与病死率无关,但此研究延迟插管时间不超过1 d,而本研究与其他研究[11]相比,插管前NIPPV或HFNC时间显著延长,表明延迟插管可能会导致呼吸机相关性肺损伤、呼吸肌疲劳和氧债务增加[36,37]。另外普通病房医护人员对NIPPV插管时机的评估能力可能是其失败的另一个重要原因[38,39]。ICU床位不足[40]及氧疗设备短缺是各国疫情暴发初期面临的严重问题,增加重症新冠肺炎患者的死亡风险,因此监测ICU床位负荷与需求、及时调整ICU的床位供应和具备重症监护能力的医务人员数量是降低病死率的重要措施。
综上所述,对新冠肺炎并发ARDS患者使用NIPPV和HFNC应根据反映PaO2/FiO2的S/F比值、呼吸困难症状如RR、辅助呼吸支持水平及器官功能状态等综合评估,在短时间内无明显好转应快速进行气管插管呼吸机辅助通气,减少呼吸肌疲劳和氧债务;同时应加强普通病房医护人员对NIPPV和HFNC流程、报警的处理能力、插管时机的培训,以便在疫情暴发时快速组建应对重症病情的精锐队伍,才能在疾病早期使患者得到最优化的氧疗方案,从而改善患者预后。
所有作者均声明不存在利益冲突



























