
评价洛匹那韦利托那韦和阿比多尔对治疗新型冠状病毒肺炎的有效性。
回顾性分析2020年1月20日至2月6日上海市公共卫生临床中心收治的134例新型冠状病毒肺炎患者的临床资料。134例患者均接受重组人干扰素α2b喷雾治疗及对症支持治疗,其中52例患者口服抗病毒药物洛匹那韦利托那韦,34例患者口服抗病毒药物阿比多尔,48例患者不服用任何抗病毒药物。比较3组患者的治疗效果。统计学分析采用卡方检验。
134例患者中,男69例(51.5%),女65例(48.5%),年龄范围为35~62岁,平均年龄为48岁。阿比多尔组和洛匹那韦利托那韦组患者体温恢复正常的中位时间均为6 d,对照组为4 d,3组间差异无统计学意义(χ2=2.37,P=0.31)。3组患者呼吸道标本病毒核酸转阴中位时间均为治疗后7 d,洛匹那韦利托那韦组第7天病毒核酸转阴率为71.8%(28/39),阿比多尔组为82.6%(19/23),对照组为77.1%(27/35),差异无统计学意义(χ2=0.46, P=0.79)。洛匹那韦利托那韦组[42.3%(22/52)]、阿比多尔组[35.3%(12/34)]和对照组[52.1%(25/48)]患者治疗后第7天影像学仍为进展表现(χ2=2.38, P=0.30)。洛匹那韦利托那韦组不良反应生率为17.3%(9/52),阿比多尔组为8.8%(3/34),对照组为8.3%(4/48),3组间差异无统计学意义(χ2=2.33, P=0.33)。
未发现洛匹那韦利托那韦和阿比多尔具有改善新型冠状病毒肺炎患者症状或缩短呼吸道标本病毒核酸转阴时间的作用,其有效性仍有待进一步临床研究确认。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2020年1月7日,中国有关部门确认了一种由新型冠状病毒引起的传染性疾病[1];1月12日,得益于科研工作者的努力,中国科学家分享了这种新型冠状病毒的基因序列信息[2]。
近年来,在国际范围内由冠状病毒引起的大流行性疾病包括严重急性呼吸综合征(severe acute respiratory syndrome,SARS)和中东呼吸综合征(Middle East respiratory syndrome,MERS)。已有研究表明,2019新型冠状病毒(2019 novel coronavirus,2019-nCoV)与严重急性呼吸综合征冠状病毒(severe acute respiratory syrdrome coronavirus, SARS-CoV)的基因组序列高度同源,引起的病毒性肺炎在症状方面也与SARS有一些相似之处[3]。目前,新型冠状病毒肺炎暂无特效药,多以对症支持治疗为主。根据既往治疗SARS与MERS的经验和相关临床及基础研究推测,洛匹那韦利托那韦可能对治疗新型冠状病毒肺炎具有一定疗效[4]。而阿比多尔作为专门预防和治疗流行性感冒的药物,体外实验证实其对SARS有效,在部分地区也被推荐应用[5]。因此,及时评价上述两种药物对新型冠状病毒肺炎的治疗效果具有重大意义。
上海市公共卫生临床中心作为上海市新型冠状病毒肺炎的定点收治医疗机构,自疫情暴发以来已陆续收治了多例感染者。在上海市卫生健康委员会领导的上海市新型冠状病毒肺炎治疗专家组的指导下,陆续形成了一系列救治方案。本研究纳入了在上海市公共卫生临床中心收治的新型冠状病毒肺炎患者,分析洛匹那韦利托那韦和阿比多尔在治疗中的作用,旨在为新型冠状病毒感染治疗方案的选择提供更多临床依据。
2020年1月20日至2月6日上海市公共卫生临床中心共收入262例新型冠状病毒肺炎患者。本研究纳入134例,其中男69例(51.5%),女65例(48.5%),年龄范围为35~62岁,平均年龄为48岁。纳入标准:①新型冠状病毒肺炎确诊患者;②患者呼吸道标本均经2019-nCoV核酸检测;③患者未使用过其他具有潜在抗病毒活性的药物。新型冠状病毒肺炎诊断标准根据国家卫生健康委员会发布的《新型冠状病毒感染的肺炎诊疗方案(试行第二版)》[6]。本研究通过上海市公共卫生临床中心伦理委员会审核批准(YJ-2020-S015-01)。
回顾性分析新型冠状病毒肺炎患者的临床治疗经过。134例患者均接受重组人干扰素α2b喷雾治疗以及对症支持治疗,其中52例患者口服抗病毒药物洛匹那韦利托那韦2片(每片含洛匹那韦200 mg,利托那韦50 mg),每12 h 1次,疗程为5 d;34例患者口服抗病毒药物阿比多尔200 mg(3次/d),疗程为5 d;48例患者不服用任何抗病毒药物作为对照组。因任何原因未能连续服用2 d抗病毒药物的患者,视为未服用抗病毒药物而纳入对照组。
呼吸道标本2019-nCov核酸检测以最后一次检测的结果和时间为准。如连续2次检测病毒核酸为阴性,则核酸转阴时间采用第1次检测的时间。
数据处理采用Stata 13.0统计软件。呈偏态分布的计量资料以M(P25,P75)表示,组间比较采用Kruskal-Wallis检验;计数资料以例数(百分数)表示,组间比较采用卡方检验或Fisher确切概率法。不同组间患者在体温恢复正常和病毒学转阴时间上的差异采用Kaplan-Meier曲线分析和Cox回归分析。P<0.05为差异有统计学意义。
洛匹那韦利托那韦组、阿比多尔组和对照组患者的人口学资料、临床表现、实验室检查和胸部CT检查情况比较,差异均无统计学意义(均P>0.05),见表1。
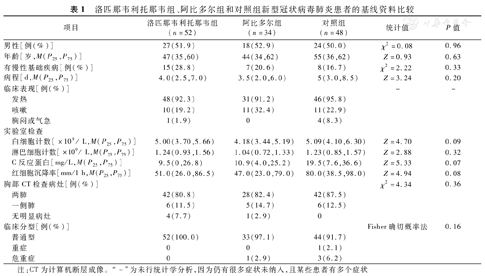
洛匹那韦利托那韦组、阿比多尔组和对照组新型冠状病毒肺炎患者的基线资料比较
洛匹那韦利托那韦组、阿比多尔组和对照组新型冠状病毒肺炎患者的基线资料比较
| 项目 | 洛匹那韦利托那韦组(n=52) | 阿比多尔组(n=34) | 对照组(n=48) | 统计值 | P值 | |
|---|---|---|---|---|---|---|
| 男性[例(%)] | 27(51.9) | 18(52.9) | 24(50.0) | χ2=0.08 | 0.96 | |
| 年龄[岁,M(P25,P75)] | 47(35,60) | 44(34,62) | 55(36,62) | Z=0.93 | 0.63 | |
| 有慢性基础疾病[例(%)] | 15(28.8) | 7(20.6) | 8(16.7) | χ2=2.22 | 0.33 | |
| 病程[d,M(P25,P75)] | 4.0(2.5,7.0) | 3.5(2.0,6.0) | 5(3.0,8.5) | Z=3.24 | 0.20 | |
| 临床表现[例(%)] | - | - | ||||
| 发热 | 48(92.3) | 31(91.2) | 46(95.8) | |||
| 咳嗽 | 10(19.2) | 11(32.4) | 11(22.9) | |||
| 胸闷或气急 | 1(1.9) | 0 | 4(8.3) | |||
| 实验室检查 | ||||||
| 白细胞计数[×109/ L,M(P25,P75)] | 5.00(3.70,5.66) | 4.18(3.44,5.19) | 5.09(4.10,6.30) | Z=4.70 | 0.09 | |
| 淋巴细胞计数[×109/ L,M(P25,P75)] | 1.24(0.93,1.56) | 1.04(0.72,1.33) | 1.23(0.85,1.57) | Z=2.88 | 0.32 | |
| C反应蛋白[mg/L,M(P25,P75)] | 9.5(0,26.8) | 10.9(4.0,25.2) | 19.5(7.6,36.6) | Z=5.33 | 0.07 | |
| 红细胞沉降率[mm/1 h,M(P25,P75)] | 51.0(26.0,86.5) | 47.0(23.0,79.0) | 80.0(38.5,98.0) | Z=4.94 | 0.08 | |
| 胸部CT检查病灶[例(%)] | χ2=4.34 | 0.36 | ||||
| 两肺 | 42(80.8) | 28(82.4) | 42(87.5) | |||
| 一侧肺 | 6(11.5) | 5(14.7) | 6(12.5) | |||
| 无明显病灶 | 4(7.7) | 1(2.9) | 0 | |||
| 临床分型[例(%)] | Fisher确切概率法 | 0.16 | ||||
| 普通型 | 52(100.0) | 33(97.1) | 44(91.7) | |||
| 重症 | 0 | 0 | 1(2.1) | |||
| 危重症 | 0 | 1(2.9) | 3(6.2) | |||
注:CT为计算机断层成像。"-"为未行统计学分析,因为仍有很多症状未纳入,且某些患者有多个症状
在住院治疗期间,52例洛匹那韦利托那韦组患者中2例(3.8%)发展为重症,2例(3.8%)发展为危重症;33例阿比多尔组普通型患者中,1例(3.0%)发展为重症;48例对照组患者中2例(4.2%)发展为重症。洛匹那韦利托那韦组和阿比多尔组患者体温恢复正常的中位时间均为6 d,而对照组为4 d,3组比较差异无统计学意义(χ2=2.37,P=0.31)。
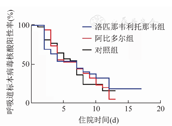
洛匹那韦利托那韦组、阿比多尔组和对照组患者呼吸道标本病毒核酸转阴中位时间均为治疗后7 d,见图1。鉴于3组患者入院时所处的病程阶段可能存在差异,将入院时的年龄、性别和发病天数纳入多因素分析,仍未发现3组患者呼吸道标本病毒核酸转阴时间差异有统计学意义,而高龄则不利于病毒核酸转阴(HR=0.98,P=0.02)。由于未能每天监测呼吸道标本病毒核酸,为计算治疗后第7天的实际病毒核酸转阴率,将入院治疗后7 d内呼吸道标本病毒核酸已转阴的人群视为第7天已转阴人群,而第7天及以后随访中病毒核酸呈阳性的患者视为第7天未转阴人群。洛匹那韦利托那韦组第7天病毒核酸转阴率为71.8%(28/39),阿比多尔组为82.6%(19/23),对照组为77.1%(27/35),3组间差异无统计学意义(χ2=0.46, P=0.79)。洛匹那韦利托那韦组[42.3%(22/52)]、阿比多尔组[35.3%(12/34)]和对照组[52.1%(25/48)]患者治疗后第7天影像学仍为进展表现(χ2=2.38, P=0.30)。在普通型的亚组分析中,3组患者呼吸道标本病毒核酸转阴中位时间均为治疗后7 d(χ2=1.31, P=0.52);洛匹那韦利托那韦组[42.3%(22/52)]、阿比多尔组[36.4%(12/33)]和对照组[47.7%(21/44)]患者治疗后第7天影像学仍为进展表现(χ2=1.00, P=0.61)。

在治疗过程中,52例洛匹那韦利托那韦组患者中9例(17.3%)出现不良反应,其中以恶心、腹泻等消化道症状为多见;34例阿比多尔组患者中3例(8.8%)出现不良反应,表现为腹泻;48例对照组中4例(8.3%)出现纳差、腹泻等不良反应;3组间差异无统计学意义(χ2=2.33, P=0.33)。洛匹那韦利托那韦组和对照组在治疗后分别有1例患者出现白细胞水平异常升高,考虑继发感染可能;3组各出现轻度肝功能损伤2例,洛匹那韦利托那韦组出现轻度肾功能损伤2例。所有出现不良反应的患者停药或给予对症支持治疗后好转。
当前尚无针对新型冠状病毒的疫苗和抗病毒药物,所以尽快寻找和确定针对新型冠状病毒肺炎的有效药物对控制患者病情极为重要。在一项发表于2004年的回顾性分析中,Chu等[4]对2003年中国香港41例SARS患者使用洛匹那韦利托那韦联合利巴韦林抗病毒治疗效果分析发现,联合应用治疗的临床效果显著优于单用利巴韦林的治疗效果。此后,洛匹那韦利托那韦联合干扰素β也被推荐用于治疗MERS[7]。在国家卫生健康委办公厅颁布的《新型冠状病毒感染的肺炎诊疗方案(试行第二版)》中推荐试用洛匹那韦利托那韦治疗新型冠状病毒肺炎[6]。阿比多尔具有广谱抗病毒活性,主要适用于由甲型、乙型流行性感冒病毒引起的上呼吸道感染。国外体外研究表明,25、50和100 μg/mL的阿比多尔可显著抑制SARS-CoV对绿猴肾细胞的感染[5,8]。但上述药物对于2019-nCoV的治疗效果尚缺乏临床数据支持。
本研究结果显示,洛匹那韦利托那韦组和阿比多尔组在改善患者临床症状(如体温恢复正常)和加快病毒清除方面均未优于对照组,而洛匹那韦利托那韦组的不良反应发生率却有高于对照组的趋势,这可能与使用的药物剂量或疗程有关。目前对上述两种药物的使用剂量和疗程尚无相关数据,本研究则初步采用了5 d的标准剂量治疗方案,更长疗程或更大剂量方案的有效性仍需进一步探索。当然也可能是上述两种药物对新型冠状病毒的抑制效果确实不佳。
本研究尚存在一些不足之处。首先,由于条件限制,并未每天采集患者咽拭子,也未能对病毒核酸进行定量检测,所以无法准确判断呼吸道标本的病毒转阴时间和药物的抗病毒效果。同时,由于采样、转运等环节的问题,目前认为核酸检测的灵敏度存在一定不足。其次,仅评估了第7天的病毒转阴率,尚未评估长期如14 d的抗病毒效果。最后,本研究主要纳入普通型肺炎患者,因此这两种药物在重症和危重症患者中的应用有待进一步评估。
总之,本研究未发现洛匹那韦利托那韦和阿比多尔具有改善患者症状或缩短呼吸道标本病毒核酸转阴时间的作用,因此上述两种药物对新型冠状病毒肺炎的治疗效果仍有待进一步评价。
所有作者均声明不存在利益冲突



























