
胃肠胰神经内分泌肿瘤(GEP-NEN)是起源于胃肠胰神经内分泌细胞的一组异质性肿瘤。近年来,随着发病率和诊断率的显著升高,GEP-NEN的规范治疗策略也越来越受到关注。GEP-NEN的诊疗需在多学科、个体化和精准医疗的理念指导下开展。现有的治疗手段主要包括手术治疗、放射介入治疗、肽受体介导的放射性核素治疗、化学治疗、生物治疗、分子靶向治疗等。近年来,随着对肿瘤免疫微环境研究的深入,免疫检查点靶向治疗在GEP-NEN领域也得到了初步探索。现主要对GEP-NEN的药物治疗进展进行总结。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
神经内分泌肿瘤(neuroendocrine neoplasm,NEN)是一组起源于神经内分泌细胞的分布广泛的复杂异质性肿瘤,其中胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine neoplasm, GEP-NEN)最常见,占所有NEN的65%~75%。2019年第5版WHO病理分级系统对胃肠/肝胆胰NEN的分类和分级标准进行了更新,将NEN分为分化好的神经内分泌瘤(neuroendocrine tumor,NET)和分化差的神经内分泌癌(neuroendocrine carcinoma, NEC),以及混合性神经内分泌-非神经内分泌肿瘤(mixed neuroendocrine-non-neuroendocrine neoplasm,MiNEN)。根据核分裂象和(或)Ki-67增殖指数进一步将NET分为G1、G2、G3级。NET包括G1、G2和G3 3个病理级别,其中G1和G2级的定义与2010年WHO第4版病理分级系统一致,而G3级NET则指Ki-67指数>20%,而具有高分化形态学特点的NEN(表1)。分化差的NEC包括小细胞神经内分泌癌(small cell neuroendocrine carcinoma, SCNEC)和大细胞神经内分泌癌(large cell neuroendocrine carcinoma, LCNEC)[1]。另外,根据肿瘤是否产生激素或存在激素相关症状,将GEP-NEN分为功能性和无功能性肿瘤。

2019年第5版世界卫生组织胃肠/肝胆胰神经内分泌肿瘤分类和分级标准
2019年第5版世界卫生组织胃肠/肝胆胰神经内分泌肿瘤分类和分级标准
| 命名 | 分化程度 | 分级 | 核分裂象数c(/2 mm2) | Ki-67指数c(%) |
|---|---|---|---|---|
| 神经内分泌瘤,G1级 | 高分化 | 低 | <2 | <3 |
| 神经内分泌瘤,G2级 | 高分化 | 中 | 2~20 | 3~20 |
| 神经内分泌瘤,G3级 | 高分化 | 高 | >20 | >20 |
| 小细胞神经内分泌癌 | 低分化 | 高 | >20 | >20 |
| 大细胞神经内分泌癌 | 低分化a | 高 | >20 | >20 |
| 混合性神经内分泌-非神经内分泌肿瘤 | 高或低分化b | 多样b | 多样b | 多样b |
注:a低分化神经内分泌癌并无正式分级,但根据其定义,一般考虑为高分级。b在大部分混合性神经内分泌-非神经内分泌肿瘤中,神经内分泌肿瘤和非神经内分泌肿瘤成分均为低分化,并且神经内分泌肿瘤成分的增殖指数与其他神经内分泌癌一致。但这一概念分类允许这两种成分均可能是高分化,并且这两种成分在适用的情况下均应分别进行分级。c核分裂象数表示为核分裂象计数/2 mm2(该面积为40倍放大倍数和每个视野直径0.5 mm情况下的10个高倍镜视野),计数50个0.2 mm2的视野;Ki-67指数通过计数高染色区域(即热点区)至少500个细胞获得;最终分级采用两种增殖指数所对应的分级中较高的分级
GEP-NEN总体治疗目标包括控制肿瘤生长,以及控制功能性肿瘤激素分泌过量导致的相关症状或者综合征2个方面。由于GEP-NEN的高度异质性,其治疗应根据肿瘤部位、功能状态、病理分级或分期,生长抑素受体(somatostatin receptor,SSTR)表达情况,以及药物毒性谱等因素进行综合分析,制定个体化的精准治疗方案。现参考欧洲神经内分泌肿瘤协会(European Neuroendocrine Tumor Society,ENETS)和美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)发布的最新版指南,并结合研究前沿,对GEP-NEN药物治疗进展作一系统介绍,为临床医师提供药物治疗方案参考。
对进展期GEP-NEN,目前用于控制肿瘤生长的药物包括生物治疗药物、分子靶向药物、细胞毒化学治疗药物,临床上主要按照肿瘤部位、分化、分级制定治疗策略(图1)。
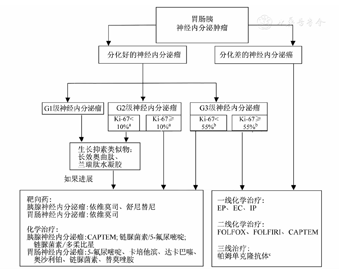

注:CAPTEM为替莫唑胺单药或联合卡培他滨;EP为依托泊苷+顺铂;EC为依托泊苷+卡铂;IP为伊立替康+顺铂;FOLFOX为奥沙利铂+亚叶酸钙+5-氟尿嘧啶;FOLFIRI为伊立替康+亚叶酸钙+5-氟尿嘧啶。a此Ki-67截断值基于CLARINET神经内分泌瘤研究;b此Ki-67截断值基于NORDIC神经内分泌癌研究;c2019美国国立综合癌症网络的指南,评估有错配修复缺陷和高度微卫星不稳定患者,在系统治疗后仍持续进展可作考虑
①生长抑素类似物(somatostatin analogue,SSA):SSA可通过结合SSTR发挥抗肿瘤增殖和促凋亡作用。目前,临床上最常用于胃肠胰神经内分泌瘤(gastroenteropancreatic neurendocrine tumor, GEP-NET)治疗的SSA包括长效奥曲肽(octreotide long-acting release)和兰瑞肽水凝胶(lanreotide autogel),其延缓肿瘤进展的疗效分别在PROMID和CLARINET两大Ⅲ期临床研究中得到证实[2,3]。2015年新一代广谱SSA帕瑞肽Ⅲ期临床试验报道,长效帕瑞肽用于伴有类癌综合征(carcinoid syndrome,CS)且对现有2种SSA治疗后症状复发的转移性消化道NET,其肿瘤控制效果优于长效奥曲肽并可获得更长的无进展生存期(progression-free survival, PFS)[4],然而这一研究仅纳入了部分有CS的NET。目前,ENETS和NCCN指南均推荐长效奥曲肽和兰瑞肽水凝胶为分化好(G1/G2级,Ki-67<10%)、SSTR阳性表达的转移性GEP-NET患者的一线治疗。
②干扰素:干扰素α-2b在NEN中也可发挥一定抗增殖作用。2017年SWOG研究报道,接受长效奥曲肽治疗的晚期G1或G2级NET患者中,联合干扰素α-2b组与联合贝伐单克隆抗体组相比,PFS分别为15.4和16.6个月,但差异无统计学意义[5]。此外,干扰素α-2b临床使用中不良反应发生率较高。因此,ENETS和NCCN指南均不推荐将其作为抗肿瘤生长的一线治疗,只有在少数无法接受其他抗肿瘤药物或多种抗肿瘤方案治疗失败的情况下才谨慎考虑。
近年来,分子靶向药物在GEP-NET的治疗中取得了明显的进展,主要致力于控制GEP-NET肿瘤细胞生长和血管新生。目前,最受关注的为哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)抑制剂和以血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)为靶点的抗血管新生抑制剂,目前这2类靶向药物主要应用于G1和G2级进展期GEP-NET的治疗,可作为SSA治疗失败后的二线治疗,或化学治疗、放射性核素治疗(peptide radio receptor therapy,PRRT)失败后的三线治疗。
①mTOR抑制剂:依维莫司是口服有效的mTOR抑制剂,其在胰腺神经内分泌瘤(pancreatic neuroendocrine tumor, pNET)、胃肠NET中延缓肿瘤进展的效果在大型Ⅲ期临床试验RADIANT-3、RADIANT-4中得到证实[6,7]。ENETS和NCCN指南推荐依维莫司可用于G1和G2级进展期GEP-NET的二线和(或)三线治疗。依维莫司存在不可忽略的不良反应,临床中需要全面评估患者基础状况,若存在难以控制的糖尿病或肺部疾病等,则应谨慎使用或采取其他替代方案。常规推荐口服剂量为10 mg/d,若患者耐受性较差,可减为5 mg/d。
② VEGFR抑制剂:舒尼替尼是口服有效的VEGFR抑制剂,其延缓pNET进展的效果已经得到大型Ⅲ期临床试验证实[8]。ENETS和NCCN指南均推荐,舒尼替尼可用于G1和G2级晚期pNET的临床治疗。常规推荐口服剂量为37.5 mg/d,若患者耐受性较差,可减为25 mg/d。而舒尼替尼在胃肠NET尚无相关Ⅲ期临床数据或指南推荐。目前,舒尼替尼用于晚期中肠NET的Ⅱ期临床试验SUNLAND尚在进行中。2019年,美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)年会发布TALENTⅡ期临床试验最新结果[9],仑伐替尼(新型VEGFR抑制剂)显示了迄今为止靶向药物治疗NET所能获得的最高的客观缓解率(objective response rate,ORR)(总ORR为29%,其中pNET高达42.3%, 胃肠NET为16.3%),以及很好的PFS,其可能成为GEP-NET分子靶向治疗的又一选择。
①化学治疗在G1和G2级NET中的应用:2016版ENETS指南对于化学治疗在G1和G2级NET中的推荐,主要适用于pNET [10]。在一线SSA治疗失败后,可以考虑采用化学疗法治疗pNET。那么在SSA后的二线方案选择中,与靶向药物相比,什么情况应该优先考虑化学治疗?一般认为,肿瘤负荷很大,临床症状明显,近6~12个月肿瘤快速进展并伴远处转移,或需要新辅助化学治疗手段为手术创造条件,则可优先考虑化学疗法。以链脲菌素(streptozocin)为基础的化学疗法是治疗pNET的常用选择。常用组合方案为链脲菌素联合5-氟尿嘧啶(5-fluorouracil)或联合多柔比星,但多柔比星具有心脏毒性等不良反应,临床使用中应格外注意剂量的控制。在以链脲菌素为主的化学治疗失败后,可选的后续方案有:替莫唑胺±卡培他滨;奥沙利铂为主的化学治疗方案+5-氟尿嘧啶或卡培他滨。尚无充分证据提示上述哪种化学疗法方案最佳,但对于pNET的治疗,2016年ENETS指南提出,替莫唑胺±卡培他滨方案或许可作为优先选择[10]。替莫唑胺单药,或联合卡培他滨的CAPTEM方案,或联合抗血管生成药物的前瞻性临床试验正在开展,可供参考的临床数据尚有限。但有小型前瞻或回顾性研究表明,替莫唑胺联合抗血管生成药物或CAPTEM方案在晚期NET可获得15%~70%的ORR[10]。2019版NCCN指南与2016版ENETS指南意见一致,推荐的常用化学疗法组合方案包括CAPTEM,链脲菌素和(或)多柔比星±5-氟尿嘧啶,链脲菌素和(或)5-氟尿嘧啶[11]。
对于G1和G2级胃肠NET,ENETS和NCCN指南均不推荐全身化学治疗,只有在少数肿瘤负荷大、快速进展、Ki-67指数水平较高(>15%)、SSTR阴性且其他方案(包括生物治疗、靶向药物治疗、PRRT)均失败的情况下才谨慎考虑。2019版NCCN指南推荐可选的化学治疗药物包括5-氟尿嘧啶、卡培他滨、达卡巴嗪、奥沙利铂、链脲菌素、替莫唑胺等[11]。
②化学治疗在G3级NET中的应用:对于G3级NET,其治疗方案与G1和G2级NET或G3级NEC均有所区别,目前尚无统一的标准方案[12]。2013年NORDIC NEC研究发现,Ki-67<55%的患者比Ki-67≥55%的患者对一线以铂类为主的化学治疗灵敏度显著降低,分别为15%和42%[13]。该研究对G3级NEN的治疗具有重要指导意义,强调G3级NEN的异质性,认为应该实施个体化精准治疗。因此,ENETS和NCCN指南均指出,对于分化好、Ki-67<55%的G3级NET患者,以铂类为主的传统化学疗法也许不作优先考虑,可参考G1和G2级NET,推荐以替莫唑胺为主的化学治疗方案。而对于Ki-67≥55%的G3级NET,可参考G3级NEC的化学治疗方案[14]。
③化学治疗在NEC中的应用:目前仍缺乏针对胃肠胰神经内分泌癌(gastroenteropancreatic neuroendocrine cancer,GEP-NEC)化学治疗的大型临床研究数据,其化学治疗方案主要参考小细胞肺癌,将以铂类为主的联合化学治疗作为一线方案。2016年ENETS推荐的一线组合方案包括:依托泊苷+顺铂(EP);依托泊苷+卡铂(EC);伊立替康+顺铂(IP)。其中,EP方案在GEP-NEC中最常用,ORR约为30%,中位生存期为1年左右。而EP方案治疗失败后,可选的二线方案非常有限,可考虑以奥沙利铂为主的奥沙利铂+亚叶酸钙+5-氟尿嘧啶(FOLFOX)方案,或伊立替康为主的FOLFIRI (伊立替康+亚叶酸钙+5-氟尿嘧啶)方案[12],也有小型临床研究探索以替莫唑胺为主的方案作为EP治疗失败后的二线方案[15]。其他二线药物如氨柔比星、替吉奥(S-1)、紫杉烷的研究还在探索中。而之前对EP方案敏感、停药>3个月后出现进展的患者,也可考虑再用回EP方案。但是对于以铂类为基础的一线化学治疗方案失败的GEP-NEC,二线化学治疗的总体有效率较低(≤18%)。2019年NCCN指南与2016年ENETS指南意见一致,EP或EC方案是GEP-NEC的首选方案,FOLFOX、FOLFIRI、替莫唑胺±卡培他滨可作为二线方案[11]。
以免疫检控点细胞程序性死亡-受体1/配体1(programmed cell death protein-1/ligand-1,PD-1/L1)为靶点的免疫靶向治疗是近年来肿瘤治疗领域的热点,而在NEN中还处于早期临床探索阶段,现有临床试验结果总体有效率很低。2018年ASCO公布KEYNOTE-158Ⅱ期临床试验结果,抗程序性死亡受体1(programmed cell death protein-1, PD-1)药物帕姆单克隆抗体用于107例NET患者,ORR仅为3.7%[16]。2018年,欧洲肿瘤内科学年会公布了另一个抗PD-1单克隆抗体spartalizumab (PDR001)的Ⅱ期多中心临床试验结果,在86例GEP-NEN患者中,NET患者的ORR为7.4%,而NEC患者的ORR仅为4.8%[17]。目前研究认为,PD-1/L1表达、肿瘤突变负荷(tumor mutation burden,TMB)、微卫星不稳定(microsatellite instability,MSI)和错配修复缺陷(mismatch repair deficiency,dMMR)可能与免疫靶向治疗敏感性密切相关。NCCN指南提出,对于既往已接受正规系统治疗但仍持续进展的肺外NEC患者,在行dMMR和MSI评估后,可考虑采用帕姆单克隆抗体治疗[11]。总体而言,免疫靶向治疗在NEN治疗领域现状仍不容乐观,对NEN免疫微环境的深入研究,筛选免疫治疗敏感人群是未来提高免疫治疗有效性最需要解决的问题。
是控制CS或舒血管肠肽瘤、胰高血糖素瘤等功能性pNET最主要的一线用药[18]。可选药物为长效奥曲肽和兰瑞肽水凝胶。而对于难治性CS,可考虑增加SSA剂量,一般通过缩短给药间期(缩短至2~3周)达到增加剂量增强效果的目的。新型广谱SSA帕瑞肽,目前暂时还未被批准用于CS或其他功能性NEN,但可考虑用于多种方案都失败后的难治性CS[10]。
是控制CS和功能性pNET的二线用药,对某些SSA疗效不佳的患者,可单独或联合SSA使用达到增强症状控制的效果[18]。
是控制胰岛素瘤患者低血糖症状最有效药物,可通过直接抑制胰岛素释放来纠正低血糖[18]。
是控制胃泌素瘤引起的高胃酸相关症状的主要内科用药。临床上对长期服用PPI的患者,应注意防范维生素B12缺乏和低血镁症的发生[18]。
主要用于有库欣综合征的异位促肾上腺皮质激素瘤患者。米非司酮可直接阻断皮质醇在外周的作用,发挥治疗作用。近年来,新型药物美替拉酮(11β-羟化酶抑制剂)能直接抑制皮质醇的合成,显著改善库欣综合征[19]。
为口服的5-羟色胺合成抑制剂,是难治性CS有效的新型药物。2015年,TELESTAR Ⅲ期临床试验结果表明,对SSA难治性CS,其可显著减少CS引起的腹泻次数[20]。
是口服的胃泌素受体拮抗剂,在Ⅱ期临床试验中被证实可显著控制Ⅰ型胃NET多发性肿瘤的数目和大小,且耐受性良好,其有望成为新型Ⅰ型胃NET的临床用药选择[21]。
制定精准个体化的治疗方案在高度异质性的GEP-NEN中尤为重要,提倡成立多学科专家团队进行GEP-NEN的综合诊治。目前,进展期GEP-NEN的药物治疗逐渐规范化,但仍面临诸多挑战。对G1和G2级NET,一线治疗失败后,现有靶向药物与化学治疗药物序贯治疗的顺序,以及新型靶向药值得探索;对G3级NET,以铂类为主的化学疗法方案效果不佳,却缺乏有充分临床研究数据指导的标准治疗方案;对NEC,缺乏大型前瞻性临床研究,以铂类为主的一线化学治疗方案失败后,可选的二线方案有限,且有效率普遍较低,这群患者又该何去何从?因此,开发新型药物任重而道远。探索新型靶向药物,将靶向治疗、化学治疗、免疫治疗合理联用是NEN药物治疗领域未来的探索方向。
所有作者均声明不存在利益冲突



























