
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
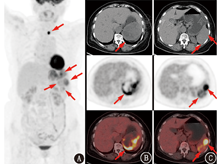
患者女,64岁,以"1周前体格检查发现脾脏占位"为主诉于本院就诊,病程中无发热、黄疸,无咳嗽、气喘、心悸、胸闷,无进行性体质量减轻,进食、睡眠、大小便正常。既往无手术、外伤史及其他肿瘤史,无结核、肝炎等传染病史。体格检查:无明显阳性体征。实验室检查:血常规、生化检测及肿瘤标志物指标均正常。颈部超声示:甲状腺左叶近峡部见12 mm×9 mm ×10 mm等回声结节,形态欠规则,局部欠清,内见不规则钙化灶。腹部CT平扫及增强CT示:脾脏见数个类圆形稍高密度影,较大者约92 mm×67 mm,内见片状低密度影,增强扫描呈相对低强化。结合相关检查仍无法确诊,遂行18F-脱氧葡萄糖(fluorodeoxyglucose, FDG)PET/CT(德国Siemens Biograph mCT)检查,显像(图1)示脾脏见多发类圆形混杂密度影,边界不清,较大者见不规则坏死,病灶较大者约8.8 cm×7.5 cm,糖代谢不均匀增高,最大标准摄取值(maximum standardized uptake value, SUVmax)9.1,考虑恶性病变可能性大;甲状腺左叶见类圆形稍低密度影,直径约1.4 cm,内见点状钙化灶,糖代谢异常增高,SUVmax 19.0。后行手术切除,术中探查发现脾脏上极占位约6 cm×5 cm,质地韧,与周围组织紧密粘连,肝脏无明显肝硬化改变,食管胃底部静脉无曲张,余脏器未见明显异常,遂行脾切除术+粘连松解术+冲洗引流术。术后病理检查(图2)示肿瘤细胞由席纹状排列的胖梭形细胞和多形性瘤细胞组成,多形性瘤细胞核大而不规则,染色质粗而深染;肿瘤内还可见多核瘤细胞,肿瘤内易见核分裂象,间质内可见慢性炎性反应细胞浸润。免疫组织化学:广谱细胞角蛋白(cytokeratin pan, CKpan;-)、上皮膜抗原(epithelial membrane antigen, EMA;-)、S-100蛋白(-)、CD34(+)、波形蛋白(vimentin;+++)、平滑肌肌动蛋白(-)、结蛋白(desmin;-)、CD68(+)、CD1a(-)、CD31(+)、CD21(-)、CD23(-)、P53(大部分为阴性)、细胞增殖核抗原Ki-67(阳性指数约为30%),符合恶性纤维组织细胞瘤(malignant fibrous histiocytoma, MFH)/未分化肉瘤。

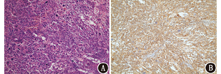

MFH是一种主要发生于软组织的肉瘤,没有特定的已知分化线,脾原发性MFH罕见,其临床特点和生物学特性尚未明确,在所有原发性脾脏肿瘤中的发病率也难以评估。首例脾MFH由Govoni等[1]在1982年报道,目前文献报道少于20例[2]。脾MFH好发年龄为40~60岁,男性发病略高于女性,临床症状不典型,约70%患者有腹痛、脾肿大、体质量减轻、发热等体征,据报道有2例发生自发性破裂[2,3,4]。本例甲状腺左叶病灶从超声及PET/CT影像表现来看更倾向甲状腺原发肿瘤,且患者腹腔未发现转移灶,甲状腺孤立转移可能性较小。脾MFH根据组织病理学分型可分为5类,包括多形性、黏液性、炎性、巨细胞性和血管瘤样性,其中多形性和炎性多见,各类之间预后无明显差异。MFH常与一些肉瘤混淆,如纤维肉瘤、平滑肌肉瘤、脂肪肉瘤和横纹肌肉瘤,免疫组织化学是鉴别的关键,原发性脾MFH的vimentin、CD68和α1-抗胰糜蛋白酶(α1-anti-chymotrypsin, α1-ACT)呈阳性表达,而CD31和CD34呈阴性表达。
目前并未发现可用于术前诊断脾MFH的特征性影像学表现。Makis等[2]报道了1例脾MFH肝转移的PET/CT显像,发现肝脾多发薄壁囊实性占位,坏死明显,边缘FDG代谢异常增高,脾脏最大病灶约9.6 cm×7.5 cm,SUVmax15.8。本例患者发现相对较早,未见远处转移,PET/CT显像与上述报道有不同之处,除了部分病灶见明显坏死,还有多处呈实性肿块,FDG代谢亦略低,因此,脾MFH影像学特点还需进一步总结。本例病灶光学显微镜下核分裂象多见,且免疫组织化学示细胞增殖核抗原Ki-67阳性指数约30%,提示肿瘤细胞增殖活跃,恶性程度高,与18F-FDG显像高摄取相符,而肿瘤的快速生长及炎性反应细胞的浸润可能是部分病灶出现囊变坏死的原因,从而在18F-FDG显像时呈现出缺损区。虽然本例18F-FDG显像无法做出确切的术前诊断,但可提示病变为脾脏原发恶性肿瘤,且无局部及远处转移,为临床准确分期、制定治疗方案提供了依据。
脾MFH需与脾脏其他良恶性病变鉴别,如血管瘤、淋巴管瘤、脾结核、淋巴瘤、血管肉瘤等。其中血管瘤、淋巴管瘤、脾结核是常见的脾脏良性病变。脾脏血管瘤的FDG代谢与周围正常脾实质相仿或略低,脾脏淋巴管瘤FDG代谢不高,呈缺损区或与周围脾组织相似[5],而脾MFH的FDG代谢明显增高,可进行鉴别;脾结核虽然FDG代谢增高,但通常有腹部淋巴结肿大伴中心低密度干酪样坏死、伴有结节性腹膜增厚的高密度腹腔积液(25~45 HU)、胸腔积液和肝脏局灶性病变等相关表现,部分晚期病变会出现钙化,CT和MR均可显示轻度的周边强化。常见的脾脏恶性病变有淋巴瘤、转移瘤及肉瘤等。原发性脾脏淋巴瘤较少,其中大部分为非霍奇金淋巴瘤;诊断脾继发性淋巴瘤时,脾外病变如腹膜后淋巴结肿大等有助于诊断。脾脏淋巴瘤的超声表现具有可变性,可表现为正常外观、均质或非均质性脾肿大、多个小粟粒状低回声结节、单个或多个大的低回声肿块,结节内可见血管分布,并可延伸至脾外,靶征和病变内钙化较少见;在CT上,结节呈低密度,强化不明显,增强后可显示清晰度最佳的病灶,较大病灶可发生不规则坏死,有时可并发脾梗死;在MRI上,典型脾脏淋巴瘤在T1加权成像(weighted imaging, WI)上呈低信号或接近等信号,而在T2 WI上呈高信号;PET/CT显像示脾肿大伴FDG代谢弥漫性增高,或呈局灶性代谢增高灶[6],当表现为后者时,术前诊断与脾MFH鉴别困难。脾脏转移瘤常合并肝脏及其他器官的转移,根据原发肿瘤类型的不同,可表现为轮廓清楚、低密度的囊性或实性肿块,部分可见钙化,18F-FDG代谢显像可见全身多部位的代谢增高灶[7]。本例病灶局限在脾内,转移瘤基本排除。脾脏血管肉瘤恶性程度高,症状包括体质量减轻、腹痛不适、发热、腹部肿块和脾破裂引起的低血容量休克,影像学上表现为界限不清的不均质肿块,FDG代谢异常增高,内部可有出血和坏死区,与脾MFH鉴别困难,确诊有赖于病理及免疫组织化学检查。
肿瘤组织学边缘阴性的根治性切除手术是治疗脾MFH的首选方法,MFH的标准化疗药物包括阿霉素、异环磷酰胺等,但化疗并不能改善脾MFH患者的总体生存率,总体预后差。18F-FDG PET/CT显像已被证实在鉴别脾脏良恶性病变方面具有良好的应用价值。英国皇家放射医学会和英国皇家内科医师学会2016版联合循证指南推荐使用18F-FDG PET/CT显像对包括MFH在内的侵袭性肉瘤进行分期[8]。然而,18F-FDG PET/CT显像在脾MFH分期中的应用鲜有报道。本例提示,18F-FDG PET/CT显像是脾MFH实施治疗的关键,其能提供术前的良恶性判断及分期等信息,为临床个体化治疗提供依据。
所有作者均声明不存在利益冲突


























