
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,50岁。无明显诱因出现左侧腰臀部及左下肢内侧疼痛,多出现于行走或挤压时,呈钝痛,休息后可减轻,无发热,无下肢静脉曲张、肿胀、水肿,未予治疗,现左下肢疼痛加重。既往无外伤、肝炎、结核病史。实验室检查:癌胚抗原(carcinoembryonic antigen, CEA)7(0~5;括号内为正常参考值范围,下同) μg/L,余肿瘤标志物均为阴性;WBC计数8.4(3.5~9.5)×109/L,RBC计数4.5(4.3~5.8)×1012/L,Hb 133(130~175) g/L,中性粒细胞百分比66%(40%~75%);抑制治疗状态下甲状腺球蛋白(thyroglobulin, Tg)2.2(3.5~77.0) μg/L,游离三碘甲状腺原氨酸(free triiodothyronine, FT3)5.00(3.28~6.47) pmol/L,游离甲状腺素(free thyroxine, FT4)17.2(7.9~18.4) pmol/L,促甲状腺激素(thyroid stimulating hormone, TSH)1.16(0.34~5.60) mU/L。该患者10个月前因甲状腺乳头状癌(papillary thyroid cancer, PTC)于本院行"右侧甲状腺癌扩大根治术+左侧甲状腺近全切除术+双侧颈部淋巴结清扫术"。7个月前于本院行131I清除残留甲状腺组织(简称清甲)治疗(剂量4 440 MBq),清甲治疗前血清TSH 84.53 mU/L,Tg 15.0 μg/L,甲状腺球蛋白抗体(thyroglobulin antibody, TgAb)<10(0~115)×103 U/L。清甲治疗后1周行131I SPECT/CT显像,结果(图1)示甲状腺区摄碘灶,颈部以外其他部位未见异常摄碘组织。3个月前停服左甲状腺素钠片,停服1个月后查血清Tg为4.2 μg/L,该患者因个人原因未行停药后小剂量碘扫描。现甲状腺彩超提示甲状腺双叶切除术后,双侧颈部未见明显异常肿大淋巴结。为明确全身情况及下肢疼痛原因,行18F-脱氧葡萄糖(fluorodeoxyglucose, FDG)PET/CT[德国Siemens Biograph Truepoint64 (52环)]显像,结果(图2)示左侧髂骨不规则斑片状骨质破坏并局部片状软组织影形成,病变区FDG摄取异常增高,最大标准摄取值(maximum standardized uptake value, SUVmax)约13.0;病变区大部分呈溶骨性表现,局部见点片状碎骨块影及线样硬化边;双肺上叶另见多个高密度小结节影,放射性分布未见异常;全身其他部位未见FDG摄取异常增高灶。后行CT引导下左髂骨病变穿刺活组织检查,病理检查(图2E)示广泛朗格汉斯细胞浸润。免疫组织化学检查:甲状腺转录因子-1(thyroid transcription factor-1, TTF-1;-),细胞角蛋白(cytokeratin, CK;个别+),CD68(+),平滑肌肌动蛋白(-),P63(-),细胞增殖核抗原Ki-67(+;10%~20%),S-100蛋白(+),富含AT序列的特异性结合蛋白2(special AT-rich sequence-binding protein 2, SATB-2蛋白;-),CD207(+),CD1a(+),提示朗格汉斯细胞组织细胞增生症(Langerhans cell histiocytosis, LCH)。
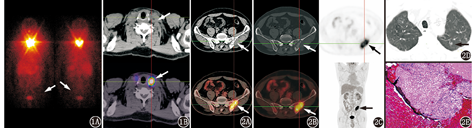

LCH是一种原因不明的朗格汉斯细胞异常增生引起的组织破坏疾病[1],可发生于任何年龄的人群,但发病高峰为1~3岁的儿童。LCH临床表现多样,侵犯部位可为皮肤、肺、肝脏、脾脏、骨骼等,其中以骨骼为主的病变以骨质破坏、组织细胞增生和嗜酸性粒细胞浸润为主[1],需与骨转移瘤、骨髓炎、骨肿瘤、骨结核及淋巴瘤相鉴别。
骨骼系统是LCH最常侵及的部位,LCH发生于骨骼者多见于颅骨、脊柱、肋骨及四肢长骨等[2],而发生于髂骨者罕见。LCH的病因目前尚无定论,尽管不少研究考虑其发病与病毒、免疫学等有关,但至今尚无明确证据。实验室检查伴嗜酸性粒细胞升高,血红细胞沉降率加快;免疫组织化学检查CD1a、S-100蛋白和CD207阳性是重要的诊断证据[3],部分患者可伴有CD68阳性。CT主要表现为骨骼呈单发或多发溶骨性骨质破坏,多起于病灶中心,部分可见线样硬化边,部分见死骨、骨膜反应及软组织肿胀[4]。此外,增殖朗格汉斯巨细胞及淋巴细胞等均具有高葡萄糖代谢活性,所以骨LCH在18F-FDG PET/CT上多表现为FDG摄取明显增高,本例表现与之相符。本例左侧髂骨病变单从CT图像特征来看,病变区大部呈溶骨性表现,局部见点片状碎骨块影及线样硬化边,周围软组织变化不显著,亦不明确支持原发或转移性恶性肿瘤所致,多考虑良性或低度恶性骨病变,这也与LCH骨骼侵犯的CT表现相符。
本例患者有PTC病史,当甲状腺癌伴有其他部位病变时,要注意鉴别诊断。分化型甲状腺癌(differentiated thyroid cancer, DTC)以PTC为主,其分化程度高,保留甲状腺组织的部分功能,具有摄碘及分泌Tg的能力。Tg作为一种只存在于正常甲状腺组织和DTC细胞中的大分子糖蛋白,可作为甲状腺组织特有的生化标志物[5]。在行甲状腺全切术及131I清甲后,患者机体已没有分泌Tg的来源,外周血中Tg应处于极低水平,当Tg水平升高,提示体内存在PTC转移灶,因此Tg成为临床判断甲状腺癌转移或复发的重要指标[6]。但血清Tg水平检测易受TgAb影响[7],部分Tg检测阴性但TgAb水平明显增高者与甲状腺癌的复发及远处转移相关[8,9]。本例患者Tg、TgAb水平始终未见增高,不支持甲状腺癌远处转移。131I可被有功能的甲状腺组织摄取,被摄取的量和速度与甲状腺功能有关。131I也能被有功能的甲状腺癌转移灶摄取,治疗剂量或诊断剂量的131I全身显像(whole-body scan, WBS)可以帮助了解是否存在摄碘性转移灶。本例患者清甲治疗后131I WBS示左髂骨部位摄碘阴性,且本例甲状腺癌病理类型为PTC,骨转移概率较低,所以左侧髂骨病变不应考虑为甲状腺癌转移,即使怀疑骨恶性病变也多考虑原发性骨病变或其他肿瘤转移所致。此外,甲状腺癌骨转移表现为溶骨性或成骨性转移,溶骨性多表现为膨胀性囊状破坏区;成骨性多表现为圆形或片状"棉絮"样致密影,部分呈象牙质样改变,少见骨质硬化、骨膜反应及死骨影,且常表现为多发,好发于上半身骨骼[10],这与本例表现不符。
本例18F-FDG PET/CT显像示双肺上叶多个高密度小结节未见明显FDG摄取增高,亦不高度怀疑恶性病变,但不排除甲状腺癌肺转移。肺是PTC最常见的远处转移部位,肺转移是甲状腺癌患者最主要的致死原因[11]。与患者清甲治疗后131I SPECT/CT融合图像比较,双肺上叶多个高密度小结节为新发病变,但由于患者Tg、TgAb水平始终未见增高,因此不支持甲状腺癌肺转移。肺部LCH发病率仅次于骨,X线及CT早期表现为1~10 mm的多发小结节;随病变进展,结节影逐渐被网状阴影、肺气囊替代,且通常集中在肺的上中部区域[12],而通常见到的肺内血行转移瘤好发于中下肺野及外围肺野。本例从双肺多个小结节位置来看,均位于双肺上叶,与肺部LCH特征吻合,但多个小结节均未见明显FDG摄取增高,与既往报道不符[12],这可能与本例中结节过小(最大结节直径约0.7 cm)有关;也可能双肺多个小结节不是LCH,需要随访证实。
本例中左髂骨病变表现为斑片状骨质破坏并FDG高摄取,需与以下病变鉴别。(1)骨结核:也可表现为溶骨性骨质破坏及死骨形成,但骨结核患者常表现为低热、乏力、盗汗、消瘦等症状,临床病史及实验室检查有助于诊断。(2)骨髓炎:好发于少儿及青少年,发病部位常见于下肢长骨干骺端及骨干,常伴红肿热痛等炎性反应。(3)骨肉瘤、软骨肉瘤及尤文肉瘤:骨肉瘤及尤文肉瘤好发于长骨干骺端及近骨干部位,多见于儿童及青少年,多数软组织肿块较明显,部分可见弧线状及"葱皮"样骨膜反应;软骨肉瘤好发于四肢长骨及骨盆,多见于成人,男性多于女性,CT上常显示骨质破坏区或软组织肿块中不同程度的钙化和骨化影。
PTC合并LCH在临床上较为罕见。当甲状腺癌伴有其他部位病变时,要注意鉴别诊断,PTC骨转移概率较低,且主要表现为溶骨性或成骨性骨转移,少见骨质硬化、骨膜反应及死骨影,LCH肺内病变通常集中在肺的中上部区域,且Tg、TgAb水平的高低以及是否摄取131I是鉴别诊断的重要依据。
所有作者均声明不存在利益冲突


























