
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
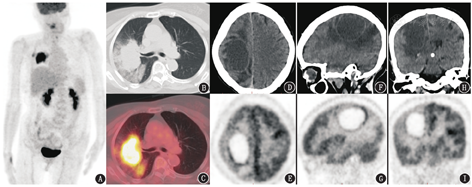
病例1 患者女,75岁,2周前无明显诱因出现左侧肢体定位感减退,当地医院脑MRI提示:右侧顶叶中线旁占位,考虑转移瘤合并出血可能。为进一步评估脑占位性质、寻找潜在原发灶,患者行18F-脱氧葡萄糖(fluorodeoxyglucose, FDG)PET/CT(德国Siemens公司Biograph64 Truepoint TrueV)显像(图1),可见右侧肺门区摄取异常增高肿物,大小为7.2 cm×4.5 cm,最大标准摄取值(maximum standardized uptake value, SUVmax)为8.3,肿物致右肺上叶支气管截断,远端见斑片及磨玻璃影的阻塞性改变;右侧额顶叶囊性占位,大小为5.5 cm×3.4 cm,囊腔呈放射性缺损区,囊壁菲薄且厚薄较均匀,放射性摄取明显高于白质,SUVmax为5.0,病变周围大片状水肿带,相邻额顶叶皮质代谢减低,左侧小脑代谢亦减低,中线结构略向左移位。

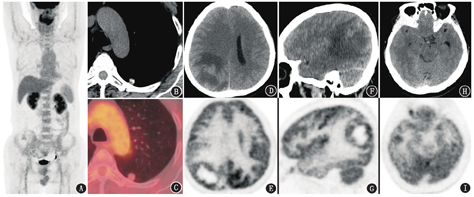
病例2 患者男,60岁,2周前无明显诱因出现走路偏斜,曾因此于行走中头部撞到大树后出现头晕、恶心,当地医院脑MRI见右侧颞叶、顶叶及右侧脑膜多发异常信号,增强后明显强化,周边大片水肿带,不除外脑转移瘤。行胸部CT发现左肺下叶背段结节(直径1.1 cm)。为进一步明确病变性质及分期,患者行18F-FDG PET/CT显像(图2)。脑PET/CT显像可见右侧顶枕叶囊性占位,大小为4.4 cm×3.2 cm,中心囊腔呈放射性缺损区,囊壁厚薄不均,代谢与相邻皮质相近,SUVmax为12.1,周围伴大片状低密度水肿带;右侧颞叶亦可见代谢摄取增高小结节,大小为1.0 cm×0.7 cm,SUVmax为10.1;右侧丘脑后部条片状代谢增高影,SUVmax为6.8;邻近右侧大脑皮质、基底节及左侧小脑代谢减低,中线结构向左移位。左肺下叶背段胸膜下可见一实性结节,大小1.2 cm×1.1 cm,边缘尚光整,伴钙化,代谢与纵隔血池相近,SUVmax为1.4。

该2例患者有相似之处,脑占位均以囊性为主,囊壁代谢明显增高,周围伴明显水肿,且均发现肺占位,首先要考虑和排除的就是肺癌伴脑转移瘤。病例1 PET/CT图上见右肺门区代谢增高肿块,伴支气管包绕截断和远端肺野阻塞性改变,符合肺癌的典型表现。若肺癌诊断明确,那么颅内病变为脑转移瘤的可能性很大,但仍需根据影像所示对颅内占位进行分析。由于脑组织缺乏淋巴系统,脑转移瘤几乎均来源于血行转移,其分布受脑血液供应特征影响,好发于大脑半球的皮质、皮质下,尤其是皮髓质交界区,可呈圆形、卵圆形、环形,可伴有明显水肿,水肿通常局限于白质区,保留覆盖的皮质。本例颅内占位位于右侧额顶叶皮质下,呈环形,代谢不均匀增高,周围伴有明显水肿,也符合脑转移瘤表现,因此临床有把握诊断为肺癌伴脑转移瘤。需要注意的是,由于大脑皮质高代谢的影响,且有的脑转移瘤由于囊变、出血等导致实性成分较少,在PET上FDG的高代谢可能不明显,需结合脑MR加以判断,并且要警惕PET/CT可能遗漏小转移灶的可能。
病例2中脑占位为多发,其中较大病灶与病例1相似,伴囊变、代谢高、周围水肿明显,仍应先除外脑转移瘤的可能。那么病例2中的肺结节是否可能为原发灶?该结节为周围性的实性小结节,没有明显分叶征、毛刺征、胸膜牵拉征等周围型肺癌的表现,代谢不高于纵隔血池,纵隔窗还可见结节有明显钙化。黏液腺癌和典型类癌外形可较规整,代谢活性也不太高,前者是由于肿瘤细胞成分少、黏液含量多而在PET表现为较低程度的代谢活性,而黏液成分有时可表现为高于软组织的密度或伴小钙化灶。本例的钙化范围相对于瘤体来说较大,密度高,在肿瘤中比较少见。肺类癌则是由于肿瘤细胞分化良好、恶性程度低,FDG代谢通常不高,一般发病年龄偏年轻,多为中央型,表现为支气管腔内的类圆形或圆形结节,管腔内病变通常只占病变的一小部分,形成"冰山征",增强扫描明显强化,本例不考虑。本例的肺结节从形态、密度、代谢来看更像良性病变,如肺错构瘤。
若肺结节不是原发灶,那么就不支持脑转移瘤的诊断。虽然颅内多发病灶相对来说更常见于脑转移瘤,但胶质瘤、淋巴瘤、脑脓肿等也会多发。脑淋巴瘤可能来源于血管周围未分化的多能细胞,肿瘤细胞在血管周围间隙内浸润生长,肿瘤可单发也可多发,多位于脑内靠近表面或中线的部位,好发于基底节、胼胝体、丘脑和脑室周围,肿瘤一般密度比较均匀,无明显包膜,出血、囊变少见,周围水肿程度低于转移瘤或高级别胶质瘤;另外,由于原发的脑淋巴瘤多为弥漫性大B细胞淋巴瘤,FDG代谢一般明显增高。这些特点与本例表现不符。脑脓肿患者通常有寒战、发热、血象升高等感染征象,本例也不考虑。因此,本例颅内病变鉴别的重点是脑转移瘤和胶质瘤。
若为胶质瘤,病灶多发、水肿坏死明显、代谢增高,则应为高级别胶质瘤。脑转移瘤和胶质瘤18F-FDG PET/CT表现有诸多的相似之处,如均可分布于皮质下,可出现液化坏死,瘤周水肿明显,肿瘤有不同程度代谢增高。这些相似的表现为鉴别诊断带来一定困难,这时就体现出PET/CT对全身病变探测的优势,如果有明确的原发灶,则考虑脑转移瘤,若没有原发灶,则胶质瘤可能性更大。
再来看颅内病变本身的特点。一般来说,脑转移瘤的瘤周水肿更为显著,不成比例的小结节大水肿有利于脑转移瘤的诊断;此外环形病灶的环外壁在脑转移瘤相对规则,而胶质瘤环壁一般厚薄不均,环外壁毛糙不规则,形如"花环"状;脑转移瘤FDG代谢通常高于脑白质,而WHO Ⅰ~Ⅱ级胶质瘤FDG代谢多低于白质或与白质相当[1]。病例2最显著的右侧顶枕叶囊性占位,囊壁厚薄不均,外缘不规则,呈"花环"壁结节状代谢增高,加之PET/CT全身显像其余部位没有明显原发恶性肿瘤征象,脑内病变要首先考虑高级别胶质瘤。之后患者行右侧顶枕叶占位手术切除,术后病理:高级别胶质瘤,伴大片坏死,结合形态及免疫组织化学检查,考虑为间变少突胶质细胞瘤或胶质母细胞瘤。免疫组织化学检查结果:CD34(血管+),广谱细胞角蛋白(AE1/AE3;-),上皮细胞膜抗原(epithelial membrane antigen, EMA;-),少突胶质细胞转录因子-2(Oligo-2;+),胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP;+),神经元核抗原(neuronal nuclei antigen, NeuN;散在+),P53(散在+),S100蛋白(+),突触素(synaptophysin, Syn;部分+),异柠檬酸脱氢酶1(isocitrate dehydrogenase 1, IDH1;+),X连锁α地中海贫血/精神发育迟滞综合征蛋白(X-linked α-thalassemia retardation syndrome protein, ATRX;+),细胞增殖核抗原Ki-67(40%)。
由于脑实质高FDG代谢的背景干扰,PET/CT脑显像在脑肿瘤检出方面诊断效能低于MRI,而MRI多序列、多功能成像技术,使得MRI在脑转移瘤与胶质瘤鉴别诊断方面可提供更多有效信息。脑转移瘤MRI增强扫描呈明显实体或伴中央坏死的环型强化,非强化转移瘤罕见[2],而低级别胶质瘤无强化或仅轻微强化。另外,MR波谱、MR灌注成像、扩散张量成像等均有助于鉴别胶质瘤和脑转移瘤。例如下列表现有助于诊断胶质瘤:好发于额叶、颞叶,可沿白质纤维或胼胝体纤维向邻近脑叶或对侧半球发展;低级别胶质瘤PET/CT代谢活性多低于或相当于白质,MRI增强无或仅轻微强化,占位效应轻;高级别者弥漫浸润生长,中央易坏死囊变,囊壁厚薄不均,壁外缘不规则呈"花环"状,瘤周水肿常见、显著,通过MR波谱、MR灌注成像、扩散张量成像可探测瘤周浸润肿瘤细胞,以区别于脑转移瘤的瘤周单纯水肿[3,4]。
脑转移瘤是成人最常见的脑肿瘤,而胶质瘤是脑内最常见的原发肿瘤,两者鉴别诊断是临床工作的重点,但两者临床症状与影像表现存在诸多相似之处,因此也是临床工作的难点。除脑占位本身影像学表现的鉴别之外,需注意肺、乳腺、胃肠道等部位恶性肿瘤的排除对两者的鉴别有重要意义,这也体现了PET/CT全身大视野显像的优势。
所有作者均声明不存在利益冲突


























