
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,58岁,主诉口干、眼干、体质量进行性下降2年余。患者2年余前无诱因出现口干、眼干,伴双侧颌下腺及腮腺无痛性肿大,实验室检查示血嗜酸性粒细胞增多,血红细胞沉降率、C反应蛋白升高,血清IgM升高[14.3(正常参考值范围:0.4~2.3) g/L],血清蛋白电泳见M蛋白(6.6 g/L),血清免疫固定电泳IgM-kappa(+),尿免疫固定电泳游离kappa轻链(+),血清IgG4、肿瘤标志物正常,骨髓穿刺涂片正常。涎腺超声示双侧腮腺、颌下腺弥漫性病变;胸、腹、盆部CT示双肺间质性病变,肠系膜脂膜炎,腹膜后及肝门肿大淋巴结;腹部MRI示胰腺形态饱满,实质强化不均,周围可见T1低信号包鞘,主胰管不规则狭窄,符合自身免疫性胰腺炎表现;超声内窥镜下见胰头弥漫性肿胀,实质回声偏低,提示自身免疫性胰腺炎。患者曾行左侧颌下腺及淋巴结活组织检查(简称活检),结果提示慢性硬化性涎腺炎,淋巴结慢性炎,免疫组织化学检测示IgG(-),IgG4(-),kappa(-);多次胰腺穿刺活检未见肿瘤细胞;唇腺活检见灶性腺泡萎缩,间质内及导管周淋巴细胞、浆细胞浸润,免疫组织化学检测示IgG(+),IgG4(-),kappa(+),lambda(+)。曾予中等剂量泼尼松治疗,口干、眼干症状有所缓解,唾液腺及胰腺肿胀较前好转。
18F-脱氧葡萄糖(fluorodeoxyglucose, FDG)PET/CT显像如图1所示,可见多系统病变:(1)双侧腮腺、右侧颌下腺(左侧已切除)肿胀,代谢弥漫增高[最大标准摄取值(maximum standardized uptake value, SUVmax)4.6];(2)双肺有大小不等的代谢增高斑片、实变及磨玻璃影(SUVmax 10.8),部分病变伴"铺路石征";(3)胰腺形态饱满且代谢增高,以胰头及钩突为著(SUVmax 5.6);(4)胃体及胃窦部胃壁增厚、代谢轻度增高(SUVmax 2.9),结直肠及部分小肠节段性代谢增高,以自直肠至结肠肝曲为著;(5)甲状腺左叶及峡部有代谢增高的低密度结节(SUVmax 4.8);(6)纵隔及肺门有代谢增高的小淋巴结(SUVmax 6.3)。
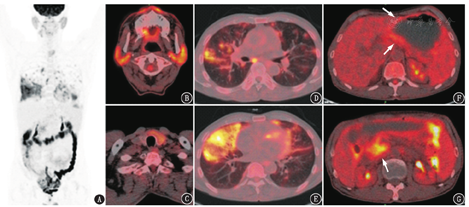

先从PET/CT影像角度分析。病变具有代谢活跃的特点,累及腺体(唾液腺、甲状腺、胰腺)、肺、消化道、淋巴结,其中肠道的代谢需与生理性摄取鉴别;淋巴结分布在肺门和气管周围,需与非特异性炎性淋巴结鉴别。因此,疾病鉴别诊断主要依据腺体(尤其是唾液腺和胰腺)、肺的病变特点进行。良性病变中,容易累及唾液腺、胰腺、肺的疾病是IgG4相关性疾病,恶性病变则主要鉴别淋巴瘤。另外,患者唾液腺的病变加上口干、眼干的症状,需考虑干燥综合征的可能,原发性干燥综合征不伴发其他疾病,而继发性干燥综合征则可伴发其他风湿性疾病,如类风湿关节炎、系统性红斑狼疮,也可伴发淋巴增殖性疾病。
IgG4相关性疾病是多系统受累的疾病,容易累及唾液腺、泪腺及眼眶周围、胰腺、胆道系统、肺、肾,并出现主动脉周围炎/腹膜后纤维化,另外前列腺、甲状腺、淋巴结也易受累[1,2],其病理特点是有IgG4阳性淋巴浆细胞浸润、闭塞性静脉炎和不同程度的"席纹状"纤维化,由于炎性细胞的存在,PET图像上也有代谢增高的特点[3,4]。从受累脏器和PET代谢特点来看,本例唾液腺、胰腺病变都是弥漫性受累,为较典型的IgG4相关性疾病表现;IgG4相关性疾病的肺部表现形式多样,可为实性结节、支气管血管型、肺泡间质型、弥漫性磨玻璃样不透光区几种类型[5],本例肺部病变有磨玻璃影和实变影,伴"铺路石征",代表同时存在肺泡和间质的病变,可为IgG4相关性疾病的肺部表现。再看甲状腺病变,IgG4相关性疾病的甲状腺受累通常表现为Reidel甲状腺炎或桥本甲状腺炎的纤维变异型,而本例表现为甲状腺结节,不典型,但鉴于PET/CT检查中发现甲状腺意外瘤的概率约为1%~3%[6],本例甲状腺病灶也可能与其他系统性的病变无关,鉴别时不作重点考虑。IgG4相关性疾病累及消化道时可表现为淋巴浆细胞性胃炎,影像表现无特异性。
18F-FDG PET/CT诊断IgG4相关性疾病有几个要点:(1)典型的主要受累脏器和部位如胰腺(弥漫或节段性受累)、胆道系统、泪腺及眼眶周围、唾液腺,并出现主动脉周围炎/腹膜后纤维化/纵隔纤维化,同时存在多个典型脏器受累具有较强的诊断意义。(2)注意IgG4相关性疾病可解释的其他次要病变,即有些脏器或部位的IgG4相关性疾病影像诊断特异性不强,或者需要与其他更常见的疾病鉴别。例如前列腺病变虽可为IgG4相关性疾病的表现,但在老年男性患者中需先鉴别前列腺癌;肺部、肾、淋巴结病变影像特点不强,在其他疾病如淋巴瘤中也容易出现。这些次要病变的表现需与IgG4相关性疾病的总体特点相符。当出现IgG4相关性疾病罕见的受累脏器或部位时(例如睾丸、骨骼、脑实质、肾上腺等),或表现为罕见的影像表现时,疾病整体就难以用IgG4相关性疾病解释,需要先考虑其他方向的诊断。(3)临床表现与IgG4相关性疾病符合,如起病隐匿或亚急性起病,病灶进展慢,血清IgG4升高,病理表现吻合,激素治疗有效等。纵观本例,PET/CT上有较为典型的IgG4相关性疾病表现(胰腺、唾液腺弥漫受累),MRI和超声内窥镜检查也提示自身免疫性胰腺炎,肺、消化道、淋巴结病变可以符合IgG4相关性疾病表现,多个脏器的活检虽未提示IgG4相关性疾病的典型病理特征,但均为慢性炎且未见肿瘤,临床曾予激素治疗症状有缓解。以上病例特点都与IgG4相关性疾病相吻合。
那么本例的诊断是否有存疑之处?本例血清IgG4水平正常,为不支持点,但考虑到血清IgG4对于诊断IgG4相关性疾病既不灵敏也不够特异,有约20%的IgG4相关性疾病血清IgG4水平正常[1],这一点不足以推翻诊断。本例另一重要的临床特点是有M蛋白(IgM-kappa型),这无法用IgG4相关性疾病解释。单克隆的IgM型M蛋白多见于意义未明的单克隆丙种球蛋白病、华氏巨球蛋白血症、B细胞淋巴瘤、轻链(light chain)型(即AL型)淀粉样变、冷球蛋白血症、多发性骨髓瘤等疾病[7],因此若以M蛋白为主要特征来分析,则要首先考虑血液系统疾病。如前所述,干燥综合征可继发于淋巴增殖性疾病(以黏膜相关性淋巴瘤、弥漫大B细胞淋巴瘤为主),而干燥综合征本身也可表现为唾液腺对称性、弥漫性肿大,代谢增高;再者淋巴瘤中黏膜相关性淋巴瘤容易累及唾液腺、肺、胃肠道、甲状腺,其虽不好发于胰腺,但约2%的黏膜相关性淋巴瘤也可有胰腺受累[8]。本例患者较长的病程和FDG的代谢特点,也支持相对惰性的淋巴瘤的表现。
患者之后行胃镜,见胃体黏膜粗糙,多发小结节样隆起及散在浅溃疡,活检病理提示黏膜相关性淋巴瘤。再行经支气管镜肺活检,亦提示黏膜相关性淋巴瘤。临床予利妥昔单克隆抗体+环磷酰胺+表阿霉素+长春地辛+泼尼松(R-CHOP方案)化疗4程后复查PET/CT,肺、胃肠道、胰腺、甲状腺病变基本消失,淋巴结代谢减低,唾液腺肿胀好转、代谢减低。
PET/CT影像诊断主要基于影像特点,但同影异病、同病异影,使得影像诊断有时存在局限性。核医学医师一需学习、挖掘疾病影像特征的细微差别,二需掌握重要的临床背景知识,将其加入影像鉴别诊断体系,三可从科研角度进一步研究更有利于鉴别的分子影像特征,方能达到"看山是山"的目的。
所有作者均声明不存在利益冲突


























