
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,84岁,因"纳差,体质量下降6个月"入院。6个月前患者无明显诱因出现腹胀、纳差,伴偶发餐后恶心、呕吐。近2个月来,饮食较前进一步减少,且出现消瘦,体质量下降5 kg。患者53年前曾患结核性胸膜炎,给予抗结核治疗半年。入院3 d前外院消化道钡餐检查示:慢性胃炎;皮革胃不能除外,建议进一步检查;胸部CT示双侧胸膜增厚粘连,双肺及双侧胸膜多发结节及粟粒影,部分病灶内见点状钙化灶,诊断为肺结核。入院后体格检查:体温36.8 ℃,心率100次/min,血压130/80 mmHg(1 mmHg=0.133 kPa),腹软,未见肠形及蠕动波,全腹无压痛,无反跳痛,未触及包块。实验室检查:肿瘤标志物均正常,痰检结核杆菌、结核抗体及结核菌细胞免疫实验结果均阴性,血红细胞沉降率(简称血沉)未见加快。胃镜检查示胃体、胃角、胃窦黏膜表面高低不平或呈大小不等的结节状,胃壁增厚、僵硬,局部蠕动弱;于胃体下段大弯侧取大块黏膜行活组织检查(简称活检)。超声示病灶处胃壁黏膜、黏膜下层明显增厚,约0.9 cm,部分胃壁5层结构不清,低回声病变已侵犯至固有肌层。考虑:胃癌BorrmannⅣ型?胃淋巴瘤待排。病理检查提示(胃体、窦)黏膜重度慢性炎性反应伴急性活动,建议结合临床必要时再检。
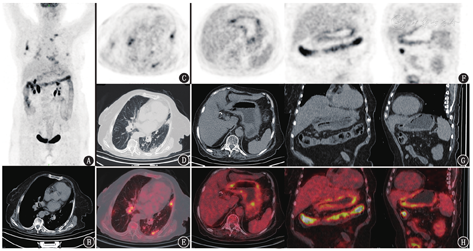
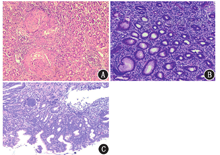
由于病理活检不支持胃恶性肿瘤的诊断,患者遂行18F-脱氧葡萄糖(fluorodeoxyglucose, FDG;放化纯>95%)PET/CT(德国Siemens Biograph TruePoint 64型)显像,结果(图1)示:双肺及双侧胸膜多发小斑片影及小结节影(大者最大径为1.5 cm),FDG摄取异常增高,最大标准摄取值(maximum standardized uptake value, SUVmax)为11.08(图1A~1E);胃壁弥漫性不均匀结节及肿块状增厚(最厚达1.6 cm),FDG代谢不均匀异常增高,SUVmax为6.27,胃周多发小粟粒淋巴结及絮状阴影,FDG摄取轻度增高,SUVmax为2.5(图1F~1H)。考虑:(1)双肺、胃体及胃窦壁结核,肺门、纵隔、胃周、肠系膜及腹膜后多发淋巴结结核;(2)弥漫性胃癌并腹膜后及腹盆腔多发淋巴结转移不能完全排除,宜病理复诊。患者再行病理活检,结果(图2A)提示:(胃体下段)肉芽肿性炎,多考虑结核,请临床进一步检查。患者1周后再行病理活检(图2B)提示(胃窦、胃体)肉芽肿性炎,符合结核。抗酸染色发现可疑阳性菌。患者确诊后,予异烟肼、利福平、吡嗪酰胺、莫西沙星等联合抗结核治疗6个月,腹胀、呕吐症状明显减轻。复查胃镜示胃体上部至胃窦黏膜呈"花斑"状,黏膜皱襞变粗,胃壁稍增厚,未见明显结节状隆起;超声示胃壁黏膜至黏膜下层增厚,厚度约0.7 cm,局限性黏膜缺损,黏膜至黏膜下层弥漫浸润性改变,病理活检提示黏膜慢性炎性反应(图2C)。


胃是人体结核感染中的罕见器官,约60%以上的患者胃结核继发于肺结核,可伴有肠结核或骨结核等[1]。该病最早由Barkhausen报道,国内发病率较国外略高[2,3],但在临床上仍属少见,在因结核死亡的尸检病例中胃结核的检出率仅为0.03%~0.21%[4]。本例患者病灶累及范围较广,全胃(胃窦、胃底、胃体)均受到结核菌浸润。目前胃结核感染机制尚不明确,有文献报道其可能与以下因素有关[5]:(1)胃黏膜损伤,黏膜屏障破坏;(2)胃酸减少,胃液的杀菌力降低;(3)胃动力不足,结核菌在胃内停留时间较长;(4)胃壁缺乏淋巴滤泡等。
胃结核的临床表现主要是胃肠道症状,如腹痛、恶心呕吐、消化不良,偶有反酸、嗳气等[5,6],部分患者可表现为幽门梗阻或上腹部包块,少数可表现为上消化道出血[1]。本例患者临床表现主要为腹胀、纳差,有时餐后出现恶心、呕吐等消化道症状,且痰液结核菌涂片未找到抗酸杆菌,结核抗体(-),结核菌细胞免疫检查结果阴性,血沉未见加快,临床症状不典型,故很难发现。
胃结核诊断困难,临床表现及B超、CT及胃镜等检查手段均无特异性,与胃溃疡、胃癌、克罗恩病等难以鉴别[2]:B超可显示幽门区低回声肿块,也可显示肠系膜、腹腔和主动脉旁淋巴结肿大及腹膜增厚;CT可显示弥漫性胃壁不规则增厚,多发肠系膜淋巴结肿大和腹膜增厚等;胃镜常表现为黏膜下病变或胃窦附近曲度较小的溃疡,结核性溃疡可为巨大、不规则、单发或多发,常与胃癌鉴别困难,但因上消化道内镜可进行结核性病变镜下活检,因此对胃病变的定位和诊断具有重要作用[1,2]。胃结核的最终确诊仍然依靠病理组织学,包括抗酸杆菌的Ziehl-Neelsen染色和培养,尤其是"干酪"样上皮样细胞肉芽肿的发现对病理组织学确诊最有价值,PCR技术是该病诊断的"金标准"[7]。
18F-FDG PET/CT显像在鉴别消化系统病变良恶性方面有明显优势,胃淋巴瘤及胃癌的PET/CT显像均可表现为不同形式的胃壁增厚和SUVmax的显著增高[8],而结核病PET/CT显像会因炎性反应活动的程度不同表现为溃疡、增生及瘢痕等病理改变,也可形成类似胃肠道恶性肿瘤的肿块,这都会导致PET显像标准摄取值(standardized uptake value, SUV)不同程度的增高[9,10]。因此,单纯利用18F-FDG PET显像的SUVmax来进行胃淋巴瘤、胃癌及胃结核的鉴别诊断灵敏度较差[10,11]。对于胃淋巴瘤、胃癌及胃结核可以从其发病部位及CT表现进行鉴别:(1)胃癌大多起源于胃黏膜层并向黏膜下层及肌层浸润,CT扫描常见胃壁僵硬及胃腔狭小、黏膜表面隆起及"火山口样"改变等。(2)胃淋巴瘤主要发生于胃黏膜下层,病变常沿黏膜下层蔓延生长,CT影像往往表现为胃壁弥漫性增厚,厚度相对均匀,且黏膜表面相对光滑。(3)胃结核是以结核菌浸润胃黏膜、黏膜下层,亦可向肌层浸润为主要病理改变,本例全胃结核患者CT和胃镜均显示胃底、胃体、胃角和胃窦部胃壁多发大小不等的结节状不规则增厚及胃腔狭小,与弥漫性胃癌鉴别诊断相对困难。但由于该例既往有结核病史,且本次胸部CT仍能发现肺结核转归中不同时期的影像学特征(如增殖、纤维化及钙化证据;图1B~1E)。因此,结合病史、影像学表现及实验室检查综合判断:肺及胃结核的诊断应予以优先考虑。当本例鉴别诊断较困难时,结合患者临床症状、实验室检测结果(肿瘤标志物、结核相关检查等)及其他辅助检查(超声胃镜及病理)资料,为正确诊断提供了重要的参考依据。
18F-FDG PET/CT显像诊断全胃结核缺少特异性[10,12],与胃淋巴瘤、弥漫性胃癌等难以鉴别,但其对于胃结核的价值不在于明确诊断,主要用于提醒诊断医师当胃镜活检结果为阴性时,需考虑黏膜下来源的胃部疾病(如胃肠间质瘤、结核等)的可能,从而有助于临床医师对疑似或已知结核病例进行评估和疗效观察[12]。遗憾的是,本例患者因家庭经济条件限制未能在抗结核治疗后再行18F-FDG PET/CT复查。作为全身性检查,18F-FDG PET/CT显像评估全身器官受侵犯情况可使进一步检查更有针对性,并为病理确诊取材提供位置导向和参考。
所有作者均声明不存在利益冲突


























