
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,76岁。2018年外院前列腺穿刺活组织检查(简称活检)诊为前列腺癌[Gleason评分4+4,血清前列腺特异抗原(prostate specific antigen, PSA)>20 μg/L],予戈舍瑞林+比卡鲁胺治疗半年,PSA下降满意。1年后发现右足跟肿物,CT提示右足跟骨内6.1 cm×4.8 cm大小占位,外院全身骨显像示多发骨骼摄取增高灶,考虑为前列腺癌转移灶可能;盆腔MRI提示前列腺外周带右侧异常信号,右侧腹股沟及左盆腔淋巴结肿大;血清PSA 0.5 μg/L。鉴于18F-脱氧葡萄糖(fluorodeoxyglucose, FDG)PET/CT对前列腺癌的诊断效果欠佳,很大比例的前列腺癌及其转移灶为假阴性,诊断灵敏度仅为30%~50%[1];另外由于18F-FDG对于肿瘤的非特异性,其在判断前列腺局灶性炎性反应和前列腺癌中的特异性较差,仅有约20%的前列腺18F-FDG摄取增高灶被证实为前列腺癌[2],因此患者行68Ga-前列腺特异膜抗原(prostrate specific membrane antigen, PSMA)PET/CT(图1)以评估前列腺癌的情况。
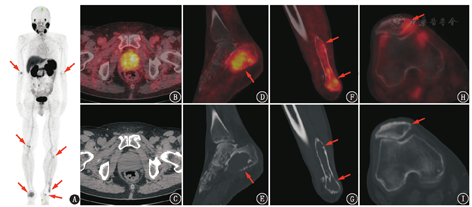

PSMA是具有750个氨基酸的跨膜糖蛋白,在大多数前列腺癌的原发灶和转移灶中均高表达,且在低分化、转移或去势抵抗性前列腺癌中的表达明显增加,其表达水平是疾病预后的重要预测因素[3,4]。68Ga-PSMA PET/CT是以PSMA为基础的前列腺癌分子影像新技术,适应证主要包括前列腺癌靶向定位活检、手术与外放疗前分期、生化复发的前列腺癌病灶定位诊断、指导转移性去势抵抗性前列腺癌PSMA放射配体治疗、转移性前列腺癌全身治疗监测等。本例68Ga-PSMA PET/CT显像见前列腺增大,最大横截面6.1 cm×4.8 cm,前列腺腺体摄取不均匀增高,最大标准摄取值(maximum standardized uptake value, SUVmax)8.5,符合前列腺癌原发病灶的表现;盆腔及腹股沟淋巴结未见异常摄取。此外,四肢骨骼发现多处68Ga-PSMA摄取异常增高灶,包括右侧尺骨鹰嘴、左肱骨内侧髁、右股骨内侧髁、右侧髌骨、左胫骨上段、左腓骨下段、双侧跟骨,其中以右侧跟骨病灶最为显著,SUVmax 6.0,上述骨病灶均为单纯的溶骨性改变,较大的病灶呈膨胀性生长并破坏骨皮质。
68Ga-PSMA PET/CT是灵敏度很高的前列腺癌影像诊断技术。本例前列腺癌诊断明确,在治疗过程中发现骨多发病灶,原发灶及骨病灶68Ga-PSMA摄取明显增高且摄取程度相当,诊断需首先考虑前列腺癌伴多发骨转移,但该诊断存在几个疑问:(1)血清PSA 0.5 μg/L是较低水平的PSA,意味着瘤负荷较低,此时患者存在多发骨转移的概率有多大?(2)为何骨病灶均出现在四肢骨,而最易发生骨转移的中轴骨未见异常?(3)前列腺骨转移一般为成骨性转移,而本例病灶均为单纯溶骨性改变,未出现成骨成分,是什么原因?(4) 68Ga-PSMA摄取增高的病灶是否均为前列腺癌及其转移灶?
在高分化或中分化的转移性前列腺癌患者中,通常血清PSA>10 μg/L,但Gleason评分较高的低分化前列腺可几乎不产生PSA,因此PSA较低甚至正常并不能排除骨转移。另外,在接受了前列腺癌根治术、抗雄激素去势治疗、睾丸切除去势治疗的前列腺癌患者中,PSA会降到较低水平,在PSA<0.5 μg/L的患者中,68Ga-PSMA PET/CT仍有约1/3的阳性率,其中一半存在骨转移[5]。本例患者接受抗雄激素去势治疗后血清PSA降至0.5 μg/L,有多发骨转移的可能。
肿瘤骨转移首先发生在红骨髓最丰富的中轴骨,这可能与血运和骨髓微环境有关。少见情况下,肿瘤骨转移也可能只出现于四肢骨骼而中轴骨不受累(图2)。但大部分的肿瘤骨转移以累及中轴骨为主,仅累及四肢远端骨骼且病灶多发的情况少见。前列腺癌骨转移通常为成骨性,以新骨形成为特征,这可能与前列腺癌释放的PSA可裂解甲状旁腺激素相关蛋白有关,其可阻断肿瘤诱导的骨质吸收,同时PSA也可激活骨微环境释放的成骨细胞生长因子。绝大部分的前列腺癌骨转移为成骨性,但其中也可有由破骨细胞介导的溶骨性成分,文献中也有一些个例报道表现为广泛溶骨性破坏的前列腺癌骨转移[6,7],但均很少见。本例有5个以上骨骼病灶,均分布于四肢长骨远端,所有病灶均为单纯溶骨性改变而未见成骨成分,这些特点提示要鉴别其他非前列腺来源的疾病,如原发性骨肿瘤或其他累及骨骼的系统性疾病。
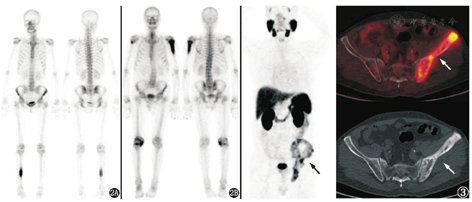

68Ga-PSMA是诊断和评估前列腺癌的方法,但PSMA不仅仅表达于前列腺癌上皮细胞膜,其他实体肿瘤(如肺癌、肾癌、结肠癌、食管癌、甲状腺癌、脑肿瘤等)的新生血管内皮细胞也有PSMA的表达,这些肿瘤原发灶及转移灶能摄取68Ga-PSMA。此外,一些良性病变(如支气管扩张伴感染、结节病、Paget病等)也可能摄取68Ga-PSMA[8,9]。图3为1例前列腺增生合并骨盆Paget病的患者,血清PSA 13.51 μg/L,外院前列腺MR见前列腺外周带小片状异常信号,骨显像曾考虑前列腺癌骨盆转移,68Ga-PSMA PET/CT显像见左侧骨盆摄取不均匀异常增高,前列腺摄取未见异常,结合CT表现考虑骨盆Paget病。
本例因骨骼病变异于前列腺癌骨转移的表现,追问患者病史13年前曾行鼻腔孤立性浆细胞瘤手术及放疗,之后未见复发。结合病史及骨病特点,考虑多发性骨髓瘤可能,这恰好是典型的以单纯溶骨性骨病变为特点的骨病。之后患者行CT引导下右跟骨病灶穿刺活检,病理示纤维组织内见弥漫成片浆样细胞浸润,考虑多发性骨髓瘤;同时查血清蛋白电泳及免疫固定电泳示免疫球蛋白(immunoglobulin, Ig)G-λ型M蛋白阳性,证实了多发性骨髓瘤的诊断。
68Ga-PSMA是近几年核医学分子影像领域的研究亮点,68Ga-PSMA以及基于PSMA的核素靶向治疗在很大程度上改变了前列腺癌的诊治策略。68Ga-PSMA对于前列腺癌原发灶、转移灶的诊断具有很高的灵敏度和准确性,但应用时也要了解该法潜在的局限性。核医学的每一种示踪剂、每一种显像方法几乎都是基于某种功能或分子特征的"特异性"设计的,这种设计模式使得核医学影像背后的意义变得简单、直接、易懂。在认识到每一种示踪剂所反映的病理生理基础和分子特征后,可根据其原理基础做出"是"或"否"的初步判断。但实际上,在临床中并不能完全用这样的方式来解读核医学影像,因为核医学的每一种示踪剂和显像方法几乎都不具备完美的特异性和灵敏度。因此,对于核医学影像而言,在了解示踪原理的设计基础后,还需要跳出核医学这种"特异性"示踪影像的局限,才能做出更准确的影像解读。
所有作者均声明不存在利益冲突


























