
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
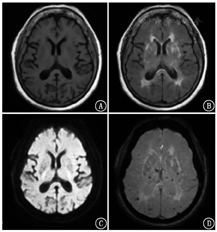
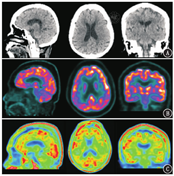
患者女,73岁,受教育程度:6年(小学文化)。因"出现幻视半年余伴认知障碍(主诉看到已过世或不存在的人及经常不能认出丈夫)、进行性记忆下降3年余"就诊。体格检查:血压130/80 mmHg(1 mmHg=0.133 kPa),双侧瞳孔等大正圆,反应迟钝,双侧鼻唇沟等深,四肢肌张力增高,双上肢和双下肢腱反射未引出,无颈项强直,Kernig征阴性。神经精神心理学评估:计算力明显下降,不能配合完成神经精神量表检查。既往史:高血压10余年,控制可,无糖尿病、症状性脑卒中等病史。实验室检查:甲状腺功能正常,叶酸、血清维生素B12正常,梅毒筛查甲苯胺红不加热血清试验(toluidine red unheated serum test, TRUST)阴性。头颅MRI示:T1加权成像(weighted imaging, WI)未见明显异常(图1A);T2WI示多发非对称性白质高信号病灶并延伸至皮质下白质(图1B);弥散WI(diffusion WI, DWI)未见明显异常(图1C);磁敏感WI(susceptibility WI, SWI)示颅内散在皮质、皮质下多发微出血病灶(图1D)。18F-脱氧葡萄糖(fluorodeoxyglucose, FDG)及淀粉样蛋白显像剂18F-florbetapir[AV-45;AV-45显像得到本院伦理委员会的批准(批准号:2018-191),患者签署知情同意书]由本院核医学科自制,PET/CT(德国Siemens Biography mCT)显像结果如下:CT示右侧脑室旁腔隙性脑梗死灶(图2A);双侧顶叶、双侧枕叶和右侧额叶弥漫性FDG代谢轻度减低(图2B);双侧额叶、颞叶、顶叶和枕叶皮质见淀粉样蛋白沉积(图2C)。根据脑淀粉样血管病(cerebral amyloid angiopathy, CAA)波士顿诊断标准[1,2],最终临床诊断为CAA。


CAA是指淀粉样蛋白沉积于脑皮质和软脑膜血管所致中枢神经系统的脑小血管病变,病理学特征是淀粉样蛋白在大脑皮质和髓质的中小动脉(极少累及静脉)中层和外膜上的沉积。根据沉积的淀粉样蛋白种类分为7种类型,其中β-淀粉样蛋白(β-amyloid, Aβ)沉积与阿尔茨海默病(Alzheimer′s disease, AD)的病理表现类似,CAA患者脑血管内沉积的是相对较短的Aβ40氨基酸片段,且临床上经常发现CAA合并AD[2,3]。CAA临床表现复杂,可以表现为脑叶出血、痴呆、认知和神经功能减退、暂时性局灶性神经症状发作等,仅凭临床体征诊断困难。CAA的临床确诊包括病理学和影像学证据支持,一般患者较难接受脑组织活组织检查(简称活检),Aβ PET显像反映脑内Aβ的异常沉积,被认为是CAA的活体病理诊断,越来越广泛地应用于CAA与正常认知健康对照组或自发性深部脑出血患者的鉴别诊断,诊断准确性中等至良好[4,5]。
CAA患者Aβ PET显像全脑皮质的Aβ沉积滞留率明显高于正常组,以枕叶为主,Aβ PET显像阴性可能有助于在合适的临床评估下排除CAA。需注意的是,部分认知功能正常的老年人也有Aβ沉积表现,故阳性显像不一定是确诊AD或其他认知功能障碍的唯一指标,一定要结合临床症状和体征[5,6,7]。目前诊断CAA主要依据波士顿诊断标准进行[1,2],具体如下:(1)发病年龄≥40岁;(2)起病方式为急性、亚急性或慢性;(3)有头痛、精神状态或行为改变、局灶性神经系统体征、癫中1项以上的临床表现;(4)MRI示单发或多发白质高信号病灶(皮质、皮质下或深部),非对称性并延伸至皮质下白质(非对称性并非既往颅内出血所致);(5)MR SWI示≥1处皮质、皮质下出血性病灶(如脑出血、脑微出血、皮质表面铁沉积等);(6)排除肿瘤、感染等其他因素。文献报道CAA患者的FDG显像表现为全脑弥漫性代谢减低,以双侧枕叶为著[8]。
本例患者年龄73岁,缓慢起病,临床表现以幻视半年余伴认知障碍为主;其头颅MRI T2WI示多发非对称性白质高信号病灶并延伸至皮质下白质,SWI示颅内散在皮质、皮质下多发微出血病灶,符合影像学诊断标准;患者其他常规检查已排除感染及肿瘤病史,符合CAA波士顿诊断标准全部表现。因为患者认知功能下降,还需要鉴别诊断是否合并AD。首先,未见本例患者有明显海马萎缩,与AD不符;其次,Aβ沉积以双侧枕叶为著,而AD患者较少累及枕叶;最后,本例患者FDG代谢轻度减低而认知功能严重下降,与AD患者认知功能下降幅度和FDG低代谢程度一致的情况不符。因此,最终考虑患者CAA可能性较大,合并AD可能性较小。
产生幻视的原因众多,本例患者最终诊断CAA,这在临床相对少见。可能由于Aβ沉积枕叶所致多发微小出血,进而引起功能性损害,最终产生幻视、幻听。目前国内CAA病例并不少见,但其临床表现复杂,常见的如头痛、头胀、手麻等缺乏诊断特异性,有时仍需依靠脑组织活检才能明确诊断,而AV45显像剂的出现提供了活检外的无创性选择。建议对根据临床表现怀疑CAA的患者进行FDG及Aβ PET显像,从而提高该病的检出率。值得注意的是,AD和CAA关系密切,两者常有合并发生的现象。Thal等[9]对380例患者脑活检结果进行分析,发现其中71例被证实为AD,AD患者合并CAA-Ⅰ型占56.3%,CAA-Ⅱ型占36.6%,只有7.1%没有合并CAA。Hecht等[3]对284例患者进行尸检研究,发现CAA亚型中CAA-Ⅰ型与衡量AD严重程度的临床痴呆评定量表评分关系密切,具体机制与载脂蛋白E-ε4等位基因突变和皮质多发微小梗死灶有关,其中CAA-Ⅰ型合并AD的患者表现为Aβ严重沉积,而纤维斑块的纠集较轻。
总之,在条件允许的情况下,综合分析临床表现、Aβ沉积、神经系统代谢及结构改变(FDG PET、MRI)是神经系统疾病鉴别诊断的关键。
所有作者均声明不存在利益冲突





























