
放疗及根治性前列腺切除术是局限性前列腺癌的最终治疗选择。根治性前列腺切除术后前列腺特异抗原水平升高提示前列腺癌复发,此类患者仍可通过挽救性放疗治愈。为了使治愈机会最大化,放疗靶区应包括疾病的所有范围。因此,无论是根治性还是挽救性放疗,准确估计疾病位置对放疗规划至关重要。目前一线显像方法对前列腺癌的早期分期和生化复发的检测灵敏度均有限。将PET纳入前列腺癌患者的常规评估可以提高分期的准确性和放疗计划的规范性。目前,18F-脱氧葡萄糖(FDG)PET/CT已被常规用于多种癌症的放疗规划,但其对前列腺癌的灵敏度较低。其他评估前列腺癌的PET探针包括18F-NaF、11C-乙酸盐、11C或18F标记的胆碱、抗1-氨基酸-3-18F-氟环丁烷-1羧酸(18F-fluciclovine)和68Ga或18F标记的配体,均可与前列腺特异膜抗原(PSMA)结合。PSMA似乎是最灵敏和特异的配体,但其尚未获得美国食品与药品监督管理局(FDA)的新药申请批准。回顾性和前瞻性研究显示,PET/CT对前列腺放疗计划可能有潜在的重要价值。将患者随机分配到常规放疗计划与PET/CT辅助放疗计划的前瞻性试验或许可以得出很有意义的临床结果。目前正在进行前瞻性临床试验,评估利用18F-fluciclovine PET/CT对具有临床终点的挽救性放疗进行规划;建议进行前瞻性试验,评估PSMA PET/CT对前列腺放疗计划的临床影响。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2017年美国前列腺癌患者约有161 000例,其中死亡约27 000例[1]。局限性前列腺癌的有效治疗方法包括根治性前列腺切除术或放疗[2]。根治性前列腺切除术后的局部复发可能通过挽救性放疗(salvage radiotherapy, SRT)治愈[3]。任何局部治疗的有效性都依赖于精确的影像学检查,以排除可能仍未治疗的疾病区域。99Tcm骨显像及腹部CT或MRI分别评估骨转移、软组织转移及淋巴结转移,从而对前列腺癌进行分期。对于初始分期,99Tcm骨显像判断骨转移的灵敏度和特异性分别为46%~89%、32%~57%[4,5]。CT同MRI诊断淋巴结转移的灵敏度和特异性分别为39%~42%和82%[6]。这些扫描的准确性很低,通常导致对疾病严重程度的低估。局部治疗失败后,前列腺特异抗原(prostate specific antigen, PSA)水平升高可视为复发。然而,目前一线显像的灵敏度太低,不能及时发现复发病灶,因此不能及时指导挽救性治疗[7,8,9]。
直观地说,放射靶区应包括疾病的所有范围。因此,在放疗规划中,准确估计疾病位置至关重要。放射肿瘤学家在治疗靶区上做了区分,包括影像学上看到的病灶区域(大体肿瘤靶区)和影像学上虽然看不见但有很高隐藏疾病风险的靶区[临床靶区(clinical target volume, CTV)]。在可行的情况下,为对肿瘤进行控制和提升最终治愈的可能性,医师会采用更高剂量(考虑邻近正常组织的风险)。PET/CT可能提高前列腺癌的分期准确性,并影响放疗计划。
在许多癌症放疗计划的制定中,整合PET/CT信息是一种常规做法[10]。18F-脱氧葡萄糖(fluorodeoxyglucose, FDG)可检测恶性肿瘤内葡萄糖代谢的增加[11,12,13],有助于头颈部[14]、肺[15,16]、胃肠道[10]和宫颈[17]处癌症及淋巴瘤[18,19]放射计划的制定。然而,18F-FDG PET/CT对前列腺癌的灵敏度较低,应用严重受限[20,21],不过也有例外,如侵袭性低分化癌和小细胞前列腺癌[20,22],但这些在接受放疗的前列腺癌中仅占很小一部分。
其他一些PET/CT探针已在前列腺癌患者中进行了评估[21]。这些示踪剂可以针对前列腺癌细胞的代谢变化特征{11C、18F-胆碱标记的磷脂质,11C-乙酸盐标记的脂肪酸,18F-抗1-氨基酸-3-18F-氟环丁烷-1羧酸[18F-fluciclovine(Axumin; Blue Earth Diagnostics公司)]标记的氨基酸}、成骨细胞骨转移的重塑(18F-NaF)、细胞表面蛋白过表达[前列腺特异膜抗原(prostate-specific membrane antigen, PSMA)的标记配体][21]。11C-胆碱和18F-fluciclovine已获得美国食品与药品监督管理局(Food and Drug Administration, FDA)的新药申请批准,用于局部治疗后复发前列腺癌的影像学检查[23]。PSMA几乎可以说是检测局部和转移前列腺癌病灶最灵敏和特异的配体[24,25,26],但尚未批准使用。本文回顾了现有的科学文献,主要有3个目的:(1)描述PET/CT显像如何影响前列腺癌放疗计划;(2)评估各种PET/CT显像方式对放疗计划的潜在影响;(3)描述PET/CT对放疗计划影响的最新研究。
18F-NaF PET/CT会优先定位于骨重建活跃区域,这是成骨前列腺癌骨转移的特征。与99Tcm骨显像相比,其优点在于有较高的信噪比和更短的注射与显像时间间隔[27]。一些报道表明,18F-NaF PET/CT比99Tcm骨显像有更高的灵敏度和特异性[5,28,29]。18F-NaF PET/CT已获批准,但由于没有纳入医疗保险,且不能显示软组织或淋巴结病变,临床应用受限。由于胆碱转运的增加,11C和18F胆碱探针对前列腺癌组织具有选择性,这可能是由于细胞膜合成和增殖的变化所致[21]。对于前列腺切除术后PSA水平为2 μg/L的前列腺癌患者,11C-胆碱PET/CT能发现80%患者的复发迹象,大大超过了目前的一线显像方法。因此,美国FDA于2012年批准其用于局部治疗失败后复发性前列腺癌的显像[30]。
18F-fluciclovine是一种合成的氨基酸类似物,通过氨基酸转运体:丙氨酸-丝氨酸-半胱氨酸转运载体2(alanine-serine-cysteine transporter 2, ASCT2)和L型氨基酸转运载体1(L-type amino acid transporter-1, LAT-1)被细胞摄取[31,32]。与11C和18F胆碱示踪剂一样,18F-fluciclovine对前列腺癌的特异性取决于其代谢途径的改变。18F-fluciclovine PET/CT已广泛应用于生化复发的诊断。最近的一项大型多中心研究报道了其对PSA≤0.79 μg/L生化复发患者的检出率为40%[33]。与11C-胆碱相比,18F-fluciclovine对复发性前列腺癌的检出率有所提高,也促使其在2016年被批准用于复发性前列腺癌显像[23,34]。目前18F-fluciclovine对前列腺癌早期分期的评估正在进行中(NCT03081884)。
PSMA是一种在前列腺癌细胞上高度表达的细胞表面糖蛋白和叶酸水解酶[35]。PSMA表达随Gleason评分增加而增高[36,37],且在去势抵抗状态下保持高水平[38]。研究最明确的PSMA探针是小分子配体,如68Ga-PSMA-11和2-(3-(1-羧基-5-[(6-18F-氟-吡啶-3-羰基)-氨基]-戊基)-脲基)戊二酸{2-(3-(1-carboxy-5-[(6-18F-fluoro-pyridine-3-carbonyl)-amino]-pentyl)-ureido)-pentanedioic acid, 18F-DCFPyL},其与酶活性位点结合。最近的一项研究纳入120例中高危患者行68Ga-PSMA PET/CT初次分期,后行根治性前列腺癌切除术,68Ga-PSMA PET/CT检测淋巴结转移的灵敏度为66%,特异性为98.9%[39]。然而,有的较小型研究报告的灵敏度则较低[40],需要进一步研究以证实。有大规模回顾性研究显示,68Ga-PSMA PET/CT检测骨转移优于骨平面显像[41,42]。与11C-胆碱和18F-fluciclovine一样,68Ga-PSMA PET/CT在局部治疗失败的复发前列腺癌患者中被研究最多。大量回顾性研究显示,其对PSA低于0.5 μg/L患者的检出率为50%~58%,对PSA水平高于2 μg/L患者的检出率在95%以上[25,43]。68Ga-PSMA PET/CT对复发性前列腺癌的检出率超过18F-和11C-胆碱PET/CT[44,45],并可能超过18F-fluciclovine PET/CT[24]。还没有PSMA PET探针通过美国FDA批准,但许多试验正在进行中(NCT02918357、NCT02919111、NCT02673151、NCT02940262)。PSMA在前列腺癌细胞的高特异性表达促进了PSMA靶向放射配体疗法的发展[46]。177Lu-PSMA已被证实对难治性去势抵抗性前列腺癌转移有明确疗效[46,47]。更大规模的试验正在进行中(NCT03042312)。
本综述余下的部分将聚焦于18F和11C标记胆碱、18F-fluciclovine以及PSMA PET/CT显像在根治性放疗和SRT计划制定中的应用。
在计划前,放射肿瘤学家首先勾画出总靶体积和疑似隐匿性肿瘤区域(CTV)。考虑日常每例患者剂量设置的误差,最终靶区(计划肿瘤体积)往往是CTV的等距扩展。风险器官(如膀胱、直肠)也会被描绘出来。放射肿瘤学家的目的是在不损害周围器官功能的情况下,对肿瘤进行尽可能高的剂量照射。现代治疗计划利用了患者体位固定系统、动态多叶准直器、逆向规划技术和计算机剂量投送。最终的结果是给靶区(CTVs和计划肿瘤体积)的剂量具有高度适形和可重复性,并恰当避免对邻近正常组织和器官(特别是风险器官)的影响。因此,准确绘制恶性肿瘤组织本身是提升现代放疗疗效的关键限制因素。治疗计划通常以CT为基础,因为计算其精确剂量所需的电子密度可以从Hounsfield单位中推断出来。为了辅助目标轮廓圈定,可以通过基于交互信息的图像配准,将其他成像方式如MRI和PET/CT融合到专用的规划CT扫描中,以辅助目标的描绘。根据这些图像确定规划目标,并将生成的目标轮廓回传至专用的规划CT进行治疗规划(图1,图2)。
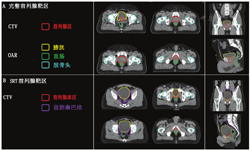


单独放疗或联合激素治疗是局部前列腺癌的可能治愈方法,也是根治性前列腺癌切除术后复发性前列腺癌可能治愈的SRT方法。值得注意的是,CT上通常看不到大体前列腺肿瘤。MRI可发现前列腺内的肿瘤病灶,具有良好的灵敏度[48],但多数前列腺肿瘤为多灶性,部分隐匿病灶在MRI上不可见[49]。因此,在确定的情况下,CTV包括整个前列腺、包括或不包括精囊和盆腔淋巴结,这取决于临床病理特征。图1A显示了1例典型的低危至中危前列腺癌患者的CTV和风险器官。医师给予患者前列腺的剂量比淋巴结的要高(如果包括的话)。在挽救性治疗组,CTV是前列腺窝和精囊残余物,包括或不包括盆腔淋巴结。图1B显示了复发性前列腺癌患者接受SRT的CTVs和风险器官,包括选择性盆腔淋巴结的覆盖。SRT靶区体积通常是在没有复发性疾病的影像学证据情况下绘制的。在实际中,大多数医师的CTVs建立是基于已发表的共识指南。放疗肿瘤组(Radiation Therapy Oncology Group, RTOG)已发表了盆腔淋巴结指南[50]。RTOG[51]、欧洲癌症研究和治疗组织[52]、澳大利亚和新西兰放射肿瘤学泌尿生殖组[53]发表了勾画前列腺床区轮廓的指南。这些共识CTVs正用于当前临床试验并指导常规护理。
在根治和挽救性治疗的情况下,盆腔淋巴结阴性的影像学价值尚不清楚,目前正在进行的相关随机试验有RTOG 0924, RTOG 0534, NCT00567580。实际上,许多放射肿瘤学家将部分患者的盆腔淋巴结纳入高风险(通常指由以下任何1种情况的患者:初始PSA水平>20 μg/L;临床或影像学T分期3级或以上;Gleason评分8分或以上;短时间内PSA倍增),作为根治和SRT剂量的设定。对于在淋巴结内、前列腺床区或前列腺本身有肿瘤影像学证据者,可以给出更高的剂量来覆盖广泛的肿瘤。这可以通过同时集成推量照射(在每个部分中向总肿瘤提供更高的剂量)或顺序增强(向总肿瘤提供更多的剂量)的技术来实现,也可以通过近距离放射疗法(临时或永久植入放射性粒子)来实现。
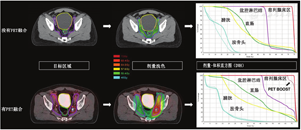
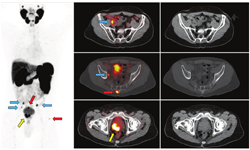
与PET/CT结合可能在许多方面影响放疗计划。首先,在PET/CT定义的目标体积内总体疾病可以给予更高剂量。图2显示了1例复发性前列腺癌患者的典型SRT计划,以及1例68Ga-PSMA阳性的左侧髂内淋巴结接受的剂量高于周围盆腔淋巴结患者的SRT计划。剂量显示为热图。剂量-体积直方图显示了涵盖每个描绘体积的给定百分比剂量。图中显示,68Ga-PSMA阳性淋巴结(加上边缘)100%接受超过65 Gy(图中虚线),而整个盆腔淋巴结体积100%接受45 Gy(图中紫色实线)。
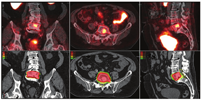
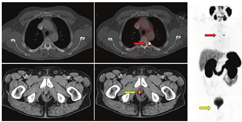
第二,CTVs可以被扩展到包括目前一线影像学未见的疾病区域,并且通常不是一致的CTVs靶点(图3)。第三,转移性疾病的证据表明,单靠局部治疗是无法治愈的。在寡转移性疾病(较低的转移性疾病负荷,在3~5处部位出现不同表达)的背景下,许多医师提供转移导向治疗,旨在局部消融转移灶(图4,图5,图6),转移导向治疗是当前众多临床试验的主题[54]。最后,在某些PET/CT意外显示的弥漫性转移病灶的病例中,放疗可能是无效的。
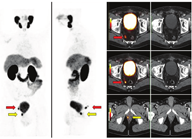




一些研究评估了分子PET/CT显像对明确前列腺放疗计划的影响(表1),López等[55]回顾性分析了9例11C-胆碱PET/CT对前列腺放疗的影响,其中4例在病灶轮廓及拟定剂量上有变化;2例肿瘤体积有扩大,包含了最初没有规划到的额外淋巴结区域;1例除接受前列腺和淋巴结治疗外,还接受了针对单发骨转移的转移导向治疗。1例在目前一线影像学上疑有转移却缺乏11C-胆碱摄取而被降级。Kuang等[56]报道了30例在放疗计划前准备接受18F-胆碱PET/CT检查的患者PET划定前列腺内病变局灶剂量的可行性。研究人员表示,在对正常组织有足够保护的情况下,接受79 Gy剂量的前列腺CTV增加至105 Gy是可行的。Vees等[57]对19例同时接受18F-胆碱PET/CT和前哨淋巴结SPECT检查的高危前列腺患者进行评估,18F-胆碱PET/CT发现2个淋巴结在标准CTVs范围内。这些阳性淋巴结的治疗会使用更高剂量。值得注意的是,前哨淋巴结SPECT/CT发现了104个淋巴结,其中27个未被纳入一致的CTVs中。
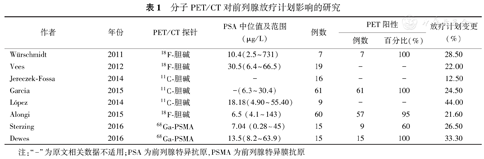
分子PET/CT对前列腺放疗计划影响的研究
分子PET/CT对前列腺放疗计划影响的研究
| 作者 | 年份 | PET/CT探针 | PSA中位值及范围(μg/L) | 例数 | PET阳性 | 放疗计划变更(%) | |
|---|---|---|---|---|---|---|---|
| 例数 | 百分比(%) | ||||||
| Würschmidt | 2011 | 18F-胆碱 | 10.4(2.5~731) | 7 | 7 | 100 | 28.50 |
| Vees | 2012 | 18F-胆碱 | 30.5(6.4~66.5) | 19 | - | - | 22.00 |
| Jereczek-Fossa | 2014 | 11C-胆碱 | - | 16 | - | - | 12.50 |
| Garcia | 2015 | 11C-胆碱 | -(6.3~30.4) | 61 | 61 | 100 | 24.50 |
| López | 2014 | 11C-胆碱 | 18.18(4.90~55.40) | 9 | - | - | 44.00 |
| Alongi | 2015 | 18F-胆碱 | 6.5 (4.1~143) | 60 | 57 | 95 | 21.60 |
| Sterzing | 2016 | 68Ga-PSMA | 7.04 (0.28~45) | 15 | 9 | 60 | 26.50 |
| Dewes | 2016 | 68Ga-PSMA | 13.5(8.2~63.9) | 15 | 15 | 100 | 33.30 |
注:"-"为原文相关数据不适用;PSA为前列腺特异抗原,PSMA为前列腺特异膜抗原
Zamboglou等[58]报道了10例患者在接受77 Gy剂量的前列腺内,将68Ga-PSMA标定的局部病灶提高到95 Gy的可能性。同组还报道了68Ga-PSMA与多参数MRI对前列腺内病灶的一致性[59]。Dewes等[60]报道了15例接受放疗并在计划前接受68Ga-PSMA PET/CT的患者,15例中有8例改变了TNM分期,分别有5例和12例出现CTVs的改变和原定剂量的改变,2例先前行11C-胆碱显像疑似转移性疾病的患者被降级。Sterzing等[61]报道了15例接受68Ga-PSMA PET/CT制定放疗计划的患者,4例患者TNM分期发生变化,从而导致了CTV和剂量的改变。
目前尚缺乏评估PET/CT对前列腺放疗计划影响的随机前瞻性试验。最近,对接受放疗和雄激素去势联合治疗的高危前列腺癌患者进行的雄激素抑制联合选择性淋巴结和剂量升级放疗(androgen suppression combined with elective nodal and dose escalated radiation therapy, ASCENDE-RT)Ⅲ期试验显示,9年无进展和无转移生存率分别是73%和87%[62]。前列腺癌的长期自然病史,甚至高危患者根治性放疗的成功率[62],都需要大量患者数据来支持该项试验,以发现无转移生存的改善。通常局部环境下,患者无生化进展的主要生存终点,并不需要大量的样本。
多项研究评估了PET/CT分子显像对SRT计划的影响(表2)。
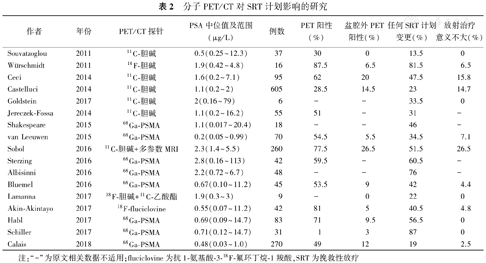
分子PET/CT对SRT计划影响的研究
分子PET/CT对SRT计划影响的研究
| 作者 | 年份 | PET/CT探针 | PSA中位值及范围(μg/L) | 例数 | PET阳性(%) | 盆腔外PET阳性(%) | 任何SRT计划变更(%) | 放射治疗意义不大(%) |
|---|---|---|---|---|---|---|---|---|
| Souvatzoglou | 2011 | 11C-胆碱 | 0.5(0.25~12.3) | 37 | 30 | 0 | 13.5 | 0 |
| Würschmidt | 2011 | 18F-胆碱 | 1.9(0.42~4.8) | 16 | 87.5 | 6.5 | 81.5 | 6.5 |
| Ceci | 2014 | 11C-胆碱 | 1.6(0.2~7.1) | 95 | 62 | 20 | 47.5 | 15.8 |
| Castelluci | 2014 | 11C-胆碱 | 1.1(0.2~2) | 605 | 28.5 | 14.5 | 23 | 14.7 |
| Goldstein | 2017 | 11C-胆碱 | 2(0.16~79) | 6 | - | - | 33.5 | 0 |
| Jereczek-Fossa | 2014 | 11C-胆碱 | 1.1(0.2~16.2) | 55 | 51 | - | 31 | - |
| Shakespeare | 2015 | 68Ga-PSMA | 1.1(0.017~20.4) | 18 | - | - | 46 | - |
| van Leeuwen | 2015 | 68Ga-PSMA | 0.2(0.05~0.99) | 70 | 54.5 | 5.5 | 34.5 | 7.1 |
| Sobol | 2016 | 11C-胆碱+多参数MRI | 2.3(1.4~5.5) | 260 | 77.5 | 26.5 | 51.5 | 26.5 |
| Sterzing | 2016 | 68Ga-PSMA | 2.8(0.16~113) | 42 | 59.5 | - | 60.5 | - |
| Albisinni | 2016 | 68Ga-PSMA | 2.2(0.72~6.7) | 48 | - | - | 76 | - |
| Bluemel | 2016 | 68Ga-PSMA | 0.67(0.10~11.2) | 45 | 53.5 | 9 | 42 | 4.4 |
| Lamanna | 2017 | 18F-胆碱+11C-乙酸酯 | 1.9(0.3~3) | 9 | - | 0 | 22 | 0 |
| Akin-Akintayo | 2017 | 18F-fluciclovine | 0.55(0.07~11.2) | 42 | 81 | 5 | 40.5 | 4.8 |
| Habl | 2017 | 68Ga-PSMA | 0.69(0.09~14.7) | 83 | 71 | 9.5 | 56.5 | 0 |
| Schiller | 2017 | 68Ga-PSMA | 0.71(0.12~14.7) | 31 | 1 | 3 | 87 | 0 |
| Calais | 2018 | 68Ga-PSMA | 0.48(0.03~1.0) | 270 | 49 | 12 | 19 | 2.5 |
注:"-"为原文相关数据不适用;fluciclovine为抗1-氨基酸-3-18F-氟环丁烷-1羧酸,SRT为挽救性放疗
Souvatzoglou等[63]对37例前列腺癌根治性切除术后生化复发(中位PSA 0.5 μg/L)患者进行了回顾性研究,这些患者接受了11C-胆碱PET/CT检查。30%的患者11C-胆碱PET/CT阳性,其中盆腔淋巴结复发5例,前列腺床区内复发6例。患者最初均计划单独在前列腺床区行SRT,11C-胆碱PET显示有13.5%的患者盆腔淋巴结阳性。Würschmidt等[64]同样报道了18例生化复发患者(中位PSA 1.9 μg/L)行18F-胆碱PET/CT检查,患者最初均计划直接在前列腺床区进行SRT,87.5%的患者18F-胆碱PET/CT阳性,除1例外,余均因剂量增加或纳入盆腔淋巴结而影响了SRT。Ceci等[65]报道在95例前列腺切除术后生化复发的患者(中位PSA 1.6 μg/L)中,62%的11C-胆碱PET/CT结果阳性,31.5%的患者靶区体积发生改变,15.8%的患者因PET结果没有实施原有的SRT计划(因为发现远处转移)。Castellucci等[66]报道了605例前列腺根治性切除术后生化复发患者[其中19例还接受了前列腺床区辅助放疗(中位PSA 1.07 μg/L,范围0.2~2 μg/L)],他们在计划行SRT前接受了11C-胆碱PET/CT检查,28.5%的患者显像阳性,14.5%有远处转移迹象。11C-胆碱PET/CT改变了23%的患者计划SRT,其中14.7%的患者由于有远处转移灶而未行原定计划的治疗。Jereczek-Fossa等[67]报道了60例前列腺癌根治术后生化失败患者(其中5例长期雄激素去势治疗的患者有去势抵抗的迹象),他们行11C-胆碱PET/CT进行SRT规划(中位PSA 1.1 μg/L);11C-胆碱PET/CT阳性率为51%,所有显像阳性且盆腔内有复发的患者,除前列腺床区及盆腔淋巴结照射外,复发灶剂量均增大至80 Gy;毒性反应是可以接受的(急性3级胃肠道毒性发生率为5%)。整体来看,这些研究纳入的1 083例患者中,357例(33%)在SRT计划中加入11C-胆碱PET,从而改变了最初的放疗计划[63,64,65,66,67,68,69,70]。这些研究主要的局限性在于,11C-胆碱PET/CT检测时中位PSA明显高于SRT启动时的PSA阈值。SRT的成功率随PSA的升高而降低。大多数医师在PSA水平低于1 μg/L或最好在0.2 μg/L以下时开始SRT[71]。因此,在这些阈值或阈值以下时,检测疾病的显像最有可能影响SRT。
对于68Ga-PSMA PET/CT来说,即使PSA水平低于0.5 μg/L[72],检测率也约为50%,这足以影响常规SRT的靶区绘制。有7项研究评估了68Ga-PSMA PET/CT对放疗计划的潜在影响。Shakespeare[73]报道68Ga-PSMA PET/CT改变了46%患者的放疗计划(包括首程放疗、前列腺切除术后SRT和额外附加的补救性再次放疗)。Sterzing等[61]报道了42例前列腺切除术后生化复发(中位PSA 2.8 μg/L)的患者行68Ga-PSMA PET/CT检查,PET对其中51%的患者放疗计划有影响。Albisinni等[74]报道了131例患者中99例(76%)后续治疗的影响,这些患者的PSA水平在经过各种治疗(手术、放疗、高强度聚焦超声)后有所上升。Bluemel等[44]报道了45例前列腺切除术后生化复发患者,他们接受了68Ga-PSMA PET/CT检查,其中53.3%的患者显像阳性,42.2%的患者SRT改变,这些变化包括47%靶区体积增大、32%剂量增加、10% SRT完全消失。Habl等[72]报道了31例在SRT开始前发现68Ga-PSMA显示有阳性淋巴结的患者,其中40%并未被标准RTOG的CTVs所覆盖。因此,68Ga-PSMA PET/CT导致了87%的患者SRT计划改变[分别有51.5%采用了剂量递增、40%靶区体积增大、3%接受了转移导向立体定向放疗(stereotactic body radiation therapy, SBRT)][72]。整体来看,68Ga-PSMA PET/CT对SRT计划的总体影响中位数为46%(34.5%~87%)。这些报告主要局限性在于患者不均一,即复发解剖描述不一致,以及68Ga-PSMA PET/CT检查时患者间PSA的范围波动较大[44,61,72,73,74,75,76]。笔者最近对270例前列腺癌根治术后低PSA(<1 μg/L;中位PSA 0.48 μg/L)生化失败的患者行均质队列研究,发现68Ga-PSMA PET/CT检出19%的患者(40%患者68Ga-PSMA PET/CT阳性)前列腺床区和盆腔淋巴结RTOG标准容积规划并未覆盖到病变,上述研究意味着对SRT计划有重大影响[77]。
目前的一线影像学用于指导当前前列腺治疗的许多临床试验。随着PET/CT被纳入常规检查,许多被现有影像学划为N0或M0期的患者很可能被更准确地分期为N1或M1。Roach等[78]最近报道了431例原发和复发前列腺癌患者68Ga-PSMA PET/CT的检查结果,这些患者的一线影像结果呈阴性或不明确。PET显像显示分别有39%和16%患者有先前未知的淋巴结疾病和远处转移病灶[78]。
许多被PET/CT提高了分期级别的患者,转移性疾病的负担有限。对于初始分期有N1影像学证据的患者,目前的治疗方针包括前列腺和盆腔淋巴结放疗及长期雄激素去势治疗[79]。对有N1影像学证据的患者,局部治疗失败后的治疗方法尚不清楚。前列腺癌M1期的患者主要采用雄激素去势治疗。然而,对许多临床医师来说,以不同于全身广泛转移患者的治疗方式来治疗有限的转移病灶(寡转移)患者似乎是合理的(研究者对寡转移前列腺癌有不同的定义,一般指最多有3~5处明显的远处转移)。转移导向治疗,是通过SBRT或转移瘤切除术,伴或不伴有全身系统性治疗的一种正在策划进行中的前瞻性试验策略[80]。前列腺癌寡转移患者是否最终会受益于与全身广泛转移转灶不同的治疗策略目前尚不清楚。不过在任何情况下,随着临床医师采用PET/CT进行初始和复发分期,对这些患者的识别可能会大大增加。
目前进行的一些前瞻性试验正在评估PET/CT在各种临床环境下对前列腺癌治疗的影响(表3)。在生化复发的情况下,FALCON试验(NCT02578940)正在评估18F-fluciclovine PET/CT对SRT策略的影响。加拿大安大略的劳森健康研究所正在进行3项试验,评估18F-fluciclovine PET/CT对目前一线影像结果阴性患者SRT的影响(NCT01804231, NCT02131649, NCT01804231)。多伦多大学也正在进行术后生化阴性和当前一线影像学阴性患者18F-DCFPyL PET/CT的单臂试验(NCT03160794)。终点是检测到寡复发病灶,以及对可检测到病灶且适用于寡转移灶SBRT患者的生化反应。
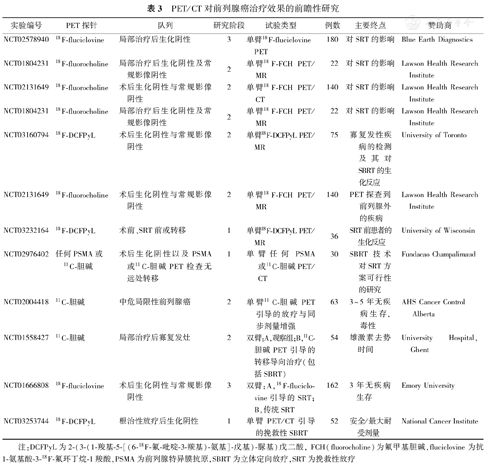
PET/CT对前列腺癌治疗效果的前瞻性研究
PET/CT对前列腺癌治疗效果的前瞻性研究
| 实验编号 | PET探针 | 队列 | 研究阶段 | 试验类型 | 例数 | 主要终点 | 赞助商 |
|---|---|---|---|---|---|---|---|
| NCT02578940 | 18F-fluciclovine | 局部治疗后生化阴性 | 3 | 单臂18F-fluciclovine PET | 180 | 对SRT的影响 | Blue Earth Diagnostics |
| NCT01804231 | 18F-fluorocholine | 局部治疗后生化阴性及常规影像阴性 | 2 | 单臂18F-FCH PET/MR | 22 | 对SRT的影响 | Lawson Health Research Institute |
| NCT02131649 | 18F-fluorocholine | 术后生化阴性与常规影像阴性 | 2 | 单臂18F-FCH PET/CT | 140 | 对SRT的影响 | Lawson Health Research Institute |
| NCT01804231 | 18F-fluorocholine | 局部治疗后生化阴性及常规影像阴性 | 2 | 单臂18F-FCH PET/MR | 22 | 对SRT的影响 | Lawson Health Research Institute |
| NCT03160794 | 18F-DCFPyL | 术后生化阴性与常规影像阴性 | 2 | 单臂18F-DCFPyL PET/MR | 75 | 寡复发性疾病的检测及其对SBRT的生化反应 | University of Toronto |
| NCT02131649 | 18F-fluorocholine | 术后生化阴性与常规影像阴性 | 2 | 单臂18F-FCH PET/MR | 140 | PET探查到前列腺外的疾病 | Lawson Health Research Institute |
| NCT03232164 | 18F-DCFPyL | 术前、SRT前或转移 | 1 | 单臂18F-DCFPyL PET/MR | 36 | SRT前患者的生化反应 | University of Wisconsin |
| NCT02976402 | 任何PSMA或11C-胆碱 | 术后生化阴性以及PSMA或11C-胆碱PET检查无远处转移 | 1 | 单臂任何PSMA或11C-胆碱PET/CT | 30 | SBRT技术对SRT方案可行性的研究 | Fundacao Champalimaud |
| NCT02004418 | 11C-胆碱 | 中危局限性前列腺癌 | 2 | 单臂11C-胆碱PET引导的放疗与同步剂量增强 | 63 | 3~5年无疾病生存,毒性 | AHS Cancer Control Alberta |
| NCT01558427 | 11C-胆碱 | 局部治疗后寡复发灶 | 2 | 双臂:A,观察组;B,11C-胆碱PET引导的转移导向治疗(包括SBRT) | 54 | 雄激素去势时间 | University Hospital, Ghent |
| NCT01666808 | 18F-fluciclovine | 术后生化阴性与常规影像阴性 | 3 | 双臂:A,18F-fluciclovine引导的SRT;B,传统SRT | 162 | 3年无疾病生存 | Emory University |
| NCT03253744 | 18F-DCFPyL | 根治性放疗后生化阴性 | 1 | 单臂PET/CT引导的挽救性SBRT | 52 | 安全/最大耐受剂量 | National Cancer Institute |
注:DCFPyL为2-(3-(1-羧基-5-[(6-18F-氟-吡啶-3-羰基)-氨基]-戊基)-脲基)戊二酸,FCH(fluorocholine)为氟甲基胆碱,fluciclovine为抗1-氨基酸-3-18F-氟环丁烷-1羧酸,PSMA为前列腺特异膜抗原,SBRT为立体定向放疗,SRT为挽救性放疗
有2项单臂试验正在评估PET/CT对SRT的影响。Wisconsin大学正在对36例拟行手术或SRT的患者进行18F-DCFPyL PET/CT的前瞻性评估(NCT03232164)。葡萄牙Champalimaud基金会正在对拟行PSMA或11C-胆碱PET/CT的患者进行用SBRT技术规划SRT的可行性试验。加拿大阿尔伯塔癌症控制卫生服务中心正在对63例患者进行11C-胆碱PET/CT引导放疗的Ⅱ期试验,增加了前列腺病灶内的局部照射剂量。美国国家癌症研究所(National Cancer Institute, NCI)正在进行18F-DCFPyL PET/CT引导SBRT的根治性放疗后前列腺癌局部复发的前瞻性试验(NCT03253744)。
Ghent大学附属医院的寡转移前列腺癌采用积极监测对比转移灶导向治疗(surveillance or metastasis-directed therapy for oligometastatic prostate cancer recurrence, STOMP)研究中(NCT01558427),在寡复发转移的情况下,随机分组的患者使用11C-胆碱PET重新分级进行转移导向治疗,并与观察组进行对比。主要终点是开始雄激素去势治疗的时间。转移导向治疗可将雄激素去势治疗的无瘤生存期从13个月提高到21个月(风险比,0.60;P=0.11)[81]。
Emory大学的Akin-Akintayo等[82]正在进行1项前瞻性Ⅲ期试验,评估使用18F-fluciclovine PET/CT指导和改善SRT患者的预后(NCT01666808)。在这项试验中,162例前列腺根治性切除术后PSA水平增高、且目前一线影像学结果显示远处转移阴性的患者,被随机分为常规SRT(由当前一线影像学指导)和SRT组(由腹盆腔18F-fluciclovine PET/CT指导),主要终点是生化得到控制。尽管现在还没有癌症控制结果的数据,但研究人员已报道了18F-fluciclovine PET/CT对试验组患者计划的影响,以及PET/CT引导下的SRT与目前一线影像学引导的SRT的急性毒性反应的对比[82]。随机分配到PET/CT组的患者在先有PET信息后无PET信息的情况下制定治疗计划,41例中有31例(73%)(PSA中位数0.43 μg/L)靶区发生变化。尽管PET辅助治疗的剂量会大一些,但对风险较高的器官(直肠、肠管、膀胱)的剂量并没有显著差异。急性毒性在不同治疗组间也没有差异,表明PET引导的额外剂量可能不会增加长期毒性。需要进一步随访来评估18F-fluciclovine PET/CT对生化的控制及远期毒性的影响。
对于前列腺癌,传统影像学检查的灵敏度较差,往往会低估许多患者的疾病范围。使用11C或18F-胆碱、11C-乙酸盐、18F-fluciclovine、68Ga或18F-PSMA进行配体PET/CT检查可提高显像精度。在这些探针中,PSMA配体有最高的灵敏度和特异性。将PET/CT纳入当前的治疗实践中,预计会使相当一部分患者的疾病分级提高,并对当前的治疗模式产生显著影响。现代放疗计划可以立即整合这些PET显像结果。回顾性分析支持将PET/CT与放疗计划相结合将会为患者带来临床益处的假设,但仍需前瞻性试验结果来评估这种影响。






























