
作为功能影像,PET可从多角度挖掘肿瘤的生物特征,能够更加准确地检测前列腺癌。反式-1-氨基-3-18F-氟环丁烷-1-甲酸(18F-fluciclovine)是一种非天然氨基酸类PET显像剂,近期已被美国食品与药物管理局(FDA)批准用于检测可疑复发性前列腺癌。该显像剂可反映前列腺癌中因氨基酸代谢上升导致的跨膜氨基酸转运系统的高表达。该文对18F-fluciclovine PET显像对原发及复发性前列腺癌的诊断效能进行概述,包括综述已发表的和常规影像学检查以及其他分子显像剂的对比研究。另外,也详细描述了该方法的显像程序、图像解读,包括生理性和病理性摄取类型及诊断"陷阱"或误区。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
前列腺癌是男性最常见的恶性肿瘤,死亡率位列第三[1]。前列腺癌的常见转移部位为淋巴结和骨骼,其中盆腔淋巴结转移最为常见。然而,在10%~15%的患者中,骶前、主动脉旁、腔静脉旁淋巴结为最先转移的部位。血清前列腺特异抗原(prostate-specific antigen, PSA)水平、PSA倍增时间、PSA复发时间、Gleason评分、病理类型均是评估肿瘤局灶或远处复发的主要临床指标。
目前指南推荐:对于高危原发、复发或转移性前列腺癌患者,应使用99Tcm-亚甲基二膦酸盐(methylene diphosphonate, MDP)骨显像,并联合CT或MRI对肿瘤负荷进行评估。然而,上述影像学技术对小体积前列腺癌灶的灵敏度欠佳,可能会低估患者的肿瘤负荷。
18F-脱氧葡萄糖(fluorodeoxyglucose, FDG)在肿瘤显像中广泛应用,但由于未经激素治疗的前列腺癌细胞摄糖活性较低,18F-FDG在转移性前列腺癌检测的应用受限[2]。磷脂前体如11C-胆碱被广泛应用于检测局灶及转移性前列腺癌,现已被美国食品与药物管理局(Food and Drug Administration, FDA)批准用于生化复发前列腺癌的评估[3]。然而,在低血清PSA水平(<1.0 μg/L)的复发患者中,11C-胆碱PET使用受限;另外,炎性反应区域的摄取可能影响特异性。前列腺特异膜抗原(prostate-specific membrane antigen, PSMA)是一种前列腺癌细胞特异性表达的Ⅱ型跨膜糖蛋白,目前已研制出多种靶向PSMA的放射性显像剂并将其用于转移性前列腺癌的检测。
氨基酸是细胞代谢和生长所必需的,肿瘤细胞的营养需求远高于正常细胞[4]。多种氨基酸转运系统在前列腺癌中高表达,特别是大型中性氨基酸转运体(large neutral amino acid transporter, LAT;系统L: LAT1, LAT3和LAT4)和丙氨酸-丝氨酸-半胱氨酸(alanine-serine-cysteine, ASC)转运体(ASC transporters, ASCT;系统ASC: ASCT1和ASCT2)[5,6]。其中,LAT3、ASCT1和ASCT2受雄激素刺激后上调,LAT1和ASCT2与肿瘤高侵袭性有关[7]。反式-1-氨基-3-18F-氟环丁烷-1-甲酸(anti-1-amino-3-18F-flurocyclobutane-1-carboxylic acid, 18F-fluciclovine)是一种非天然氨基酸类PET显像剂,最先由Goodman团队合成,最早用于脑胶质瘤显像[8]。在体内,18F-fluciclovine进入细胞是由钠依赖性氨基酸转运体所介导的[主要为系统ASC(ASCT2),部分为系统L(LAT1)][5]。由于上述氨基酸转运系统同样参与18F-fluciclovine胞内到胞外的转运,造成该显像剂洗脱较快,因此推荐早期进行PET显像[9]。此外,虽然18F-fluciclovine在炎性反应中的摄取少于18F-FDG,但仍有可能造成假阳性。
早期的生物分布研究显示18F-fluciclovine经尿排泄相对较少,膀胱吸收剂量为12~25 μGy/MBq[10],远低于18F-FDG[(73±42) μGy/MBq][11]和O-(2-18F-氟乙基)-L-酪氨酸[O-(2-18F-fluroethyl)-L-tyrosine]的对应剂量(60 μGy/MBq)[12]。由于泌尿系统的放射性分布较少,该显像剂的研究热点逐渐从脑胶质瘤转为肾脏和盆腔肿瘤。一项研究发现1例肾细胞癌患者的腹膜后淋巴结高摄取18F-fluciclovine,经活组织检查(简称活检)证实此腹膜后淋巴结为前列腺癌的转移灶[9]。后续开展的研究发现,18F-fluciclovine不仅在原发和转移性前列腺癌病灶中表现为高摄取,在前列腺床、淋巴结和骨等复发灶中同样表现为高摄取[13]。
基于877例受试者的研究结果(包括美国和欧洲的797例前列腺癌患者),FDA于2015年12月对18F-fluciclovine进行了优先审查,并于2016年5月批准该显像剂(商品名Axumin;制造商Blue Earth Diagnostics,Inc.)用于血清PSA水平升高的复发性前列腺癌患者的评估;于2017年1月将该显像剂纳入医疗保险报销范围。18F-fluciclovine在其他恶性肿瘤如乳腺癌[14]、胶质瘤[15]中也有临床研究,本文在此不进行详述。
1.原发性疾病的诊断和分期。多项针对原发性前列腺癌的18F-fluciclovine PET显像研究发现,仅18F-fluciclovine PET检查不能用于原发性前列腺癌的检测。FDA也并未批准该显像剂用于原发性前列腺癌的诊断。在一项多中心临床试验中,研究者对68例拟行根治性前列腺切除术或雄激素去势治疗的原发性前列腺癌患者行18F-fluciclovine PET/CT显像,结果发现18F-fluciclovine诊断原发灶的灵敏度和特异性分别高达92.5%和90.1%[16]。然而,其他几项研究结果显示该显像剂的前列腺特异性摄取较低。另一项纳入10例拟行根治性前列腺切除术患者的研究结果显示,结合全身显像及动态盆腔显像,18F-fluciclovine的诊断灵敏度和特异性分别为81.3%和50.0%[17]。尽管前列腺癌病灶的最大标准摄取值(maximum standardized uptake value, SUVmax)较高,但前列腺癌和良性组织的摄取值仍存在部分重叠。一项纳入22例原发性前列腺癌患者的研究显示,肿瘤的平均SUVmax显著高于正常前列腺组织,但是前列腺癌和良性前列腺增生的平均SUVmax存在重叠,分别为4.5±0.5和4.3±0.6;该研究还进行了18F-fluciclovine PET/CT与多参数MRI的对比,结果显示2种检查结合后诊断的阳性预测值(positive predictive value, PPV)为82% (单独18F-fluciclovine PET/CT及MRI分别为50%及76%)[18]。另一项纳入26例原发性前列腺癌患者的研究报道了相似的结果[19]。该研究中,患者分别行18F-fluciclovine PET/CT及PET/MRI检查,结果显示18F-fluciclovine对于原发性肿瘤诊断灵敏度高,特异性低;另外,18F-fluciclovine PET的诊断效能并未显著优于单独MRI。Elschot等[20]对延迟显像的应用价值进行了探究,发现延迟显像(18~23 min和33~38 min)可用于鉴别前列腺癌和良性前列腺病变。
18F-fluciclovine PET用于原发性前列腺癌分期的文献报道较少。一项研究纳入了68例原发性前列腺癌患者,将18F-fluciclovine PET/CT和全身增强CT显像进行对比,结果显示对于前列腺外短径超过1 cm的淋巴结,18F-fluciclovine PET/CT的灵敏度、特异性、准确性分别为64.5%,99.6%和95.5%,增强CT分别为71%,100%和96.6%[16]。尽管未经病理结果证实,18F-fluciclovine PET检查在13例CT阴性的患者中发现了5~9 mm大小的放射性摄取增高淋巴结。近期一项纳入28例高危前列腺癌患者的研究发现,术前18F-fluciclovine PET/MRI诊断局部淋巴结转移的特异性高(100%),灵敏度低(30%)[21]。因此,上述研究表明,对于原发性前列腺癌,18F-fluciclovine PET不能替代淋巴结的组织病理学诊断,但对指导活检具有意义。
2.复发性疾病。美国泌尿外科学会将根治性前列腺切除术后连续2次血清PSA水平≥ 0.2 μg/L定义为生化复发[22]。美国放疗和肿瘤学会将放射治疗后连续3次血清PSA水平较最低值升高定义为生化复发(此标准仅针对外照射)。一个共识委员会提出了新的定义,即Phoenix诊断标准:无论何种放射治疗类型,PSA水平较最低值升高且≥2 μg/L即可诊断为前列腺癌生化复发[23]。
复发性前列腺癌治疗方案的决定性因素为病灶范围是否局限于前列腺床。例如,若患者存在盆腔转移灶,则需扩大放射治疗靶区以覆盖盆腔转移灶;若患者存在盆腔以外的转移灶,则需从挽救性治疗方案更改为系统性雄激素去势治疗方案。18F-fluciclovine PET对根治性前列腺切除术后疾病复发的检测灵敏度随血清PSA水平的升高而提高。一项研究表明,血清PSA水平为0~1 μg/L时,18F-fluciclovine PET/CT检测病灶的灵敏度为72.0%;1~2 μg/L时为83.3%;>2 μg/L为95%[24]。一项根治性前列腺切除术后患者与非手术患者的混合队列研究结果显示,血清PSA水平为0~1 μg/L时,18F-fluciclovine PET/CT的检测灵敏度为37.5%;1~2 μg/L时为77.8%;>2 μg/L时为91.7%;而>5 μg/L时为83.3%[25]。另外有研究显示18F-fluciclovine对于血清PSA<1.0 μg/L的患者的病灶检出率仅为21%~38.7%[26,27]。对低血清PSA水平患者的病灶检出率在不同研究间存在差异,这可能与PSA代谢动力学有关:例如,初始Gleason评分较高和PSA倍增时间较短与18F-fluciclovine PET/CT阳性结果相关。一项研究显示18F-fluciclovine PET显像阳性的患者平均PSA倍增时间为(3.25±2.09)个月,显像阴性的患者为(31.2±22.02)个月[28]。
对于原位复发的前列腺癌,18F-fluciclovine PET/CT显像的灵敏度高,特异性低,PPV中等(图1)。一项纳入93例患者的研究结果显示18F-fluciclovine PET/CT的总体灵敏度、特异性、PPV和准确性分别为90.2%、40.0%、75.3%和73.6%[29],但该研究中的患者接受冷冻治疗或近距离放射治疗的比例相对高,治疗后炎性反应或前列腺增生可能导致显像出现假阳性,造成结果存在一定误差。针对根治性前列腺切除术后复发的前列腺癌患者的队列研究仍在进行中。一项纳入596例患者的大型多中心临床研究显示18F-fluciclovine PET/CT显像对前列腺癌局部复发的诊断效能与前述研究类似,灵敏度为88.1%,特异性为32.6%,PPV为71.8%[27]。因此,与原发性前列腺癌相同,对于原位复发的前列腺癌,18F-fluciclovine PET显像不能取代组织病理学诊断。
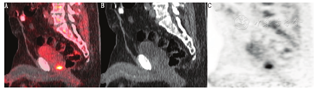

对于前列腺外复发病灶的检测,一项研究报道18F-fluciclovine PET显像的诊断灵敏度、特异性、PPV和准确性分别为55.0%、96.7%、95.7%和72.9%(未考虑PSA水平或倍增时间)[29]。一项纳入596例患者的大型多中心临床研究同样得出较高水平的PPV,为92.3%[27]。一项纳入53例患者的研究将18F-fluciclovine PET/CT和单纯CT进行了比较,结果显示18F-fluciclovine PET/CT检出前列腺外复发患者的真阳性率为29%,而CT仅为7%;另外,18F-fluciclovine PET/CT检出转移淋巴结的最小短径为0.4 cm,CT为0.9 cm[25]。综上,18F-fluciclovine PET/CT对前列腺外复发病灶的检出效能明显优于CT (图2)。另有研究表明,同一患者多次18F-fluciclovine PET/CT显像本底平均标准摄取值(mean standardized uptake value, SUVmean)差异小于20%,未经治疗的肿瘤病灶摄取随时间推移增高或保持稳定,复测重复性较好,因此可应用18F-fluciclovine PET检查对患者随访,进行疾病评估[30]。
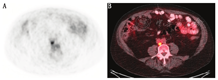

3.骨转移。18F-fluciclovine在溶骨性和成骨性转移灶中均有摄取[31],可早期发现形态结构尚正常的病变。溶骨性转移灶通常表现为高摄取,混合性转移灶表现为中度摄取,而成骨性转移灶表现为轻度或无摄取(图3)。对于成骨性转移灶,推荐应用骨显像弥补18F-fluciclovine检查的不足。


目前为数不多的研究显示,18F-fluciclovine PET/CT对骨转移的诊断效能与骨显像相似或更高。一项纳入10例未经治疗的前列腺癌患者的临床ⅡA期试验结果显示,7例患者的骨转移灶表现为18F-fluciclovine摄取增加,与常规骨显像结果相似[32]。一项纳入68例患者的研究表明,18F-fluciclovine PET/CT与骨显像+增强CT对骨转移灶的诊断一致率为83.3%,7例患者的骨转移灶仅被18F-fluciclovine PET/CT发现[16]。初步研究结果表明:若18F-fluciclovine PET/CT显像发现了明确的骨转移灶,那么患者可能不需要再次行骨显像检查。但由于目前大多数临床试验仍将骨显像作为诊断骨转移的标准,因此尚不建议使用18F-fluciclovine PET/CT显像替代骨显像。
4.与其他分子显像剂比较。部分研究比较了18F-fluciclovine与其他分子显像探针的区别。PSMA是前列腺癌细胞特异性高表达的跨膜糖蛋白,仅5%~10%的原发性前列腺癌病灶无PSMA表达[33]。放射性标记的抗PSMA抗体——卡罗单克隆抗体(简称单抗)喷地肽(capromab pendetide;商品名ProstaScint,制造商EUSA Pharma)是目前唯一被FDA批准的靶向PSMA的显像剂。然而其靶向PSMA的胞内段,因此只能被凋亡或坏死的细胞摄取,而无法被活肿瘤细胞摄取,诊断能力有限。18F-fluciclovine对前列腺癌原位或前列腺外复发的诊断效能高于111In-喷地肽[29]。
18F-fluciclovine对生化复发前列腺癌的诊断效能高于11C-胆碱。一项纳入89例根治性前列腺切除术后生化复发患者的研究发现,18F-fluciclovine PET/CT对淋巴结转移灶检测的灵敏度、特异性和准确性分别为37%、67%和38%,11C-胆碱PET/CT则分别为32%、40%和32%;这89例患者中,有10例患者存在骨转移(经临床随访确定), 18F-fluciclovine PET/CT检测出5例骨转移患者,另有5例为假阴性,11C-胆碱PET/CT检测出6例患者(其中1例为假阳性),另有5例为假阴性[26,34,35]。总之,在基于患者和基于病灶的分析对比中,18F-fluciclovine PET/CT诊断生化复发前列腺癌的PPV均高于11C-胆碱PET/CT。尽管尚无研究直接比较二者对原发性前列腺癌的诊断价值,但有研究报道11C-胆碱对前列腺内病灶定位的准确性欠佳[36,37]。
近来有一些结合PSMA胞内段活性部位的小分子PSMA显像剂被探讨。一项纳入10例复发性前列腺癌患者的研究比较了18F-fluciclovine和68Ga-PSMA-11 PET/CT的显像结果[38]。与其他研究结果相似,68Ga-PSMA-11 PET/CT对病灶的检出率更高,病灶对显像剂的摄取也较其他显像剂(如11C-胆碱)摄取更显著[39]。另有一篇病例报道比较了1例复发性前列腺癌患者的18F-fluciclovine PET和2-(3-(1-羧基-5-[(6-[18F]氟-吡啶-3-羰基)-氨基]-戊基)-脲基)戊二酸{2-(3-(1-carboxy-5-[(6-[18F]fluoro-pyridine-3-carbonyl)-amino]-pentyl)-ureido)-pentanedioic acid,18F-DCFPyL} PET的显像结果[40],该文描述病灶对18F-DCFPyL的摄取更高,18F-DCFPyL显像的不足在于泌尿系统的生理性分布较多,这可能影响对盆腔病灶的检出。尽管上述2篇论文均总结需要更多病例数据来进一步比较研究每种方法的优缺点,但初步结果表明,对于血清PSA水平较低的复发性前列腺癌,较新的PSMA显像剂检测效果似乎优于18F-fluciclovine。
血清PSA水平、PSA倍增时间、Gleason评分和影像学检查结果等均为患者是否行挽救性放疗的决定因素[41]。不符合指征却行挽救性放疗是造成患者生化复发的原因之一。因此,精准的影像学检查对治疗方案的制定至关重要。目前,前列腺癌患者治疗方案的制定主要依赖于传统影像学技术,其在检测前列腺癌早期复发方面具有一定的局限性。一项研究纳入了42例根治性前列腺切除术后患者,对这些患者已根据传统影像学技术制定了后续放疗方案;行18F-fluciclovine PET/CT显像后,有40.5%的患者改变了放疗方案[24],但作者指出,PET/CT显像对于是否真正行放射治疗的决定并未有统计学意义的影响,因为42例中仅有2例因发现骨盆外转移灶而取消放射治疗;此外,在针对该试验的另一分析显示,18F-fluciclovine PET改变了83%的患者的放疗靶区,但放疗后毒性无明显改变[42,43]。在指导治疗决策方面,18F-fluciclovine与其他显像剂的研究结果相似,如13%~33%的患者行11C-胆碱PET后也改变了其放疗方案[44,45]。
患者在检查前禁食4 h以保持血氨基酸水平的稳定,期间可少量饮水。目前尚无相关临床试验研究非严格禁食对18F-fluciclovine生物分布的影响。检查前不宜剧烈运动,避免肌肉的放射性摄取增加。
胃肠道对比剂有利于病灶显示。在扫描前约30 min口服胃肠道对比剂之前,嘱患者排空膀胱,然后鼓励患者不要排尿,因为这样可以稀释18F-fluciclovine浓度,有利于显示膀胱本身的高摄取病灶。
研究者曾提出几种18F-fluciclovine PET检测复发前列腺癌的显像流程,其中包括早期显像和延迟显像[29,46]。通过比较,早期单时间点(注射后3~5 min)进行图像采集是目前推荐的更为实用的显像流程[26]。不同设备应用的显像流程存在差异[47],笔者所在研究中心的时间飞行(time-of-flight, TOF)-PET设备的显像流程如图4。首先进行CT定位和采集,采集体位为仰卧位,手臂抬高置于头顶,采集范围及方向为从颅底至股骨。CT扫描结束之后,不改变患者体位,放下一侧手臂进行注射。与18F-FDG等其他显像剂不同,18F-fluciclovine PET无需进行延迟显像,药物注射剂量为370 MBq(10 mCi),于患者床旁行"弹丸式"静脉注射。将患者注射侧手臂抬高置于头顶,于药物注射后3~5 min(靶扫描野为4 min)开始从股骨至颅底方向进行PET采集,每个床位采集时间为3.5 min(图4),药物注射后25 min即可覆盖采集视野。怀疑前列腺癌复发时,18F-fluciclovine PET的图像采集方向尤为重要,因为18F-fluciclovine的药代动力学相对较快,靶本比在药物注射后约20~30 min时最佳(存在个别组织的摄取时间更长的情况)。如果PET图像采集过早进行(<3 min),18F-fluciclovine的生物分布可能会随着血池的增加发生变化。


18F-fluciclovine PET/CT图像解读时需要考虑18F-fluciclovine的生理性摄取和前列腺癌复发(前列腺切除床和盆腔深部淋巴结,以及腹股沟周围或远处髂外区域淋巴结)的典型摄取表现,尽管远处转移也可见(图5)。


18F-fluciclovine PET/CT图像中,胰腺和肝脏可见明显生理性摄取,垂体、唾液腺、咽淋巴环、甲状腺、乳腺实质、食管、胃肠道、肾实质和肾上腺(单侧或双侧)可见不同程度的生理性摄取。肾肿物呈18F-fluciclovine高摄取则提示恶性。肾乳头状癌较正常肾实质摄取高,肾透明细胞癌与正常肾实质摄取相近[9]。膀胱壁呈轻至中度弥漫性生理性摄取;尿道周围组织呈轻至中度平行于尿道的片状放射性分布,可在矢状位图像上与前列腺床原位复发的局灶性摄取相鉴别(图1)。患者膀胱内尿液的放射性本底可能会干扰前列腺术区、前列腺和精囊内病灶的检出。对输尿管内的显像剂滞留不要误判为高摄取淋巴结。肾上腺可表现为单侧或者双侧轻至中度生理性摄取。注射侧的手臂或者锁骨下静脉有时会有放射性药物聚集,需要与高摄取淋巴结鉴别。
前列腺的一些良性疾病,例如前列腺增生、非细菌性前列腺急性和慢性炎性反应(包括放疗后炎性反应)、细菌性前列腺炎,均对18F-fluciclovine有不同程度的摄取,从而导致假阳性结果[48]。有研究发现血管移植物周围可有高摄取的反应性淋巴结增生。皮肤和骨骼肌的炎性反应亦可引起不同程度的显像剂摄取。
定义显像剂摄取阳性的常规标准是摄取程度明显高于骨髓(常选L3椎体作为参照)、直径大于1 cm。对于软组织病变或直径小于1 cm的淋巴结,如果显像剂摄取在视觉上等于或者接近骨髓并且明显高于血池(可选腹主动脉作为参照),因为部分容积效应的原因,仍可视为阳性。
对于前列腺切除术后的患者,若前列腺术区或精囊腺内出现放射性摄取程度高于骨髓的病灶,则提示前列腺癌复发。对于选择放疗、局灶高强度超声治疗或冷冻治疗而未行手术的患者,如果前列腺的显像剂摄取呈现不对称、局灶性放射性分布,且摄取水平等于或者高于骨髓,则提示前列腺癌复发;如果前列腺的显像剂摄取呈现对称、均匀、弥漫性放射性分布,且摄取水平明显高于骨髓,则提示前列腺癌复发。前列腺呈现不均匀放射性分布,应视为多个局灶性摄取增高。已有研究提示前列腺中叶显像剂摄取产生假阳性的可能性更大。
对于放射性摄取增高(高于骨髓)的淋巴结,若其按照前列腺癌的典型转移方式分布,则提示为恶性;若分布与典型转移方式不符(如腹股沟区或髂外动脉远端),只有在其出现不对称、明显增高的放射性摄取或存在疾病其他复发征象时才提示恶性。对于对称且放射性摄取轻度增高的淋巴结,考虑为生理性摄取。
与18F-FDG PET相比,18F-fluciclovinePET上骨髓呈不均匀的放射性分布更常见。最大密度投影图像上骨内局灶放射性分布浓聚提示恶性可能。溶骨性转移瘤通常表现为高摄取,混合性转移灶表现为中度摄取,成骨性转移灶表现为轻度或无摄取。仅在CT图像上可见的可疑骨病变(如无显像剂摄取的骨质硬化)应视为非特异性病变,无法排除骨转移可能。CT示骨质改变而18F-fluciclovine无摄取的病变,可进一步行MRI、18F-NaF PET/CT或99Tcm-MDP SPECT/CT等其他影像学检查。与18F-FDG PET相比,退变的间盘和关节面摄取显像剂的现象在18F-fluciclovine PET上更少见到。有报道恶性骨转移瘤被误认为边界不规则的Schmorl结节。良性和恶性骨病变(例如骨样骨瘤和多发性骨髓瘤)均可有显像剂摄取[48]。最后,对于骨盆单发的呈非局灶性或非肿块样的18F-fluciclovine高摄取、且对应CT图像未见异常且定期复查未见变化的病例,在笔者的工作中很少遇到,因此这样的病例建议进一步行MR检查或活检(图6)。


FDA已批准18F-fluciclovine用于血清PSA水平升高的复发性前列腺癌患者的评估。大量的临床研究证实,18F-fluciclovine对前列腺癌可疑复发病灶的检出能力强。与传统影像学技术相比,应用18F-fluciclovine PET/CT进行临床分期更加准确。正确解读18F-fluciclovine PET/CT图像,不仅需要熟悉18F-fluciclovine的正常生理性摄取和变异,也需要掌握前列腺癌转移的典型模式。18F-fluciclovine与PSMA 2种显像剂在前列腺癌成像方面作用的比较,以及骨病变和其他恶性病变对18F-fluciclovine摄取的具体表现,都需要进一步的研究来阐明。



























