
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
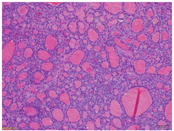
患者女,68岁,因"体格检查发现右心室肿物1个月"入院。患者1个月前体格检查时超声心动图提示:右心室腔内大小约26 mm×26 mm等回声团块,附着于右心室体部,致右心室流出道梗阻。患者诉平日胸闷憋气症状不明显。入院体格检查:体温36.1 ℃,心率:75次/min,呼吸:18次/min,血压:127/75 mmHg(1 mmHg=0.133 kPa)。实验室检查:血常规、肝肾功能、肿瘤标志物[包括癌胚抗原、甲胎蛋白、糖类抗原(carbohydrate antigen, CA)125、CA19-9、CA72-4、细胞角蛋白19片段抗原、神经元特异性烯醇化酶、鳞状细胞癌相关抗原、人绒毛膜促性腺激素、降钙素]均在正常范围。心电图示:窦性心律,完全性右束支阻滞,心电图不正常T波。胸部平扫CT示右心室内团块状高密度,平扫CT值50.4 HU(心腔内血池平扫CT值25.3 HU)。为了解病变代谢情况、明确病变良恶性及病变与周围结构毗邻关系,行心脏18F-脱氧葡萄糖(fluorodeoxyglucose, FDG;本科室加速器生产) PET/MR(德国Siemens Biograph mMR)检查。患者禁食16 h,测空腹血糖为4.5 mmol/L,静脉注射18F-FDG 310.8 MBq后40 min行心脏PET/MR显像:同步行PET及人体轴位MR采集[PET采用列表(list)模式,人体横轴位MR包括T1加权( weighted, T1W)及T2W序列采集],再行心脏轴位(心脏短轴及2、3、4腔心脏长轴)MR采集,包括电影序列、T2黑血序列、首次血流灌注动态成像及延迟增强序列。心脏电影成像示右心室心腔内大小约30 mm×23 mm结节状充盈缺损,病变附着于室间隔,随心肌舒缩而同步运动。T2黑血序列示病变呈稍长T2信号,信号稍欠均匀(图1A),首次血流灌注动态成像示病变高灌注(图1B,图1C),病变延迟强化(图1D)。18F-FDG显像示心肌代谢抑制良好,右心室心腔内病变轻微代谢,同心腔内血池(图2)。PET/MR结果示右心室心腔内病变为良性可能性大。后患者行右心室肿物切除、三尖瓣成形术。术中探查发现肿瘤瘤体附着于右心室游离壁及室间隔,瘤体完整有包膜,予以切除。术后病理示(右心室肿物)心肌间可见甲状腺滤泡性肿瘤结节,结合形态及免疫组织化学结果,首先考虑甲状腺滤泡癌转移,建议结合甲状腺部位检查情况,并除外其他少见情况(如甲状腺组织异位等;图3)。免疫组织化学结果:细胞角蛋白(cytokeratin, CK;+),CK19(少数+),细胞增殖核抗原Ki-67(+1%),甲状腺转录因子-1(thyroid transcription factor-1, TTF-1;+),成对框基因8编码的转录因子(paired box gene 8, PAX-8; +),甲状腺球蛋白(thyroglobulin, Tg; +)。患者后又行超声检查,结果示甲状腺超声未见明显异常。心外科与病理科再次会诊后,考虑为右心室异位甲状腺。
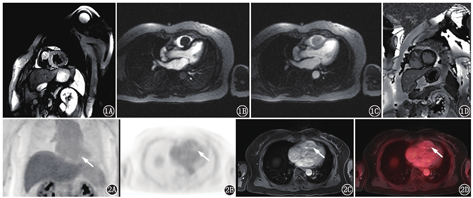


心脏肿瘤少见,可分为原发性和继发性2种,后者的发病率是前者的20~40倍[1]。MR在心脏肿瘤的诊断中发挥了重要作用[1,2,3]。MR可准确、全面、清楚地显示心脏肿瘤的部位、大小、形态、与周围结构的关系等,且特定的组织信号特征定性诊断脂肪瘤及纤维瘤的准确性非常高,但该方法对于大多数心脏肿瘤的良恶性鉴别主要根据病变的生长方式、血供特点等,缺乏特异性[2]。18F-FDG PET反映病变的糖代谢,有助于心脏肿瘤的良恶性鉴别。一体化PET/MR融合了PET与MR技术,能提供一站式解剖结构及代谢信息,对于心脏肿瘤的良恶性鉴别及治疗方案的制定具有重要意义[4]。本例为甲状腺异位于右心室患者,18F-FDG PET/MR在其诊断中发挥了重要作用。MR清晰显示病变位于右心室,高灌注提示富血供病变,并有延迟强化,提示其为肿瘤性病变而非血栓;病变局限于右心室,形态较规则,体积较小,未呈浸润性生长,且核磁信号相对均匀,提示为良性病变。而18F-FDG PET显示病变轻微代谢,最大标准摄取值(maximam standardized uptake value, SUVmax)为1.5,与血池及心室壁心肌相仿(心肌SUVmax为1.6),进一步验证了其为良性肿瘤性病变。
心脏的良性肿瘤以黏液瘤最多见(但黏液瘤常发生于心房,心室极为少见),其次为纤维瘤、血管瘤和脂肪瘤等。纤维瘤好发于儿童及青少年,可在心肌内及腔内生长。由于富含成纤维细胞及胶原纤维,瘤体常信号均匀,T1W呈等或低信号,T2W呈低或无信号,这与其他心脏肿瘤相比具有特征性,与本例表现不符。脂肪瘤在T1W和T2W均为高信号,压脂后信号明显,CT为脂肪低密度,与本例表现不符,可以排除。血管瘤在T2W多为高信号,动脉早期多为周边结节样强化,延迟呈渐近性强化,与本例T2W呈稍高信号、早期异常高灌注且强化较均匀不符。本例18F-FDG PET/MR报告结果中仅给出心脏良性肿瘤的诊断意见,未给出具体的病理类型,也是考虑了上述原因。后经手术病理证实此例为右心室异位甲状腺。首次病理诊断根据形态学及免疫组织化学首先考虑为滤泡性甲状腺癌转移,但并不能除外异位甲状腺,这是因为转移区域的滤泡性甲状腺癌较原发部位呈现好的组织分化,与异位甲状腺组织很难鉴别,此时需要结合形态学、影像学及临床进行综合分析[5]。本例患者甲状腺超声未见明确肿瘤病灶,经综合考虑右心室内病变为异位甲状腺组织。
心脏内异位甲状腺非常罕见,文献多为个案报道[6,7,8,9,10]。异位甲状腺可分为2型:Ⅰ型,颈部正常部位无甲状腺组织者称为迷走甲状腺;Ⅱ型,除异位甲状腺外,颈部正常部位同时存在甲状腺组织,则称为副甲状腺。本例患者属于Ⅱ型。异位甲状腺可出现于颈部到膈肌的任何部位,最常见于舌根部,心脏内出现异位甲状腺非常罕见。Casanova等[11]分析了文献报道的20例心脏内异位甲状腺患者,多为成年女性患者(17/20),而且绝大多数(19/20)病灶位于右心室,病变多起源于室间隔,突向右心室流出道。心脏内异位甲状腺多位于右心室,这与甲状腺的胚胎发育有关。胚胎期的第3~6周,管状的内胚层甲状腺原基的头端紧邻将发育成舌和下面部的胚胎组织,尾侧紧邻将发育成右心室流出道的胚胎组织。当甲状腺原基与头尾侧邻近的胚胎组织不能正常分离,会导致甲状腺岛留在这些胚胎组织中而发育成异位甲位腺[7]。位于右心室的异位甲状腺可以导致右心室流出道梗阻和室性心律失常,并且有癌变的可能,因此手术完整切除是唯一有效的治疗方法。文献报道的心脏异位甲状腺多描述其心脏超声的影像特点[6,7,8,9,10]。本个案报道了心脏异位甲状腺的PET/MR影像特征,其典型影像特点包括:(1)病变位于右心室,形态较规则,边界清晰,附着于右心室间隔壁;(2) MR显示病变早期灌注呈富血供,FDG仅轻微代谢,而且胸部CT显示病变呈稍高密度,这些影像表现与正常甲状腺相似。
总之,18F-FDG PET/MR有助于心脏肿瘤的良恶性鉴别,心脏异位甲状腺具有较独特的PET/MR影像特点,但最终确诊必须依靠病理学检查。
所有作者均声明不存在利益冲突


























