
利用放射源将具有细胞毒性的电离辐射作用到病灶处的方法可以追溯到20世纪初,起源于镭的发现及其能够产生的生理作用。α核素在放射治疗应用于临床肿瘤学领域中备受关注。该综述的第一部分探讨了基本的放射化学、高细胞杀伤效力和α核素的可应用性,以及存在于放射性标记方法和子核再分布的阻碍。该综述的第二部分将概述α核素在临床前和临床研究中最有希望和最新的用途。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
α核素的短射程和高传能线密度是对具有长射程和低传能线密度β核素的补充。这些物理特性允许α核素将大部分能量沉积在所需靶向肿瘤细胞周围的区域(<100 μm),使它们能够杀死孤立的肿瘤细胞。因此,α核素对于治疗诸如白血病或淋巴瘤等全身性疾病,以及小簇状或孤立的肿瘤细胞等播散性疾病特别敏感。过去几年,也有α核素用于治疗原发性和转移性实体瘤的临床前或临床应用,如胶质母细胞瘤或去势抵抗性前列腺癌(castration-resistant prostate cancer, CRPC)[1,2]。目前有6个α核素正在进行临床前或临床研究,使用其内在靶向性或靶向α治疗(targeted α-therapy, TAT)策略。抗体、肽和小分子已经成功地与α核素结合;然而,只有很少一部分α结合物进入到临床评估。
临床前研究对于α核素治疗的成功及临床转化起着重要的作用(图1)。以下介绍了一系列(发表于过去10年间)具有强大转化价值的临床前研究。
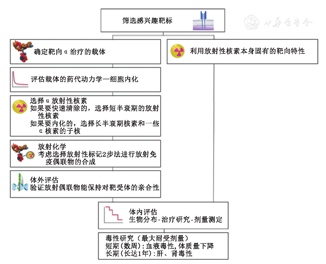

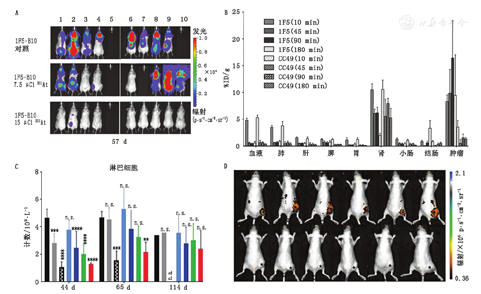
1.系统性癌:淋巴瘤和白血病。众所周知,CD20是治疗B细胞淋巴瘤的靶点。尽管具有中等长度半衰期,211At已与抗CD20单克隆抗体(简称单抗)螯合,并在2种淋巴瘤模型(皮下肿瘤异种移植和血行播散模型)中进行评估[3]。高剂量(1.78 MBq)的211At-抗CD20放射免疫疗法在皮下异种移植模型中显示出中度的肿瘤生长抑制效果。相比之下,0.55 MBq的总剂量可在70%弥漫性淋巴瘤模型动物中彻底根除疾病(图2A)[3]。注射0.55 MBq总剂量后,在5 d内观察到了普遍的致死性毒性,并有严重的体质量下降及皮肤瘀点。该研究着重指出α核素治疗的疗效因肿瘤细胞的可及性而异。

寿命较长的α核素227Th最初与抗体[如曲妥珠单抗和抗CD20单抗(利妥昔单抗)]结合,在乳腺癌、卵巢癌和淋巴瘤模型中,可明显抑制肿瘤生长以及延长个体存活时间[4,5]。用人淋巴瘤Raji细胞异种移植小鼠模型评估其长期毒性(≤1年),按体质量注射1 000 kBq/kg剂量的227Th-利妥昔单抗可导致体质量显著下降、白细胞和血小板计数暂时性下降,最大耐受剂量(maximum tolerated dose, MTD)在600~1 000 kBq/kg,骨髓的最大吸收剂量为2.1~3.5 Gy[6]。
有研究使用预靶向方法来降低α核素治疗的非特异性毒性和血液毒性。Park等[7]报道了使用抗CD20单链可变区链霉亲和素构建体和213Bi-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid, DOTA)-生物素的预靶向α放射免疫疗法来治疗非霍奇金淋巴瘤,使用预靶向方法得到了较好的体内生物分布,在注射后90 min,肿瘤的特异性摄取为(16.5±7.0)每克组织百分注射剂量率(percentage activity of injection dose per gram of tissue, %ID/g)(图2B);注射总剂量高达29.6 MBq的213Bi-DOTA-生物素显示出剂量依赖性的肿瘤反应;使用最高剂量后,10只小鼠中有3只达到完全缓解,只有1只显示出早期毒性的迹象,体质量约下降了10%;接受总剂量为22.2 MBq的213Bi-DOTA-生物素的治疗组小鼠,其中位存活期为90 d,而对照组小鼠为19 d。
抗CD33抗体林妥珠单抗(HuM195)长期被用于治疗急性髓性白血病,其临床应用将在本综述的后面提及。临床前研究中,HuM195最初被用于和213Bi和225Ac螯合,最近被用于和227Th螯合[8]。研究显示,700 kBq/kg剂量的227Th可使急性髓性白血病异种移植模型获得长达20 d的完全缓解[8]。
2.转移性前列腺癌。前列腺特异膜抗原(prostate specific membrane antigen, PSMA)的外部结构域是α核素靶向治疗的主要靶点之一。McDevitt等[9]成功地将213Bi偶合到抗PSMA单抗J591上,并证明所开发的α-放射免疫疗法能够提高人前列腺癌LNCaP细胞异种移植小鼠(肌肉注射)的中位无瘤生存期,同时降低前列腺特异抗原(prostate specific antigen, PSA)水平。在过去的10年中,还发现了许多用于诊断和治疗前列腺癌的小分子PSMA抑制剂。225Ac结合物将稍后在本综述的临床部分进行叙述。最近在PSMA阳性小鼠模型中评估了211At标记的小分子PSMA抑制剂螯合物,显示其可显著地抑制肿瘤生长和提高存活率;肾脏的长期毒性(≤12个月)决定了其剂量限值,免疫活性CD1小鼠的MTD设定为37 kBq[10]。
223Ra是一种特别有趣的放射性核素,因为它具有骨吸附特性,其抗肿瘤作用在动物模型中得到证实[11]。223Ra在临床前和临床研究中得到了广泛的验证,促使了该放射性同位素的商业化以及在转移性前列腺癌患者中的应用。因此,在以下临床部分中将重点关注使用该α核素进行的临床研究。
3.播散性腹膜疾病。212Pb(β核素)是224Ra的衰变子核及212Bi(α核素)的母核,被广泛用作α粒子纳米发生器。212Pb结合曲妥珠单抗治疗人表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)阳性的播散性腹膜疾病时,其价值首先在临床前研究中得到验证;其临床应用将在下一部分中讨论[12]。将212Pb分别标记可内化的以HER-2为靶点的曲妥珠单抗与非内化的以癌胚抗原为靶点的35A7抗体,并将同等剂量的放射免疫活性螯合物注入同时表达HER-2(低水平)和癌胚抗原(高水平)的人表皮癌A-431细胞腹膜内异种移植小鼠模型,以研究抗体内化对疗效的影响。吸收剂量计算结果显示非内化抗体212Pb-35A7(35.5 Gy)导致的肿瘤吸收剂量高于可内化的212Pb-曲妥珠单抗(27.6 Gy);然而意外的是,曲妥珠单抗螯合物治疗小鼠的平均存活时间更长(>130 d)[13]。该研究证实了内化抗体治疗小体积异种移植肿瘤的优势,但也强调了微剂量学研究的必要性。随着针对播散性腹膜疾病212Pb α核素疗法的建立,Milenic等[14]开发了靶向HER-1的α治疗方案,为减瘤术后的残留肿瘤组织、微转移或播散性腹膜疾病提供了一种可选择的或进行联合应用的治疗方案;西妥昔单抗用212Pb进行放射性标记,小鼠对其370~740 MBq的总剂量耐受良好,且毒性最小。
4.新靶标:肿瘤微环境。CD70属于肿瘤坏死因子超家族,与CD27L一起在T细胞信号传导中起重要作用。CD70在T细胞和B细胞淋巴瘤,以及几种类型的实体瘤(肾细胞癌,卵巢和胰腺癌,乳腺癌和结肠癌)上超表达。CD70是一个很有前景的免疫治疗靶点,Hagemann等[15]对其进行了227Th-TAT的研究,按体质量注射低至50 kBq/kg的剂量,人肾细胞癌789-O皮下异种移植物小鼠即可表现出完全的肿瘤抑制;与对照组相比,治疗组小鼠循环中性粒细胞、淋巴细胞和总白细胞减少,提示骨髓抑制(图2C),然而这种毒性是短暂的,小鼠在第114天完全恢复。
肿瘤微环境,如脉管系统和新生血管内皮,是α疗法的兴趣靶点。225Ac-E4G10抗体偶合物以单聚血管内皮钙粘蛋白为靶点,最近在一种高级别胶质母细胞瘤小鼠模型中显示出抑制肿瘤生长和提高存活率的作用[1]。机制性研究发现,内皮细胞和血管周细胞双耗竭可导致肿瘤血-脑屏障微环境的重构[16]。即使在治疗10 d以后,225Ac-E4G10滞留肝脏超过20 %ID/g,并未出现肝毒性[1]。
整合素在肿瘤血管生成中起重要作用,阻断整合素可抑制肿瘤生长或转移。其中,整合素αvβ3拮抗剂显示出治疗肿瘤的强大潜力。用225Ac放射性标记的DOTA-精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp, RGD)环肽[c(RGDyK)]螯合物显示出对整合素αvβ3的高亲和力[17]。注射总剂量1.9 MBq的放射性标记肽后,切伦科夫成像显示肿瘤、肝脏和肾脏摄取,体外成像证实了其生物分布(图2D)[17]。切伦科夫辐射可在多种医学同位素中观测到,包括225Ac[18]。由于α粒子是低速运动的,可以推测213Bi、209Tl和209Pb的β衰变导致了225Ac切伦科夫辐射。根据MTD (0.04 MBq),3种不同治疗剂量(1、0.5和0.25 MTD)的225Ac-DOTA-c(RGDyK)均导致了研究对象较高的血尿素氮潴留,提示肾脏受损[17]。
5.α与β研究。以下研究比较了α粒子疗法与β粒子疗法的疗效。在治疗乳腺癌肺转移的研究中,将225Ac标记的抗HER-2/neu单抗(7.16.4)的功效与213Bi和90Y的标记物进行比较(图3A),注射MTD导致中位生存期改善:90Y-7.16.4组为50 d,213Bi-7.16.4组为61 d;在总共12只小鼠中,8只在225Ac-7.16.4治疗后实现了长期存活(≤1年)[19]。α粒子治疗优于β粒子治疗的优势在于:α辐射能量沉积在肿瘤局部,而β辐射能量主要沉积在转移灶之外。由于抗体放射性螯合物的药代动力学作用,超过90%的213Bi螯合物衰变发生在达到靶点之前。225Ac的物理半衰期更长,每次衰变净产生4个α粒子,因此导致更高的吸收剂量,这解释了为什么用225Ac治疗的小鼠存活时间更长。但225Ac子核缓慢但显著的释放会导致长期肾毒性(图3B)[19]。
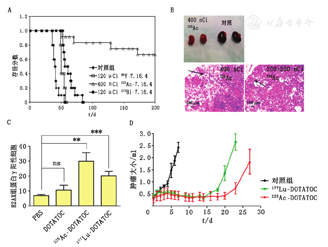

使用225Ac和177Lu放射性标记的生长抑素类似物DOTA-酪氨酸3-奥曲肽(DOTA-Tyr3-octreotide, DOTATOC)进行的肽受体放射性核素治疗也比较了α和β治疗的潜力[20]。通过细胞毒性评估,以确定相同毒性的α和β核素放射性药物的剂量。相同毒性下,177Lu标记的螯合物剂量大约是225Ac标记的螯合物剂量的700倍。通过定量测定H2AX组蛋白γ来评估DNA双链断裂的程度,接受总剂量48 kBq 225Ac-DOTATOC治疗的肿瘤其H2AX组蛋白γ阳性细胞的总体比例(35%)明显高于接受总剂量30 MBq 177Lu-DOTATOC治疗的肿瘤(21%;图3C),这一结果与肿瘤指数增长天数(225Ac-DOTATOC,25 d;177Lu-DOTATOC,21 d)一致(图3D)[20]。
α粒子具有很大的治疗潜力,因为与β粒子相比,其导致更高水平的DNA双链断裂。然而,由于α核素半衰期较长,且α核素后代大量增加肿瘤吸收剂量,α核素与β核素之间的比较性研究可能存在偏差。剂量的测定,对于α核素来说尽管具有挑战性,在此类比较研究中也应将其作为一个选择参数来决定给药剂量。此外,还应考虑肿瘤大小、缺氧或肿瘤内放射药物分布等参数。
在临床中,α和β治疗的选择取决于患者的肿瘤负荷和先前对β治疗的反应。目前仅在疾病晚期阶段提供α疗法,在疾病早期阶段,该疗法的疗效仍然未知[21]。因此,对于临床应用,关于α和β治疗疗效的比较目前是不成熟的。在早期疾病中需要进一步评估α疗法,但也需要结合目前的护理标准或新的治疗方法,如抑制DNA修复[聚(二磷酸腺苷-核糖)聚合酶抑制剂][21]。鉴于其粒子范围的互补性,还应评估α和β治疗的鸡尾酒方法。
62项使用α核素的临床试验已在clinicaltrials.gov上注册,其中52项是223Ra-二氯化物,利用的是223Ra的骨吸附特性(表1)。最后一节将重点介绍使用α放射核素进行的最值得关注的临床研究结果和进展。

α治疗临床前评估案例
α治疗临床前评估案例
| 放射性药物及剂量 | 靶点与研究对象 | 特征与结果 | 剂量限制性观察与毒性 | 文献 |
|---|---|---|---|---|
| 211At-ch81C6:71~347 MBq | 生腱蛋白:18例原发或转移性脑肿瘤患者 | Ⅰ期与Ⅱ期具备可行性、安全性、有效性:胶质母 细胞瘤患者总体生存时间为54.1与23周 | 没有观察到3级及更高级别毒性 | [40] |
| 211At-MX35 F(ab′)2:22.4~101 MBq/L | 钠依赖性磷酸盐转运蛋白2b:复发性二线化疗达到完全临床缓解的卵巢癌患者 | Ⅰ期药代动力学及剂量学:预计腹膜吸收剂量(15.6±1.0) mGy·MBq-1·L-1 | 使用200 MBq/ml,有效剂量为2.6 Sv(终生致命癌症风险10%) | [41,42] |
| 213Bi-DOTATOC:1.0~4.0 GBq | 生长抑素受体:进展性神经内分泌肿瘤患者 | 首次应用于人体:长期持续的肿瘤反应,和对β射线耐受性肿瘤的缓解 | 中度急性血液学及慢性肾脏毒性 | [27] |
| 213Bi-HuM195:10.36~37.0 MBq/kg | CD33:原发难治性或复发的急性髓系白血病患者 | Ⅰ期剂量递增:外周血白血病细胞和骨髓细胞减低 | 短暂性骨髓抑制 | [22] |
| 225Ac-HuM195:18.5~148 kBq/kg | CD33:急性髓系白血病患者 | Ⅰ期剂量递增:骨髓最大耐受剂量111 kBq/ml,外周血细胞减少 | 骨髓抑制 | [24] |
| 225Ac-PSMA-617:100 kBq/kg | PSMA:转移性去势抵抗性前列腺癌患者 | 首次应用于人体:PET显像提示完全缓解,PSA低于可检测水平 | 口干 | [2] |
| 227Th-epratuzumab BAY1862864:1.4 MBqa | CD22:复发或难治性CD22阳性非霍奇金淋巴瘤患者 | Ⅰ期剂量递增和最大耐受剂量确定,目前仍在招募入组(NCT02581878) | ||
| 223Ra-二氯化物:50 kBq/kg | 骨:有症状的去势抵抗性前列腺癌患者 | Ⅲ期ALSYMPCA总体生存和疾病无进展时间:总体生存时间14.9与11.3个月 | [31,32] | |
| 212Pb-trastuzumab:7.4~21.1 MBq/m2 | HER-2:多种治疗后仍进展的卵巢癌患者 | Ⅰ期安全性和耐受性:少数肿瘤体积缩小 | [29] |
注:a为起始剂量;ALSYMPCA为症状性前列腺癌患者的α核素治疗,epratuzumab为依帕珠单克隆抗体(简称单抗),DOTATOC为1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸-酪氨酸3-奥曲肽,HER-2为人表皮生长因子受体2,HuM195为林妥珠单抗,MX35 F(ab′)2为抗人卵巢癌细胞单抗片段,PSA前列腺特异抗原,PSMA为前列腺特异膜抗原,trastuzumab为曲妥珠单抗
从213Bi-林妥珠单抗到225Ac-林妥珠单抗。在一个临床Ⅰ期剂量递增试验中,人源的抗CD33单抗HuM195可靶向213Bi放射性标记的髓系白血病细胞[22]。先前使用β核素的研究中观察到了显著毒性,特别是骨髓的长期抑制,因此α核素的选择是合理的。18例原发性难治性或复发性进展期髓系白血病患者接受了10.4~37.0 MBq/kg的213Bi-HuM195治疗,尽管所有患者均出现短暂性骨髓抑制(恢复时间为22 d),但未观察到髓外毒性;在可评估的患者中,93%显示外周血白血病细胞减少,78%显示骨髓原始细胞减少,然而没有患者达到完全缓解,可能是因为患者的肿瘤负荷很大(高达1012个细胞)[22]。在一项临床Ⅰ/Ⅱ期试验中,采用阿糖胞苷(200 mg·m-2·d-1)和213Bi-HuM195(18.5~46.3 MBq/kg)序贯治疗方案,在213Bi治疗前行部分减瘤术;在所有剂量水平下,骨髓细胞均有下降,37 MBq/kg以及更高剂量的213Bi可产生与剂量相关的疾病缓解[23]。
225Ac被认为是可替代213Bi的治疗核素,因为它拥有更大的细胞毒性和更长的半衰期。随后的一项针对复发或难治性晚期髓系白血病患者的Ⅰ期临床试验对225Ac-HuM195进行了评估:给予的剂量是18.5~148 kBq/kg,子核在肾脏内的再分布是预先考虑到的,但没有证据表明放射性肾毒性;63%的患者外周血细胞消失,但仅发生在剂量为37 kBq/kg或以上的患者;67%的患者骨髓细胞减少[24]。一项针对进展期髓系白血病患者的临床Ⅰ/Ⅱ期研究目前正在评估低剂量阿糖胞苷联合225Ac-HuM195的MTD和疗效,初步结果建议在临床Ⅱ期研究中使用每份剂量74 kBq/kg,以限制长时间的骨髓抑制[25]。接受225Ac-HuM195的患者也接受了呋塞米和螺内酯治疗,以预防潜在的放射性肾毒性[25,26]。呋塞米已被停止使用,因为它会导致一些患者脱水;然而没有呋塞米,在接受225Ac-HuM195治疗的患者中也没有观察到肾毒性。
213Bi-DOTATOC用于β放射难治性肿瘤。Kratochwil等[27]报道了首例使用生长抑素类似物TAT,213Bi-DOTATOC可作为难治性神经内分泌肿瘤患者的治疗选择,这些患者之前曾进行过β核素90Y/177Lu-DOTATOC治疗。对伴有肝转移的进行性晚期神经内分泌肿瘤的患者采用动脉内输注治疗,其中1例骨癌患者用全身输注治疗(图4A),采用多疗程来增加213Bi-DOTATOC给药剂量,每2个月逐步增加剂量(总剂量:1.0~4.0 GBq),所有患者均显示出持久的肿瘤抑制效应,突显了213Bi-DOTATOC克服肿瘤对β辐射抵抗的能力;由于采用了针对β核素放射肽治疗所开发的方案,输注包括赖氨酸、精氨酸和琥珀酰明胶的注射液(Hausmann实验室公司),肾毒性降至最低[27]。

212Pb-1,4,7,10-四甲基碳甲酰基-1,4,7,10-四氮杂环十二烷[1,4,7,10-tetrakis(carbamoylmethyl)-1,4,7,10-tetraazacyclododecane, TCMC]-曲妥珠单抗。表达HER-2的卵巢癌患者其恶性肿瘤主要局限于腹腔,并在多次治疗后进展,Meredith等[28]进行的首次人体研究对212Pb-TCMC-曲妥珠单抗的生物分布、药代动力学和安全性进行了评估。有研究采用静脉注射4 mg/kg曲妥珠单抗后单次腹腔注射212Pb-TCMC-曲妥珠单抗(7.4 MBq/m2)[28],随后又有剂量递增的研究(7.4~21.1 MBq/m2)[29]。呋塞米和螺内酯作为肾保护剂给药,研究中观察到腹膜腔外极少的放射性药物重新分布,并且没有显著的骨髓抑制[28]。然而没有患者达到部分缓解的标准[29]。
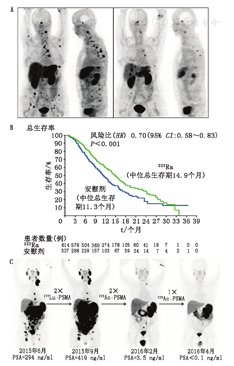
从223Ra-二氯化物到225Ac-DOTA-PSMA。在clinicaltrials.gov注册的52项临床试验中,223Ra-二氯化物[Alpharadin(德国Bayer公司)或多菲戈(Xofigo,德国Bayer公司)]的使用对α放射治疗的应用前景有很大影响。大约80%的临床试验涉及前列腺癌,35%的临床试验使用药物和223Ra-二氯化物的组合。在前列腺癌和乳腺癌患者中进行的第一次223Ra-二氯化物(46~250 kBq/kg)临床试验报告了疼痛缓解和碱性磷酸酶减少[30]。症状性前列腺癌患者的α核素治疗(alpharadin in symptomatic prostate cancer patients, ALSYMPCA)是一项临床Ⅲ期随机双盲安慰剂对照试验,用于评估223Ra -二氯化物(每4周50 kBq/kg,共6个周期)与安慰剂加标准治疗对有症状CRPC患者的疗效和安全性,223Ra-二氯化物治疗组的总生存期显著延长,为14.9个月,而安慰剂组为11.3个月(图4B)[31]。美国食品与药品监督管理局于2013年5月批准使用223Ra-二氯化物治疗CRPC。223Ra-二氯化物也被证明可延长总碱性磷酸酶和PSA增加前的时间[32]。该疗法具有良好的耐受性和极低的毒性,患者生活质量显著改善[32];然而,223Ra-二氯化物不能靶向软组织疾病或血液循环中的肿瘤(晚期表现)。
针对转移性CRPC的另一种有希望的α治疗选择是应用基于尿素的小分子PSMA抑制剂[2],其已用于临床前列腺癌PET显像[33]和β治疗[34]。尽管有希望,但这种β治疗方法在约30%的患者中无效,且对弥漫性红骨髓浸润的患者是禁忌的。225Ac被认为克服了β-抵抗并降低了血液学毒性。68Ga-PSMA-11 PET/CT显像证实PSMA阳性的2例转移性CRPC患者接受了225Ac-PSMA-617(100 kBq/kg,每2个月)的挽救治疗方案[2]。这2例患者均显示完全缓解(图4C),PSA下降至可测量水平以下,均出现了口腔干燥症[2]。一项针对14例转移性CRPC患者的研究确定了毒性和抗肿瘤效应之间的最佳折中方案[35]。该研究确定了100 kBq/kg的治疗剂量是可耐受的,且具有显著的抗肿瘤活性,但指出应该研究保护唾液腺的方法[35]。225Ac-PSMA-617具有靶向任何转移组织的优势,因此可用作223Ra-二氯化物治疗的补充选择。在对225Ac-TAT的大型研究中,225Ac的稀缺性始终是一个挑战。
α治疗的未来在于解决本综述第一部分中提到的障碍,即可用性、生产问题以及与子核再分配相关的问题。针对这些问题的解决方案目前正在研究之中,随着更大规模的、随机的、前瞻性的临床研究的进行并得到更有意义的疗效和毒性评价,必将促进α治疗更广泛的发展和应用。
α治疗方法的未来还在于临床试验的正确设计以及将这种治疗模式纳入当前的护理标准或与新的治疗方法相结合。对223Ra-二氯化物目前状况具有讽刺意味的是,尽管早期研究和ALSYMPCA已经完成,但治疗的最佳剂量和持续时间仍然未知。目前,一项随机Ⅱ期临床试验(NCT02023697)正在检测有2处或更多骨转移灶的转移性CRPC患者在3种不同的治疗方案下的结果:标准223Ra-二氯化物方案(55 kBq/kg,美国食品与药品监督管理局批准),剂量方案(每月88 kBq/kg,持续6个月)和延长疗程方案(每月注射55 kBq/kg,持续12个月)。这项研究是对一项已完成的较小规模单中心研究(NCT01934790)的补充,在此研究(NCT01934790)中患者在完成6个月疗程的223Ra-二氯化物治疗后再接受另外6个月的标准剂量(每月55 kBq/kg)的治疗,44例患者的初步数据显示,66%的患者完成了再治疗并具有良好的安全性[36]。再治疗的临床影响仍需要进一步明确。
223Ra-二氯化物治疗的优化也正在与肿瘤靶向治疗(如雄激素受体靶向治疗)相结合。一项随机临床期试验(NCT02043678)比较了雄激素生物合成抑制剂醋酸阿比特龙加强的松与阿比特龙、强的松加223Ra-二氯化物对未接受细胞毒性化疗的转移性CRPC患者的治疗,独立数据监测委员会建议当观察到骨折和死亡的不平衡时,应公开这项试验以支持单独使用阿比特龙或强的松治疗[37]。这些数据的细节尚未公布,但目前临床医师对使用阿比特龙、强的松和223Ra-二氯化物联合治疗早期转移性CRPC患者越来越谨慎。
223Ra-二氯化物与化疗联合治疗转移性CRPC的研究也正在进行中。223Ra-二氯化物与多西他赛联合用药已在临床Ⅰb/Ⅱa期研究(NCT0110352)中进行了试验,患者按2∶1随机分在联合用药组和多西他赛组,联合用药组中61%的患者PSA下降超过50%,而多西他赛组为54%的患者;持续抑制在Kaplan-Meier分析中也很明显,联合用药组PSA无进展生存时间明显更长(6.6与4.8个月;P=0.019 8)[38]。一些较新的试验正在探索将223Ra-二氯化物作为一种辅助手段以提高其他治疗效果,如聚(二磷酸腺苷-核糖)聚合酶抑制剂[即奥拉帕尼[39]或尼拉帕利(NCT03076203)],或作为一种免疫佐剂,通过远位效应以增强免疫治疗的作用[223Ra-二氯化物结合程序性死亡配体1抑制剂阿特来单抗(NCT02814669)]。肿瘤和骨双靶向的组合可使治疗效果发生在骨宿主区之外的部位,从而允许有内脏转移的患者接受223Ra-二氯化物治疗,但在美国目前是不被允许的。以肿瘤为导向的α核素(225Ac-PSMA-617)也可以进行针对肿瘤和骨的双重靶向治疗,但仍然需要对这些药物进行正式的前瞻性研究来确定最佳剂量和治疗间隔,并制定减轻毒性的策略。
本综述所述的研究表明,α核素有潜力成为优秀的治疗候选药物,并与β粒子治疗一起,可扩充治疗的选择。目前当出现对β治疗抵抗或当患者出现长期的骨髓抑制时,α核素正成为疾病晚期阶段的替代疗法;但是,在疾病早期阶段的应用还应进一步评估。总之,本综述的第一部分和第二部分对α核素疗法从基础放射化学到临床应用进行了概述。α放射治疗的未来取决于许多因素;第一部分重点介绍更广泛使用α放射性核素的障碍和新方法,第二部分强调了临床试验设计在确定α治疗的最佳剂量并将其纳入标准治疗方案中的重要性。



























