
外周血管疾病(PVD)是一种影响下肢的动脉粥样硬化性疾病,可导致骨骼肌缺血、间歇性跛行,更严重的则会导致截肢和死亡。由于常规的临床指标对骨骼肌生理学局部改变的评估并不灵敏,所以这类患者的疗效评估可能相对困难。应用PET和SPECT等技术对下肢进行放射性核素显像,可无创地定量评估PVD患者的病理生理状态,亦可与临床指标和其他显像方法形成互补。该文讨论了放射性示踪技术评估PVD的应用进展,并突出了分子影像学在临床的最新应用价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
外周血管疾病(peripheral vascular disease, PVD)是一种进行性动脉粥样硬化性疾病,会导致非冠状血管狭窄或闭塞。PVD通常累及动静脉和淋巴系统,但主要是影响下肢供血动脉。约800万美国人[1]及10%的全球人口[2]患有PVD,且老年人的患病率不断上升[3]。PVD严重损害健康,会导致进行性肢体缺血,进而导致跛行、溃疡不愈、截肢等,严重时还会致死[2]。尽管PVD患病率高,且已知与冠状动脉疾病密切相关,但PVD的诊断标准仍不明确[4]。
目前用于PVD诊断的技术有踝肱指数、超声、MR、CT血管造影(CT angiography, CTA)、SPECT和PET[5,6]。踝肱指数广泛用于PVD的诊断,该方法使用上下肢之间的血压差来检测主要供血动脉的阻塞情况,但在微血管疾病和内钙化灶的应用方面仍存在一些问题[7,8]。与其他显像技术相比,超声相对便宜、应用广泛且显像快速,这些优势使其在PVD筛查和评估中得以应用。但超声波的穿透深度有限,仅可用于大血管血流的评估[6]。MR提高了空间分辨率和组织穿透性,还可以用来评估PVD下肢组织的灌注和氧合[9,10,11]。但是MR对静息状态下血流灌注的测量不甚灵敏,并且通常需要预激或其他方法使外周血管反应性充血来获取足够大的血流量,因而存在一定的局限性;此外,与核素显像相比,MR靶向分子显像的灵敏度较低,可用的分子探针也更少[12]。CTA可将血管形态可视化,通常用于评估PVD的严重程度并指导外周血管介入治疗;但其在临床中仍无法在体定量评估动脉脉管系统[13]。
核素显像灵敏度高,且其使用靶向的放射性核素,融合了血流灌注和组织氧合作用、代谢及其他生物进程(如血管生成等)的评估,是研究PVD更具潜力的新技术(表1)[6]。SPECT和PET是核医学主要的显像模态,其中SPECT更加成熟,价格更为低廉且应用广泛。SPECT显像的可选示踪剂范围也更广。PET显像灵敏度和分辨率较高,通常使用短半衰期的放射性核素,减少了患者的电离辐射暴露。尽管SPECT和PET都具有较高的灵敏度,但与CT和MR相比,其空间分辨率较低(0.1~1 mm分辨率)。SPECT/CT和PET/CT一体机结合了高灵敏度的SPECT和PET显像(pmol范围内)与高分辨率的解剖成像,可同时进行精准定位和放射性定量。此外,这些一体化显像设备可以实现衰减校正和部分容积效应的校正,使在结构像上划定的感兴趣区(regions of interest, ROI)内的放射性摄取定量更为精确[12]。本篇综述论述了核素显像在PVD方面的应用进展,并重点介绍了靶向显像的方法,可能为研究和临床应用提供新的方向。

用于监测外周血管疾病(PVD)患者血流灌注的分子显像示踪剂
用于监测外周血管疾病(PVD)患者血流灌注的分子显像示踪剂
| 模态 | 血流灌注 | 血管生成 | 动脉粥样硬化 |
|---|---|---|---|
| SPECT | 201Tl[7,21,24,25,26] | 99Tcm-NC100692[47,48] | |
| 99Tcm-MIBI[27,29,31] | 111In-VEGF121[45] | ||
| 99Tcm-焦膦酸盐[76] | 125I-c(RGD(I)yV)[77] | ||
| 99Tcm-替曲膦 | |||
| PET | 15O-H2O[32,33,36,40] | 76Br-纳米探针[50] | 18F-FDG[58,59,60,61,62] |
| C15O2[35] | 68Ga-NOTA-RGD[49] | 18F-NaF[66] | |
| 15O2[35,36] | 64Cu-DOTA-CANF-comb[52] | 11C-乙酸盐[67] | |
| 13N-NH3·H2O[34] | 64Cu-DOTA-VEGF121[46] | 64Cu-DOTA-CANF[65] |
注:CANF为C型心房钠尿素,DOTA为1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸,FDG为脱氧葡萄糖,MIBI为甲氧基异丁基异腈,NOTA为1,4,7-三氮杂环壬烷-1,4,7-三乙酸,RGD为精氨酸-甘氨酸-天冬氨酸,VEGF为血管内皮生长因子
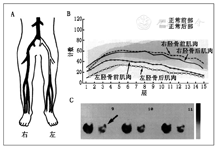
1.下肢血流灌注的评估。下肢血流灌注受损是导致PVD相关并发症的重要病理生理机制[14],因而下肢血流灌注的评估对监测疾病进展和治疗效果至关重要。核医学检查首次用于血管疾病下肢骨骼肌血流的研究是肌内注射24Na-氯化物[15]、133Xe[16]和99Tcm-高锝酸盐[17],计算它们的清除率。随着核医学的发展,后来使用99Tcm[18]、131I[19]和111In[20]标记微球和白蛋白进行二维显像,进行下肢灌注的测量。然而,这些方法效果并不理想,因为它们需要动脉内注射并利用首次通过来评估血流状态。201Tl无需动脉内注射,所以许多研究将目光转向了201Tl[7,21]。201Tl的生物特性类似于钾,可通过钠-钾泵转运到活细胞内[22],因此能够有效地测量心肌[23]和骨骼肌的灌注[21,24,25,26]。201Tl灌注显像可在静息或运动时静脉注射后进行,且具有较高的首次通过摄取率(约85%),可在较大的生理范围内评估血流量[23]。研究表明,全身201Tl显像可有效检测静息和运动负荷下PVD患者下肢的灌注异常[25,26],亦能发现踝肱指数正常的无症状患者的灌注异常[7]。传统上,PVD严重程度的评估是基于正常下肢和患肢之间的放射性摄取比值;若双侧均存在病变,则基于下肢ROI的放射性摄取与全身的放射性摄取比值[7,21,27]。三维SPECT的使用使得201Tl显像可在静息和负荷状态下更准确地发现并定位下肢缺血区域[24]。最先使用201Tl SPECT进行PVD检测的一项研究使用下肢病变区放射性摄取与全身的放射性摄取比值,评估了反应性充血期间腿部多个横断面图像的应力分布曲线(图1)[24]。

尽管201Tl在多项研究中已被证明有效,但与99Tcm标记的放射性核素相比,201Tl半衰期长且显像欠佳[28]。99Tcm标记的新型显像剂图像质量更好,且显像剂在体内几乎不存在再分布,可以在跑步期间进行注射,并延迟显像测量最大运动灌注[28]。99Tcm标记化合物的生物分布和动力学特性使其可用来测量下肢的血流灌注[27]。特别是99Tcm-甲氧基异丁基异腈(methoxyisobutylisonitrile, MIBI),多项研究已利用它来研究PVD患者的下肢灌注[27,29,30]。其可以灵敏地检测到单侧PVD患者双下肢静息状态下的血流灌注差异,与多普勒超声相比灵敏度更高[31]。本实验室的初步数据表明,99Tcm-替曲膦SPECT/CT显像有助于评估CTA结果异常和踝肱指数异常的PVD患者下肢灌注的局部差异(图2)。

PET显像亦可用来检测PVD的下肢血流灌注[32,33,34,35,36]。在PVD临床研究中使用的第一个PET放射性核素是15O-H2O[32,33,35,36],它可以自由扩散到组织中[37],且半衰期短(2 min),这使得患者一次就诊即可获得静息、运动或血管舒张负荷3种状态下血流量的评估(图3)[32,33,38,39]。一项15O-H2O静息-负荷PET研究发现,PVD患者小腿内的血流储备与健康志愿者相比存在显著差异,且与热稀释法算出的血流储备值相关[32]。另一项研究显示,在准备接受截肢手术的PVD患者的下肢远端,运动引起肌肉血流量显著减少,这表明15O-H2O PET显像可能对确定后续截肢程度具有重要价值[33]。Kalliokoski等[39]证明,用PET检测下肢骨骼肌的血流量和氧摄取量可能有助于评估患者对运动训练项目的反应;但他们观察到用PET测得的血流量基线水平变异性大,因此可能需要其他技术(如血管造影术)来辅助进行全面评估。

用于检测下肢静息和负荷血流的临床前PVD动物模型PET显像发现,PET与微球测得的血流值之间具有高度的相关性(r2=0.98)[34,40]。在PVD的裸鼠模型上使用13N-NH3·H2O PET显示下肢灌注的急性和慢性变化,发现PET血流灌注状态与纤维化、坏死的组织学分析结果密切相关[34]。
尽管PET显像可用于下肢血流灌注,但其可用的显像剂半衰期较短,图像必须在运动过程中或运动后立即获得,进行PET负荷显像还须将运动测力计与显像设备连接,因而具有一定的局限性。新开发的用于心肌灌注显像的18F-氟哌啶酮(flurpiridaz)可能更有利于心脏和下肢的运动PET显像。18F-氟哌啶酮的半衰期较长(110 min),可以实现在跑步机运动高峰期内的显像剂注射,然后连续获得心肌和骨骼肌的负荷灌注。心肌中18F-氟哌啶酮的高摄取分数可能使其在下肢骨骼肌血流检测方面具有优势,但这种可能性仍需进一步确认[41]。
2.血管生成显像。外周血管生成的靶向显像与下肢血流灌注显像相结合,可为在体评估PVD相关的病理生理过程提供有价值的信息。新生血管生成是一个复杂的过程,涉及各种细胞相互作用,并可能受到包括下肢缺血在内的多种刺激因素的影响[42]。血管生成的核素显像关键在于多种具有调节功能的靶点,如单核细胞、巨噬细胞和干细胞等非内皮细胞,以及如生长因子受体、CD13和细胞黏附分子等的内皮细胞,细胞外基质蛋白和蛋白酶等[43]。尽管有许多靶点可在体显示血管生成(表1),但在肢体缺血的情况下,血管生成的研究靶点主要是血管内皮生长因子(vascular endothelial growth factor, VEGF)受体和整合素,它们在血管生成过程中起着重要的作用[44]。
VEGF配体通过与VEGF受体(VEGF受体1~3)结合,在血管生成过程中发挥着关键作用,使VEGF受体成为外周血管生成的有效靶点[45,46]。Lu等[45]的研究证明了对111In标记的重组人VEGF121(一种缺氧时释放并与VEGF受体结合的血管生成蛋白)的靶向显像可以显示兔模型中缺血诱导的血管生成。另一项研究使用64Cu-VEGF121来显示在有运动训练和无运动训练的后肢缺血鼠模型中VEGF受体2表达的系列变化,发现缺血肢体的放射性摄取明显高于对侧正常肢体[46]。
除了PVD临床前模型中的VEGF表达外,研究还主要聚焦在整合素的靶向显像[47,48,49,50]。整合素是跨膜受体,通过增加信号转导以及调节细胞对细胞外基质的粘附来促进血管生成[44]。整合素αvβ3在血管生成的内皮细胞迁移中起着关键作用[51],因此在血管生成过程的显像中也受到重视[50]。Hua等[47]使用99Tcm标记的肽(NC100692)靶向整合素αvβ3,用于在后肢缺血的小鼠模型中进行血管生成研究。免疫荧光染色证实了整合素αvβ3对内皮细胞的靶向特异性。另一项研究通过结扎股动脉造成后肢缺血,结扎部位近端和远端肌肉ROI均显示99Tcm-NC100692滞留,股动脉结扎后1周达到峰值[48]。除99Tcm标记的化合物外,68Ga标记的精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp, RGD)环肽(cRGD)[49]和76Br标记的梳状纳米探针[50]也用于研究整合素αvβ3在后肢缺血鼠模型中的表达。使用68Ga和76Br标记的显像剂相关研究也发现,缺血肢闭塞后1周,整合素αvβ3的表达显著提高。
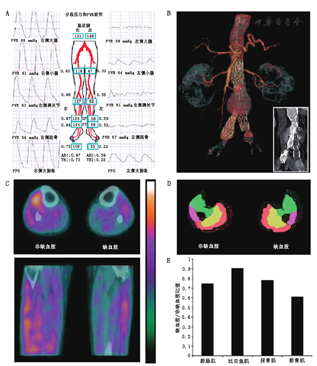
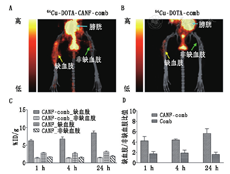
最近的一项研究表明,64Cu-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid, DOTA)-C型心房钠尿素-梳状纳米粒子靶向血管生成的PET显像是可行的,该纳米粒子可检测钠尿肽清除受体的上调(图4)[52]。钠尿肽是从心脏和脉管系统分泌的血管稳态激素,通过与受体,尤其是钠尿肽清除受体的相互作用而发挥作用[53]。利用后肢缺血小鼠模型,Liu等[52]比较了靶向与非靶向钠尿肽清除受体PET纳米探针的应用,研究证明在股动脉结扎后7 d,使用受体特异性纳米探针进行的靶向显像对血管生成反应灵敏度高,免疫组织化学证实了钠尿肽清除受体在内皮细胞和平滑肌细胞中表达水平上调(图4)。

3.动脉粥样硬化显像。组织灌注、血流和血管生成的研究具有临床应用潜力,而易损斑块则是另一个研究领域。近年来,用于斑块演变和稳定性研究的探针开发显著增加(表1)[54]。斑块的形成、进展通常以扩张性和限制性血管重塑为特征,其中多种信号事件和细胞相互作用共同促成了这些过程。CT和MR可用于动脉粥样硬化斑块的定位和特征研究。通过远端动脉血液的放射性摄取进行病灶内放射性摄取的归一化,从而进行定量分析。PET显像的空间分辨率优于SPECT,因此已成为在体研究动脉粥样硬化的首选[54,55]。
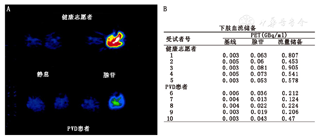
目前可用于动脉粥样硬化研究的放射性示踪剂中,18F-FDG PET显像受到关注[56]。18F-FDG是一种葡萄糖类似物,进入体内后转化为FDG-6-磷酸,随后停留在代谢活跃的细胞质中。利用18F-FDG的这一特性可对活化的巨噬细胞进行靶向显像,而活化的巨噬细胞是炎性反应的关键介质[57]。多项临床研究表明,18F-FDG PET显像较易开展(图5)[58],且18F-FDG与巨噬细胞活性密切相关[59]。但是,最近的一项研究并未发现外周动脉斑块中18F-FDG的摄取与之后CD68的免疫组织化学染色之间存在显著相关性,而CD68是巨噬细胞含量的一种测量指标[60]。尽管18F-FDG摄取与斑块易损性之间是否存在直接联系尚有争议,但初步研究显示,随着年龄和动脉粥样硬化危险因素的增加,血管18F-FDG摄取量随之增加[61,62]。心血管危险因素还与特定外周动脉中18F-FDG摄取的增加相关,这使得PET可能具有预测心血管事件的潜能,同时也是评价药物疗效的有效工具[63]。

除18F-FDG外,研究者们还开发了其他PET放射性显像剂用于动物模型和临床患者的动脉粥样硬化。显像剂的开发重点放在与动脉粥样硬化有关的各种靶点,包括炎性细胞、细胞外基质重塑的标志物和血管生成的调节因子(表1);然而,18F-FDG是目前唯一在临床中广泛应用的放射性显像剂[54,57,64]。尽管有研究证明间隔2周进行的18F-FDG显像有高度的可重复性[58],但很少有相关研究用于评估外周动脉粥样硬化(图5)[58,60,61,65,66,67]。18F-NaF也已用于研究外周血管的动脉粥样硬化斑块,其中股动脉的放射性摄取最高[66]。使用64Cu-钠尿肽进行的其他临床前研究和11C-乙酸盐的临床研究表明,动脉粥样硬化病灶中放射性摄取增加[65,67]。
4.基于放射性显像剂的PVD研究进展。下肢深静脉血栓形成(deep vein thrombosis, DVT)是PVD显像的一个应用方面,最近引起了研究者们的关注[68,69,70,71]。静脉超声是目前公认的检测DVT的技术。但是,超声很大程度上依赖于医师的技能水平和患者的疾病特征[72]。因此,可能需要更灵敏或特异的方法来指导抗血栓治疗。PET显像发现血栓形成的静脉中18F-FDG摄取明显高于非血栓形成静脉中的摄取,并且18F-FDG摄取与DVT症状发作时间呈负相关,这表明18F-FDG显像可能有助于指导DVT的病程[68]。使用99Tcm标记的肽P280(99Tcm-阿西肽)显像成功地应用于DVT[69]。由于99Tcm-阿西肽对活化血小板具有高亲和力,有望将新血栓与旧血栓区分开来,具有重要的临床意义。与超声和静脉造影相比,99Tcm-阿西肽显像对血栓的检测具有较高的灵敏度和特异性[70]。除了99Tcm-阿西肽,99Tcm-重组组织纤溶酶原在血栓的检测中也显示出高灵敏度和特异性[71]。总之,这些方法可能有助于下肢DVT的检测。
乏氧和酸中毒可能是评估PVD的替代指标[73,74]。现已证明,用于心肌显像的乏氧标志物可以为周围组织所利用,以评估缺血肢体的血流和耗氧量的平衡[74]。低pH插入肽[pH (low) insertion peptide, pHLIP]可用于研究酸中毒的变化。在酸性pH值下,平衡将朝着pHLIP插入细胞膜的方向移动,并造成组织内积聚。Sosunov等[75]证明pHLIP也可以成功地靶向缺血性心肌。尽管目前尚无pHLIP或乏氧显像用于PVD的研究,但如果加以应用,可能会增进对PVD潜在病理生理学的了解以及指导治疗,以改善血管生成、动脉生成和组织灌注。
通过在动物模型中使用多个分子靶点,PVD的放射性核素显像技术不断发展并显示出很大的潜力。尽管已经开发出多种显像剂,但其临床应用还远远不够。PVD核素显像的不断发展可能会有效、无创地评估人体对各种形式的医学治疗(如血运重建、锻炼计划以及基于基因或细胞的新型药物治疗)的系列反应。SPECT和PET高灵敏度的显像可能非常适用,可对解剖学和临床指标进行补充,从而指导未来血管介入及靶向药物治疗。


























