
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,56岁,因"右上腹疼痛20余天"入院。患者20余天前出现无诱因右上腹胀痛,间断性发作,饭后明显,初始症状较轻,后症状逐渐加重。外院超声、CT及MRI示肝多发占位性病变,未行治疗;患者既往有甲状腺炎病史。为进一步明确诊治,患者于本院肝胆外科就诊。实验室检查:血常规、尿常规、便常规及肝肾功能均无明显异常。血清肿瘤标志物癌胚抗原(carcinoembryonic antigen, CEA)、甲胎蛋白(alpha-fetoprotein, AFP)和糖类抗原19-9(carbohydrate antigen 19-9, CA19-9)均在正常范围内。
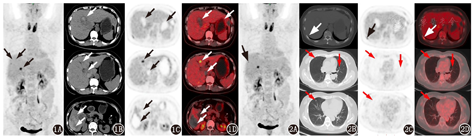
为进一步明确病变性质及全身情况,行18F-脱氧葡萄糖(fluorodeoxyglucose, 18F-FDG;本科室自行制备)PET/CT(德国Siemens Biography 16)显像。结果示:(1)肝多发占位性病变伴出血坏死,最大约7.2 cm×6.7 cm,病变多数呈放射性摄取稀疏,少数呈放射性浓聚,最大标准摄取值(maximum standardized uptake value, SUVmax)为8.5(图1);双肺多发类圆形结节,边界清晰,最大约0.5 cm×0.5 cm,未见明显放射性摄取(图2);右侧第9后肋局部异常放射性摄取(已排除外伤),SUVmax为4.1(图2)。(2)甲状腺放射性摄取弥漫性增高,SUVmax为13.7。PET/CT诊断结果:(1)肝原发恶性肿瘤伴双肺及右侧第9后肋转移可能性大,建议行活组织检查;(2)甲状腺炎。PET/CT检查2个月后,患者复查胸部CT显示双肺结节增大,最大结节为1.1 cm×1.0 cm。

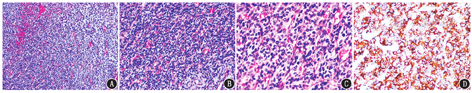
于腹腔镜下行肝左外叶肿瘤切除活组织检查,术后病理结果(图3):恶性血管球瘤。病变横断面显示明显出血及瘀血,肝肿瘤细胞多呈圆形至椭圆形,胞质丰富,边界清楚,高倍镜下可见明显的核异型性和不典型的有丝分裂象。免疫组织化学染色结果:平滑肌肌动蛋白(smooth muscle actin, SMA;+)、波形蛋白(vimentin,Vim;灶+)、CD34/CD31(血管+)、突触素(synaptophysin, Syn;弱+)、嗜铬粒蛋白A(chromogranin A, CgA;-)、肌酸激酶(creatine kinase, CK;-)、CK18/CK19(-)、甲状腺转录因子-1(thyroid transcription factor-1, TTF-1;-)、磷脂酰肌醇蛋白聚糖-3(phosphatidylinositol proteoglycan-3, GPC-3;-)、S100蛋白(-)、CD56(-)、人黑色素瘤45(human melanoma black 45, HMB45;-)、CD68(组织细胞+)。

血管球瘤是一种罕见的软组织间叶源性肿瘤,其起源于动静脉吻合支周围血管球体细胞或神经肌动脉血管球,约占软组织肿瘤的1.6%[1]。根据2013年WHO对软组织和骨肿瘤的分类,血管球肿瘤临床上可分为良性、恶性和不确定恶性潜能[2]。至少满足下列标准之一的肿瘤可定义为"恶性血管球瘤"[3]:(1)肿瘤位于筋膜下或内脏器官等组织深部,且肿瘤直径>2 cm;(2)具有不典型性核分裂象;(3)具有明显核异质性且核分裂象>5/50高倍视野。大多数血管球瘤为良性,少数为恶性或具有恶性潜能。本例肿瘤原发于肝,病灶直径>2 cm,光学显微镜下可见明显的核异型性和不典型的有丝分裂象,符合恶性血管球瘤病理诊断标准。
血管球瘤通常发生在真皮中的血管球体或四肢末端的皮下组织,如甲床、手掌、前臂及足部[4]。由于缺少血管球体,血管球瘤很少发生在内脏器官,个案报道包括发生在胃[5,6,7]、肝[8]和肺[9,10]等。本例为罕见的肝原发恶性血管球瘤,CT及病理提示肝内大多数病变有明显出血及瘀血,因此PET图像大多数病变呈放射性摄取稀疏,而肝左外叶一较小病灶无明显出血或瘀血,表现为明显的放射性摄取。患者2个月后复查的胸部CT示:肺内结节明显增大增多,因此肺内结节应为转移灶;右侧第9后肋在形态上无明显异常,是否为转移灶尚需要进一步随访。肝原发血管球瘤的个案报道中,CT平扫病灶呈低密度,增强后边缘清楚,肿块表现为富血供,持续强化,以周围环形强化及中央分隔强化为主[11,12]。因此,肝血管球瘤应作为肝血管肉瘤、肝血管内皮细胞瘤、肝血管外皮细胞瘤、肝不典型血管瘤等病变的鉴别诊断。
所有作者均声明不存在利益冲突


























