
90Y微球选择性内放射治疗越来越多被用于原发性肝癌和肝转移瘤。了解此技术相关的物理特性、剂量相关问题和影像技术特点,对介入科医师和核医学科医师来说尤为重要。尽管该治疗方法确实存在并发症的可能,但90Y微球选择性内放射治疗技术总体还是有效且安全的。该文对90Y微球选择性内放射治疗的适应证进行了全面深入地分析,回顾了术前血管造影技术和99Tcm-大颗粒聚合人血清白蛋白(MAA)显像的作用,比较了不同的给药技术及药物载体(树脂和玻璃微球),并阐述了可能存在的并发症。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
应用射线治疗恶性肿瘤不是一项新发明,但研究者在努力提高这种疗法的精准度。早在1965年,经动脉注射放射性同位素90Y就已经被研究[1]。早期尝试将这种疗法用于原发性肝癌和胰腺癌,其疗效显著且并发症少。90Y发射β射线,平均能量为0.94 MeV,可破坏和杀死肿瘤细胞[2,3],半衰期约为64 h,组织穿透深度约为1 cm,对周围影响小[2,3]。通过动脉注入带有射线的微粒比全身用药优势更明显,可将药物靶向至肿瘤灶,使之接受最大的辐射剂量,并减少周围正常肝实质接受的辐射[2]。此外,因组织渗透受限,该技术对于操作的医务人员和照顾患者的亲属来讲更安全[4]。随着医疗技术的发展,90Y的应用取得了长足发展,而且变得越来越普遍,使其成为抗击恶性肿瘤的有效工具。
自从出现经动脉90Y治疗技术以来,其就已经被广泛应用于治疗原发性肝癌的研究和应用[1,5,6]。因肝细胞肝癌对化疗反应差、对射线敏感,但放疗可严重损伤同样对放射线敏感的正常肝实质,因此肝细胞肝癌历来难治[5,7]。一般来说,如果肝细胞肝癌是局部性的,原则上应手术切除;但有些患者不能耐受手术,或者在就诊前就已经出现多个病灶或双叶病灶而不能进一步手术治疗[4,8]。早期研究证实,肝细胞肝癌对放疗敏感性高,经动脉内90Y微球栓塞治疗可致肿瘤坏死[5];此外,无法切除的肝细胞癌往往血供丰富,因此,应用此法可延长患者寿命[9]。后期研究证实即使是局部性的肿瘤,90Y微球选择性内放射治疗的效果也可等同于或优于其他局部治疗方式,如经动脉化学栓塞或消融术[10,11]。
肝内胆管细胞癌是第二常见的肝原发恶性肿瘤[12]。如无法切除肿瘤病灶,患者预后非常差,尽管联合化疗(吉西他滨和顺铂)可以提高总生存率,但通常也具有更大的全身毒性。肝内胆管细胞癌同样也对放疗敏感,使用90Y微球选择性内放射治疗的姑息治疗已证实可显著提高患者的中位生存期,且不良反应小[12,13]。
肠癌属全世界最常见的恶性肿瘤之一,由于门静脉引流,好发肝转移[14,15]。目前,肠癌肝转移的标准疗法是由氟尿嘧啶、亚叶酸钙和奥沙利铂(fluorouracil+leucovorin+oxaliplatin, FOLFOX)组成的联合化疗方案;部分文献报道FOLFOX联合90Y微球选择性内放射治疗是有价值的,尤其对化疗抵抗的患者[14,16,17,18]。目前也有多项临床试验用于验证联合治疗是否有益,但尚无统一结论[16,19]。
神经内分泌肿瘤是好发于全身各处的恶性肿瘤,通常起源于消化道[20]。与肠癌相似,神经内分泌肿瘤通常由于门静脉引流而转移到肝脏。对不能手术切除的患者,单纯的动脉内栓塞治疗是有效的肝转移瘤姑息疗法,同样转移瘤也对放疗敏感,故也可联用90Y微球选择性内放射治疗增加疗效[17,20]。美国食品与药品管理局(Food and drug administration, FDA)近期批准治疗神经内分泌肿瘤的放射性药物Lutathera[177Lu- 1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸-D-苯丙氨酸1-酪氨酸3-苏氨酸8-奥曲肽(1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid-D-Phe1-Tyr3-Thr8-octreotide, DOTATATE)],其可取代90Y微球选择性内放射治疗[21]。
除了针对有手术禁忌证的患者进行挽救性治疗和各种恶性肿瘤的一线治疗外,90Y微球选择性内放射治疗还可作为手术的辅助手段[22]。90Y微球选择性内放射治疗可降低肝细胞癌、肠癌肝转移和胆管癌患者的分期,使其更适合手术切除[13,22]。微球选择性内放射治疗还可以减轻肿瘤负荷,减慢疾病进程并为肝移植提供桥梁[22]。
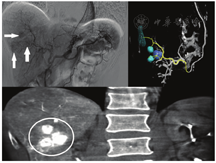
尽管术前影像检查可以显示病变的位置,但难以轻易识别出供应肿瘤的特定肝动脉分支的数量和位置[23]。90Y微球选择性内放射治疗前常需要肝动脉全景造影用于确保剂量送至病灶,从而最大程度地提高疗效并减少潜在的非靶器官栓塞。直接肝血管造影术(图1)是在连续透视下用造影剂注入肝动脉及其分支,医师可清晰观察到肿瘤、肿瘤的血供及可能供应其他器官的任何分支。特别是胃十二指肠和右胃动脉也可能来自于肿瘤供应动脉起点远端的肝分支。在治疗前,可以预先栓塞供应其他器官的动脉,以防止90Y微球误放置至肝外的其他区域,引起严重的不良反应[24]。此外,还可使用锥形束CT和引导软件优化90Y选择性内放射治疗前的肝动脉显示,从而清晰显示肿瘤及其血供分支(图1)[25]。

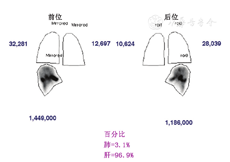
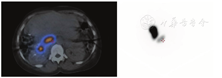
在所有患者中肝和肺之间均存在一定程度的血液分流,可能是正常分支血管、增生的肿瘤血管或动静脉畸形造成,称之为肺肝分流[26,27]。肺肝分流可在术前通过注射放射性标记的99Tcm-大颗粒聚合人血清合白蛋白(macroaggregated albumin, MAA)后计算得出一个肺内分流率的数据[28]。因99Tcm-MAA粒子的大小和分布与90Y微球相似,从而可预估对肺的潜在辐射损伤[29]。通过肝动脉导管注射多个小剂量的99Tcm-MAA(总剂量约0.148~0.185 GBq),使其分布在整个肝脏中[23,28,29]。采用腹部平面显像或SPECT(SPECT/CT)可获得术前成像(图2)[28]。计算肺内放射性示踪剂摄取的总计数,并将其除以肺和肝脏内计数的总和,从而得到肺内分流率(图3)。如果肺内分流率在单次给药剂量下大于25 Gy(树脂微球)或30 Gy(玻璃微球),或在肺中沉积的累积剂量大于50 Gy,则会对肺部造成辐射损伤风险,此时90Y微球选择性内放射治疗就属于禁忌证(图4)[30]。
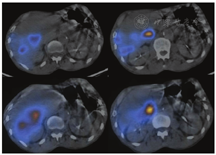



99Tcm-MAA SPECT/CT也可用于显示腹部肝脏和肝外器官的放射性示踪[31]。如果正确使用99Tcm-MAA,可观察到肝脏靶区病灶摄取相对增强,而非靶区的肝实质也可因分支动脉或寄生动脉出现少量分布。治疗前的血管造影还可显示出潜在的侧支血管,若在其他腹部器官中也有放射性分布(图5),则可能是由于其他腹部血管引起的,而该血管来自99Tcm-MAA注射部位远端的位置。如果未能预防性地栓塞这些动脉,那将使患者处于非常高的非靶器官栓塞风险中。当然,偶尔预防性栓塞也会导致出现新的侧支通路,这些通路大到足以使90Y微球偏离其预期靶点[32]。

在90Y微球选择性内放射治疗中,靶区肝组织的计划吸收剂量范围一般约为80~120 Gy[33]。这个吸收剂量的计算是根据为每单位治疗肝脏质量提供的能量或放射活性乘以剂量常数,然后再减去因肺分流造成的损失而得出。待治疗肝脏肿瘤的质量可通过在CT上测量到的体积转换得到,通常树脂微球的转换系数为1.05 kg/L,而玻璃微球的转换系数为1.03 kg/L。90Y的治疗剂量是建立在药物均匀分布、90Y完全衰减和病灶精确测量的前提之下。在这些假设的基础上,已有研究人员建立了经验性剂量模型,用于估算达到目标肝组织所需剂量而不超最大肺吸收剂量。
目前有2种不同类型的90Y微球:玻璃微球和树脂微球[30]。玻璃微球,即TheraSphere(英国BTG公司),尺寸为20~30 mm,可以配制剂量在3~20 GBq之间。树脂微球,也称为SIR-Spheres(澳大利亚Sirtex公司),尺寸为20~60 mm,具有的最大剂量为3 GBq[34]。目前,玻璃微球是FDA在人道主义豁免的情况下批准用于肝细胞癌患者的放射治疗药物[33,34];而树脂微球已通过FDA批准用于不可切除的结直肠癌肝转移[33,34]。
放射性肝叶或段切除术均需进行剂量计算。虽然尚无统一的放射性叶切除术的剂量模型,但研究报告称治疗部位的中位剂量为112 Gy[35]。与放射性叶切除术一样,放射性段切除术也有治疗剂量计算,用于治疗病变所在整个节段;然而,在放射性段切除术中,往往是从供应1或2个节段的血管中注入的,而不是像放射性叶切除术那样从叶间动脉注入[36]。
确切的剂量计算取决于微球选择性内放射治疗的微球类型[35,36]。大约40~80百万个树脂微球的最大活性为3 GBq;而玻璃微球仅1~800万个颗粒就显示出相似的放射性,因此每个微球的放射性活性更高,最大潜在活性约为20 GBq。对于树脂微球,剂量是基于活性的,而不是目标放射剂量。经验剂量模型根据最大活性和体表面积(body surface area, BSA)确定活性,并修改肝肺分流中的分流率。对于树脂微球,肝脏的目标辐射剂量限制为小于80 Gy;但对于玻璃微球,常规辐射剂量为80~120 Gy。BSA方法是计算树脂微球90Y剂量的主要方法[33]。
90Y微球选择性内放射治疗经验模型的建立基于肿瘤占据的整个肝脏体积百分比[37]。在此模型的基础上,如果肿瘤体积小于肝脏总体积的25%,则应使用2 GBq;如果肿瘤体积为肝脏总体积的25%~50%,则应使用2.5 GBq;如果肿瘤体积大于肝脏总体积的50%,则应使用3 GBq。90Y树脂微球的剂量计算(BSA法)首先需计算患者的实际BSA剂量:然后身高(m)乘以0.725,体质量(kg)乘以0.425,再乘以常数(0.202 47)。基于BSA法的树脂微球活性计算(GBq)等于肿瘤体积除以肿瘤体积和正常肝脏体积之和(两者均通过横截面成像计算得出),然后将该结果加上患者的BSA减去0.2。
剂量分布均匀的假设是当前计算中的另一个重要限制因素,因为与正常的实质相比,血流优先偏向肿瘤[38]。学者正尝试解决这种不均匀的血流分布。一项研究纳入了主观确定的肿瘤相对于邻近的正常肝组织的血管过度比例,发现传递给肿瘤2倍以上的中位计算剂量,从521 Gy增至1 214 Gy[39]。这些发现导致开发了更接近于实际的模型,称为3室模型,该模型在计算剂量时增加了肿瘤与肝脏的摄取比率,并显示出比经验或BSA模型更好的剂量估算值[40,41]。
尽管BSA模型由于其相对简单而成为90Y剂量的常用方法,但所得剂量与肝脏体积并没有很好的相关性,特别是在肿瘤负荷非常低或非常高的情况下[37,41]。如果患者有肝脏手术史,其主要后果是用药过量,则可能进一步加剧这种差异。正常肝实质中剂量的沉积增加,并可能导致致命的不良反应。另一个剂量模型MIRD可能代表了一种90Y微球选择性内放射治疗活性更准确的测量方法[37,41,42]。MIRD的作用是基于任何给药剂量都会影响3个不同的腔室:肿瘤、正常肝实质和肺实质[37,42]。90Y微球的活性等于肝脏的估算剂量(灰色)乘以肝脏质量(kg)除以50。将90Y治疗的总活性乘以每个腔室(肝脏,肿瘤或肺)的摄取分数再乘以184 000,然后再除以合定腔室的质量,即可计算出每个腔室的剂量[42]。
美国核监管委员会与美国放射学院协商后,发布了有关医师进行90Y治疗所需资格的准则[43,44]。90Y的授权用户有3个要求:完成至少3个制造商模拟的案例;获得声明运营商为授权用户的许可修订;以及对每种90Y微球体进行至少3个体内案例。
与任何动脉内介入疗法一样,主治医师必须在开始90Y微球选择性内放射治疗之前决定是进入桡动脉还是股动脉。尽管许多传统的介入放射学文献都讨论了通过股动脉入路进行手术,但一些医院已经开始通过桡动脉入路进行该手术[45]。最初桡动脉入路在介入心脏病学文献中进行了描述,现已成为介入学中一种突出的方法,可作为腹腔内脏栓塞操作的安全替代方法。与股动脉入路相比,桡动脉入路出血并发症的风险小,并且在肥胖患者中更容易操作。
通过Seldinger技术获得动脉通路后,用4或5号导管系统将主动脉、腹腔动脉和肝动脉分支置入导管中[9],然后将同轴的0.825 5 mm(0.032 5英寸)系统推入目标动脉,在该目标动脉中导入90Y微球。避免90Y微球停滞或回流很重要,从而可防止潜在的肺分流或非目标器官损伤,尤其是对于树脂微球。根据疾病的程度,不同层次的亚支可被选择,包括供应肿瘤的亚支、节段性分支和叶支。放射性段切除术是在1次疗程中基于Couinaud分类系统对2个或更少肝段进行微球选择性内放射治疗。该技术通常用于最大径<5 cm的肿瘤,因为这些肿瘤不适用于手术切除或经皮消融等治疗[36]。放射性叶切除术是将90Y颗粒注入到一个肝叶动脉(通常是肝右叶)中,以使肝脏的对侧叶肥大[9,22],一旦对侧叶肥大到肝脏总体积的20%~40%,就可以切除栓塞的肝叶[9,22]。
一旦选择了动脉,就可以给药[33]。剂量存储在Nalgene塑料容器(美国Thermo Fisher Scientific公司)中,该容器中装有药物并连接了与动脉导管相连的管路。玻璃和树脂微球的注入技术略有不同。玻璃微球管道的冲洗必须确保在4或5导管系统中,以与正常肝血流相同的输注速度完成剂量输送。对于树脂微球,所需更多的球数可能会导致动脉内出现栓塞或淤积现象,必须使用造影剂进行透视引导,以确保最大的血管饱和度。此外,还可以对剂量容器进行辐射监控,以确保已向患者使用了最佳剂量。
注射90Y 24 h内,需进行SPECT/CT显像,以确保90Y微球已经沉积在适当的肝脏区域[31]。应观察放射性区域与术前99Tcm-MAA SPECT/CT显像一致,而肝脏外区域无放射性(图2)。SPECT/CT和平面显像通常是通过双探头的γ照相机获得[30]。
如今,肝肿瘤的90Y微球选择性内放射治疗可以在门诊进行,患者在术后仅需住院观察2~6 h[9]。治疗后的预防措施在不同的治疗机构之间可能有所不同,这包括对主治医师的防护措施。可为患者开具预防胃肠道溃疡的质子泵抑制剂或类固醇激素对抗放射性治疗后疲劳。尽管通常90Y辐射暴露对周围人群有限,但仍应指导患者注意辐射安全以及相应的预防措施,因为可在尿液中检测到微量的放射性。
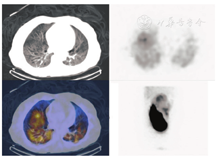
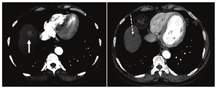
首次术后随访应该在治疗后1~3个月进行,采用腹部增强CT或MR,虽然术后3~6个月才是最佳观察时期[9]。尽管肿瘤在2种影像上表现不同,但治疗反应的特征相似[46]。如果治疗成功,则随着肿瘤血管的减少,肿瘤的大小和增强将减弱,范围与肿瘤坏死相一致(图6)。MRI的弥散受限将增加,因坏死组织的细胞膜完整性受损。经过90Y微球选择性内放射治疗后,一部分肿瘤大小可能反常增加;但是,任何大小的增加通常都是继发于周围正常肝实质细胞的死亡,不应错误地解释为肿瘤生长。治疗后影像复查中的另一个需要注意的陷阱是坏死腔周围的环形强化,有时它会被误解为肿瘤残留,但实际上它代表了肿瘤治疗后的纤维化。如果进行随访PET显像,则提示病灶缩小和代谢下降。术后成像还可以评判是否发生90Y微球选择性内放射治疗后并发症。

通常患者可以很好地耐受90Y微球选择性内放射治疗,但仍存在多种潜在的并发症,总体发生率较低[33]。这些并发症的发生与肝恶性肿瘤的其他微创治疗相似[46]。在引起肿瘤坏死的任何治疗中均可发生肝周积液和肝脓肿[33]。造影剂引起的肾毒性或对碘化造影剂的过敏反应可发生于任何血管造影术。在经动脉治疗期间,也可能发生动脉损伤,包括出血、解剖或假性动脉瘤。
90Y疗法最常见的不良反应是微球选择性内放射治疗后综合征,其特征表现为疲劳、恶心、呕吐或腹痛[33]。这些症状可以根据需要使用非处方镇痛药止痛和止吐药对症治疗。
尽管在给药过程中采取了许多步骤来最大程度降低对非肿瘤性肝实质的影响,但是由于特定患者的生理状况引起的给药差异可能会导致肝实质并发症[33]。其中最严重的是微球选择性内放射治疗引起的肝病,即严重的肝毒性和继发于辐射的肝功能障碍。多次治疗和额外的外照射会增加这种疾病的风险。对肝实质的其他影响包括肝纤维化和门脉高压。
胆道系统与肝脏可能是90Y放射性治疗并发症的潜在部位[33]。90Y治疗后发生了胆管性肝炎和胆管坏死,可能与肝包膜回缩有关[46]。放射性胆囊炎是由于胆囊动脉的非目标栓塞引起的,可通过预防性栓塞和从肝动脉远端向远处注射来预防这种并发症[31,33]。放射性胆囊炎的治疗方法与其他任何胆囊炎相同,即采用胆囊切除术[33]。
继发于非目标栓塞的胃和十二指肠溃疡的发生在文献中已有报道,可以通过十二指肠动脉、胃动脉或任何侧支血管的预防性栓塞来预防[30,33]。由于90Y微球经肝镰状动脉分流至腹壁,可能会发生自限性放射性皮炎[30,33]。非靶标栓塞的其他部位包括胰腺(放射性诱发的胰腺炎)和肺(放射性肺炎)[33]。
90Y微球选择性内放射治疗对肝原发性肝癌和肝转移瘤都是有效的治疗方法。对于不能手术或其他治疗的患者,90Y微球栓塞疗法为改善生存率和减轻疾病负担提供了机会。对于每位放射科医师、介入科医师和核医学科医师而言,了解该治疗方法的实施过程,术后影像学随访以及潜在的并发症非常重要,从而可精准地为不断增长的患者群体提供服务。


























