
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
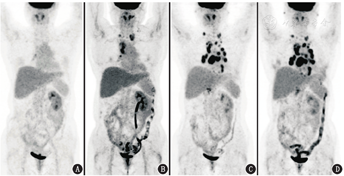
患者女,55岁,右输尿管癌术1年余,多疗程放化疗后,发现多发淋巴结肿大3个月。患者于2019年5月因右侧输尿管可疑恶性占位行"腹腔镜右侧半尿路切除术"(右肾+右输尿管全长+右输尿管开口周围部分膀胱切除),术后病理提示:肾盂输尿管高级别浸润性尿路上皮癌,侵及输尿管肌层,淋巴结转移癌(肾门1/1),手术病理分期pT2N1Mx(Ⅳ期)。术后1个月行18F-脱氧葡萄糖(fluorodeoxyglucose, FDG)PET/CT显像,未见肿瘤残留或转移(图1A)。后行3个疗程辅助化疗(吉西他滨+顺铂)及多次放疗(放疗野包括右侧肾窝及输尿管走行区、膀胱三角区、下腔静脉及右腹主动脉旁淋巴引流区),至2019年12月结束。2020年10月,患者自行触及双侧锁骨上区包块,2021年1月复查18F-FDG PET/CT新见双侧锁骨上/下、右肺门及纵隔多发代谢增高淋巴结,最大者位于纵隔4R区,大小约2.2 cm×1.7 cm,最大标准摄取值(maximum standardized uptake value, SUVmax)为7.4;腹盆部未见明显异常(图1B)。输尿管淋巴引流丰富,输尿管尿路上皮癌病程早期即易发生淋巴转移,通常先转移至区域淋巴结,与原发灶所在输尿管节段相关,而晚期疾病可转移至任意组淋巴结[1],加上腹盆腔淋巴引流区都经过了放疗,所以此次有可能直接出现颈胸部淋巴结的跳跃性转移。患者自2021年1月起,予度伐利尤单克隆抗体(简称单抗),其为程序性细胞死亡蛋白配体1(programmed death-ligand 1, PD-L1)阻断剂,属于免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)治疗。4个疗程抗PD-L1治疗后于2021年4月复查18F-FDG PET/CT,相较于治疗前,新见纵隔、双肺门及上腹部多发代谢增高的肿大淋巴结(图1C)。患者之后继续接受6个疗程抗PD-L1治疗,2021年6月复查18F-FDG PET/CT,可见原颈胸部淋巴结数量、大小、代谢活性大多变化不明显(图1D)。

肿瘤治疗后的疗效可以用病灶大小、代谢活性变化来评估,可参照实体瘤疗效评价标准(response evaluation criteria in solid tumors, RECIST)[2]、实体瘤疗效PET评价标准(PET response criteria in solid tumors, PERCIST)[3]。在免疫治疗时代,有时肿瘤的疗效评价会变得复杂。ICIs是通过阻断免疫检查点通路,重新激活T细胞介导的抗肿瘤免疫,逆转免疫逃逸现象,从而促进肿瘤细胞死亡。在免疫治疗过程中,由于免疫细胞浸润、细胞内或血管源性水肿、炎性反应以及肿瘤内出血等原因,可能出现假进展效应,表现为肿瘤体积增大、代谢增高,甚至出现新发"病灶",但这并不是肿瘤细胞增多造成的[4]。ICIs治疗后的假进展平均发生时间在开始治疗后12周左右,其在应用抗细胞毒性T淋巴细胞相关蛋白4(cytotoxic T lymphocyte-associated antigen-4, CTLA-4)单抗治疗的黑色素瘤患者中发生概率约10%,在抗程序性细胞死亡蛋白1(programmed death-1, PD-1)或PD-L1治疗的其他实体瘤中发生概率不超过5%[5]。若临床怀疑假进展,建议4~8周后复查影像学检查确认。另一种ICIs治疗中的特殊效应是超进展,是指治疗后异常的肿瘤生长增速,治疗后第1次评估时(<2个月)肿瘤负荷增长>50%,且治疗后生长速率>2倍治疗前生长速率。超进展发生率在不同肿瘤中相差较大,通常认为实体瘤抗PD-1或PD-L1治疗后超进展发生率约10%[6]。超进展患者预后极差,怀疑发生超进展后需立即停用ICIs治疗并更换方案。
本例患者在开始抗PD-L1治疗后迅速出现了淋巴结病变明显增多、增大;继续维持治疗,淋巴结的病变又趋于稳定,变化不明显。如果考虑抗PD-L1治疗后新出现的淋巴结病变都是转移,是肿瘤的超进展,那么后续治疗过程中的变化并不符合肿瘤超进展的表现。仔细观察开始抗PD-L1治疗后出现的淋巴结病变,大多分布在肺门、气管周围,双侧分布较对称,淋巴结密度较均匀,没有明显的坏死、融合,这种PET/CT上的表现很符合结节病的代谢、形态、分布特征(图2)。
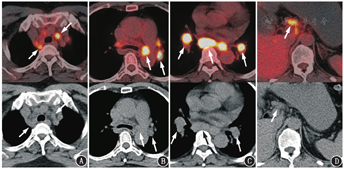

ICIs治疗除了可能出现假进展,还会引起自身炎性毒性反应,称为免疫相关不良反应(immune-relatedadverseevents, irAEs),结节病样反应就是irAEs的一种。结节病样反应在抗PD1或PD-L1治疗中发生概率并不高,通常无症状,由影像检查发现。研究推测ICIs的结节病样反应的机制与系统性结节病相似,以辅助性T细胞(helper T cell, Th)1反应为主。ICIs引发细胞介导的免疫反应及随后免疫原性肿瘤细胞破坏可能暴露出促肉芽肿炎性反应形成新抗原,从而导致结节病样反应。与系统性结节病相似,irAEs中的结节病样反应最常累及淋巴结、肺及皮肤,偶尔也会有中枢神经系统、垂体、脾、骨受累[7]。典型结节病样反应的18F-FDG PET/CT表现与系统性结节病一致,为对称性的双肺门及纵隔淋巴结肿大,密度均匀,不伴坏死,可伴双肺多发淋巴管周围分布的间质结节、斑片或团块、磨玻璃影等,形态多样,代谢增高,可伴腹腔淋巴结受累[8]。本例患者根据新出现淋巴结的形态、分布、代谢特点、以及ICIs治疗过程中的变化,要考虑出现结节病样反应的可能。
ICIs治疗引发的irAEs几乎可影响所有器官,大部分为轻度至中度,停药后可自行缓解。irAEs的发生率很高,60%~70%的ICIs治疗后患者会出现至少一项不良反应[9],其中皮肤、肠道、内分泌系统(甲状腺、垂体)、肺和肌肉骨骼不良反应相对常见,有时也可发生心血管、血液系统、肾脏、神经和眼部的不良反应,其中神经系统和心脏不良反应的致死率较高,尤其值得关注。由于irAEs与免疫诱发的炎性反应相关,所以irAEs在18F-FDG PET/CT上也可有所表现,在判读PET/CT时需加以留意。除了前面提到的结节病样反应外,18F-FDG PET/CT上可发现的irAEs还包括免疫相关肺炎、结肠小肠炎、甲状腺炎、关节炎、肌炎/筋膜炎、垂体炎、心肌炎、肝炎、胰腺炎等。如图3为1例肝癌患者抗PD-1治疗后新出现右肺下叶实变影,伴支气管充气征,18F-FDG代谢轻度增高,SUVmax为3.3;患者无发热或呼吸系统的主诉或体征,未加用针对性治疗、未停用PD-1治疗,胸部CT随访观察实变范围缩小,临床考虑免疫相关肺炎可能。
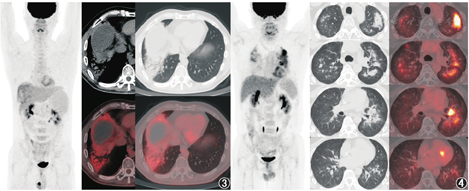

影像学上免疫相关肺炎主要表现为不同类型的间质性肺疾病,大致可分为机化性肺炎、非特异性间质性肺炎、过敏性肺炎、弥漫性肺泡损伤几大类[10]。但免疫相关肺炎需要与肺部感染鉴别,二者在肿瘤患者治疗期间都比较容易出现,影像表现有相似,而治疗方向却相反(糖皮质激素与抗生素等)。如图4是1例纵隔大B细胞淋巴瘤患者,曾接受化疗、自体干细胞移植、嵌合抗原受体T细胞回输、抗PD-1治疗,患者抗PD-1治疗8个月后出现了胸闷、气短、血氧饱和度下降,18F-FDG PET/CT示双肺多发磨玻璃、斑片及实变影,以中上肺、中央带分布为著,实变者内见支气管充气影,病灶代谢不同程度增高,SUVmax为9.7,最终临床诊断肺孢子菌肺炎,混合巨细胞病毒感染,予复方磺胺甲恶唑、更昔洛韦、泼尼松治疗后,患者症状缓解、肺部阴影消失。
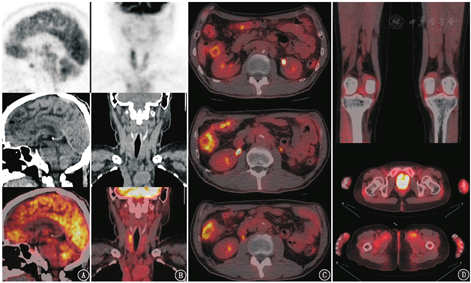
18F-FDG PET/CT上常见到的irAEs还有免疫相关性垂体炎(图5A)、甲状腺炎(图5B)、结肠炎(图5C)、关节炎(图5D)等。需要注意的是irAEs容易出现在治疗后2~3个月,但有时也可以延迟至近2年后出现,且停止治疗后仍可进展[11]。

以ICIs为代表的肿瘤免疫治疗迅猛发展,改变了肿瘤治疗的格局。相较于传统的化疗、放疗、靶向治疗,肿瘤的免疫治疗伴随的特殊的治疗反应和不良反应值得我们关注、学习,以期更有力地帮助临床进行准确的疗效评价、帮助临床制定治疗决策。
所有作者均声明不存在利益冲突


























