
患者女,31岁,体检发现腹腔肿物1个月余。外院增强MRI提示肝门部类圆形长T1、长T2信号占位,弥散加权成像(diffusion weighted imaging, DWI)呈稍高信号,边界清晰,增强扫描病灶呈延迟强化。为明确病变性质行18F-FDG PET/CT显像,结果示肝门区略低密度的类圆形孤立性占位,边缘光滑,代谢活性明显增高(图1)。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,31岁,体检发现腹腔肿物1个月余。外院增强MRI提示肝门部类圆形长T1、长T2信号占位,弥散加权成像(diffusion weighted imaging, DWI)呈稍高信号,边界清晰,增强扫描病灶呈延迟强化。为明确病变性质行18F-FDG PET/CT显像,结果示肝门区略低密度的类圆形孤立性占位,边缘光滑,代谢活性明显增高(图1)。
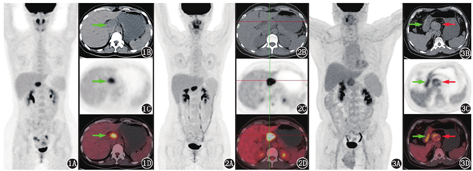

肝门区组织结构成分复杂,除了穿行的胆管及血管,还有神经、淋巴及脂肪等,这些组织成分均可形成占位性病变。此外,邻近肝门的肝脏占位也容易延伸至肝门区。因此,对于肝门区占位的诊断,首要任务是准确定位病变。病变定位不同,其鉴别诊断的思路不同。该患者肝门区占位与肝脏、胆管及邻近动静脉分界清晰,与邻近肝尾状叶的夹角也为锐角,因此主要考虑来自神经组织、淋巴组织及其他结缔组织的常见占位性病变。明确定位之后,分析患者病变的代谢情况。该病变18F-FDG代谢明显增高,淋巴结来源的淋巴瘤、Castleman病、淋巴结结核、恶性病变淋巴结转移,神经组织来源的神经鞘瘤及神经纤维瘤、副神经节瘤,间叶组织来源的肉瘤都可以是这种代谢程度。下面进行具体的鉴别诊断分析。
(1)淋巴瘤。本例肝门区病变为单发孤立性病变,在全身其他部位没有淋巴结或结外器官受累的情况下,诊断淋巴瘤的证据不足。
(2)间叶组织肿瘤。间叶组织来源的恶性肿瘤多表现为团块状肿物,可见分叶,一般无包膜,内部密度不均匀,与本例的影像表现不相符。
(3)淋巴结结核。腹腔淋巴结结核多与胃肠道结核累及有关[1],如图2。其结核菌多来源于呼吸道结核菌的吞咽,进入肠道的结核菌大部分在回盲部及十二指肠被吸收,故腹腔淋巴结结核最常累及回盲部及十二脂肠淋巴引流区域的淋巴结,在影像学上的典型表现为多发淋巴结肿大,可伴钙化、坏死,增强CT图上呈环形强化,18F-FDG代谢可不同程度地增高,可伴中央减低区。本例患者肺内及胃肠道均无明确结核感染的证据,且肝门区病变孤立,边界清晰,内部密度均匀,也不符合淋巴结结核的典型表现。
(4)淋巴结转移。诊断淋巴结转移最主要的是找到肿瘤原发灶(图3)。由于部分胃肠道及肝胆肿瘤18F-FDG代谢不高,病灶隐匿,需要重点观察这些部位是否有肿瘤性病变来辅助鉴别。本例患者肝胆系统及周围消化道均未见明确肿瘤性病变,因此排除淋巴结转移。
(5) Castleman病。文献报道70%~96%的单中心型Castleman病为透明血管型,CT增强扫描时病灶明显均匀强化,18F-FDG代谢则表现为轻度增高[2,3,4],如图4。本例患者增强MRI表现为轻度延迟强化,而18F-FDG代谢明显增高,与单中心型Castleman病的典型影像学表现不符,因此该患者单中心型Castleman病的可能性较小。


(6)副神经节瘤。副神经节瘤是一种神经内分泌肿瘤,可以分布在交感神经或副交感神经系统的任何部位。腹部副神经节瘤(图5)多起自交感神经系统,半数以上为有功能型(儿茶酚胺分泌过多),典型的高血压症状及血、尿儿茶酚胺增高有利于诊断。但也有部分患者为生化沉默型(血、尿儿茶酚胺正常,无高血压),其诊断相对困难。副神经节瘤的18F-FDG代谢活性差异很大,显像剂摄取程度与肿瘤的良恶性并无明显相关,而与是否存在琥珀酸脱氢酶(succinate dehydrogenase, SDH)基因SDHx突变有关[5]。因为SDHx突变会导致SDH失活,从而中断三羧酸循环,使肿瘤细胞能量代谢途径转变为糖酵解。糖酵解是一种低效的能量生成途径,为了维持肿瘤细胞所需能量,肿瘤细胞只能大量地摄取葡萄糖,因此SDHx突变相关的副神经节瘤病灶18F-FDG摄取程度较高[6]。
(7)神经鞘瘤或神经纤维瘤。神经鞘瘤是神经源性良性肿瘤,可发生在身体的任何部位,其中以四肢屈肌区、头颈部、腹膜后间隙及脊神经被根处(脊柱两旁)最常见(图6),可单发或多发(图7)。位于椎旁者一般可观察到病灶与神经根相连,但位于其他部位时,由于神经末梢细小或周围结缔组织的遮挡,一般无法观察到病变与神经组织的关系而表现为孤立性病变,这给诊断造成一定的困难。


最终,综合病变的影像特征——形态规则,边界清晰似有包膜,内部密度均匀,增强扫描轻度强化,考虑神经源性良性肿瘤可能性大。患者后行肝门区占位切除,术后病理诊断为神经鞘瘤。神经鞘瘤在组织学上由Antoni A区(富含细胞区)和Antoni B区(黏液区)组成,肿瘤有完整包膜。由于富含大量排列致密的梭形细胞,Antoni A区的密度和T1加权成像(weighted imaging, WI)信号往往接近肌肉组织,T2WI呈稍高信号,增强扫描强化明显并且延迟强化;而Antoni B区细胞成分稀疏,黏液基质成分多,易伴发各种退行性变(出血、坏死、囊变、营养不良性钙化),因此在CT上密度低甚至呈液性密度,T1WI呈低信号,T2WI呈高信号,增强扫描强化亦不明显。Antoni A区和Antoni B区以不同比例交替分布,从而导致肿瘤在CT和MRI上表现各异,缺乏特异表现[7]。虽然神经鞘瘤是良性肿瘤,但其可以表现为18F-FDG高摄取,并且摄取程度有较大差异,文献报道神经鞘瘤的SUVmax在1.5~17.3不等[7,8]。其18F-FDG代谢增高程度可能与Antonia A区所占比例相关,而与肿瘤细胞增殖核抗原Ki-67指数不相关[9]。
因为良性神经鞘瘤的18F-FDG代谢可以明显增高,其与恶性神经鞘瘤的鉴别就显得较为困难,两者的SUV有明显的重叠[10,11]。恶性神经鞘瘤是指起源于外周神经或神经外组织,具有神经鞘分化的恶性肿瘤,50%以上与Ⅰ型神经纤维瘤病相关,通常由丛状神经纤维瘤恶变而来;40%左右散发;10%继发于放疗,罕见由神经鞘瘤恶变而来[12]。恶性神经鞘瘤侵袭性高,早期诊断并完整切除肿瘤是目前最有效的治疗手段。一般来说,当肿瘤体积较大(多大于5 cm)、形态不规则、肿瘤呈分叶状改变、坏死囊变多见、伴瘤周水肿及周围组织侵犯时,要考虑恶性神经鞘瘤的可能性[7,13]。
本例为肝门区孤立性占位,初看病变很简单,但涉及多种鉴别诊断,很难仅凭病灶代谢来鉴别良恶性,要全方位考虑、仔细甄别,掌握不同病变的特征表现,方能正确诊断。
所有作者声明无利益冲突


























