
多种恶性肿瘤的免疫治疗药物正进入临床应用,为治疗方法提供了重要补充。这些药物通过调节肿瘤微环境来增强整体免疫应答,但同时也会导致非常规的反应模式,这对影像学检查可有效评判治疗效果这一传统认识提出了挑战。越来越多的证据表明,有效的抗肿瘤免疫需要初级和次级淋巴组织发动全身免疫反应来完成。但是全身免疫反应的增强会破坏健康组织的免疫稳态,导致不良事件的发生。通过组织和液体活组织检查,可以更好地了解肿瘤和全身免疫反应之间复杂的相互作用。然而,这些方法的适用性受到相关过程中生物、空间和时间异质性的限制。因而,分子影像学技术的应用引起了广泛的关注。随着指南的不断完善和新证据的出现,人们对18F-FDG PET/CT在反应评估中的作用有了更多的认识。这种无创技术能够用以研究整体免疫应答的生物学基础,以最大程度挖掘治疗潜力。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
利用免疫系统来摧毁癌细胞是肿瘤学中一种不断发展的治疗方法。对抗肿瘤免疫调节中肿瘤微环境与不同类型细胞间复杂的相互作用的研究,为制定肿瘤治疗策略奠定了基础。这种反应的关键是树突状细胞识别和呈递肿瘤相关抗原,启动和激活外周免疫细胞,转移免疫细胞并使T细胞浸润到肿瘤微环境中,从而使肿瘤细胞识别并发生免疫介导的细胞死亡[1]。针对这个过程中不同要素的治疗策略表现出了良好的临床效果,包括作为免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)的单克隆抗体(简称单抗),特别是抗细胞毒性T淋巴细胞抗原4(anticytotoxic T-lymphocyte antigen 4, anti-CTLA-4)和抗程序性死亡受体1及其配体(antiprogrammed death receptor 1 and its ligand, anti-PD-1和anti-PD-L1)[2]。Anti-CTLA-4药物主要引起淋巴结中T细胞启动和扩增,但是anti-PD-1和anti-PD-L1药物主要阻断T细胞上PD-1和肿瘤细胞上PD-L1之间的免疫抑制相互作用。这些完全不同的作用机制,部分地解释了临床观察到的不同反应模式。此外,越来越多的证据表明,有效的抗肿瘤免疫应答需要通过提高应答整体性来实现,包括次级淋巴组织如淋巴结和脾脏的参与[3]。
对于目前所采用的免疫治疗,部分患者有完全和持久的反应,但大多数患者没有反应,这就需要建立新的反应预测指标和明确耐药机制。大量临床试验证据表明,传统的形态学成像评估法在非常规反应中有缺陷,这使得基于CT或MRI的反应评估标准被修改[4]。分子成像可以在治疗过程中对整体免疫应答进行无创监测。尽管免疫PET通过直接靶向细胞特异(谱系)靶点或活化标志物的显像剂,能够帮助我们理解免疫系统,但其依然处在发展阶段。尽管存在挑战,但18F-FDG PET/CT的应用价值被日益明确和完善,这种技术已在全球范围内广泛使用。本篇综述旨在概述18F-FDG PET/CT在肿瘤的和全身的免疫反应监测中的应用现状。由于形态学影像检查在系统监测免疫治疗反应方面存在局限性,笔者将探讨18F-FDG PET和PET/CT在监测整体免疫应答方面的优势。在另一篇综述中,将介绍更具特异性的、可能对18F-FDG PET/CT发挥补充作用的分子探针的应用。
1.糖酵解:免疫激活的标志。Warburg效应阐明了肿瘤细胞的代谢重整:主要依赖糖酵解代谢[5]。这一机制为18F-FDG PET/CT在肿瘤中的应用奠定了基础。有氧糖酵解虽然与肿瘤细胞生长和增殖有关,但越来越多的证据表明其也是免疫细胞激活和分化中的关键过程[6]。在抗原诱导激活之后,代谢决定了免疫细胞的存亡[7]。T细胞,尤其是细胞毒性CD8亚型,在免疫应答中快速从分解代谢状态(初始和记忆T细胞)变为生长和增殖状态(效应T细胞)[8,9]。葡萄糖通过葡萄糖转运蛋白-1(T细胞和癌细胞上主要的葡萄糖转运蛋白)被输送到T细胞[10]。将肿瘤细胞、肿瘤基质和浸润的免疫细胞对肿瘤部位代谢特征的不同贡献进行反卷积,对准确的反应评估提出了挑战,并促使传统的反应标准得到改良。18F-FDG PET/CT在非肿瘤组织中的摄取可能是免疫相关不良反应(immune-related adverse events, irAEs)的表现,也可以帮助我们理解机体对肿瘤免疫治疗的全身免疫反应。
下面,笔者对大规模形态学成像临床研究,结合不断积累发展的18F-FDG PET/CT临床经验进行讨论。
2.假性进展:形态学成像的经验。在1项涉及227例晚期黑色素瘤患者的Ⅱ期研究中,anti-CTLA-4(伊匹单抗)治疗的初步经验显示有4种不同的反应模式[11]。其中包括:基线病灶的反应在12周明显,并且没有新的病灶出现;疾病稳定,部分患者后续肿瘤总负荷缓慢而稳定地下降;肿瘤总负荷初始增加,后出现治疗反应;在12周以后,新病灶出现时或出现后肿瘤总负荷降低(图1)。前2种反应模式符合常规反应标准,但后2种被视为非常规的,并被定义为假性进展。假性进展人群约占该研究队列的10%,其生存率明显优于无反应者,这就引出了常规形态学进展之外的概念。该研究强调了肿瘤负荷在免疫相关反应评估标准中的重要性,因为即便在计算病灶最大径时纳入了新病灶,部分患者的肿瘤负荷净效应也可能是降低的。


ICI种类可能会影响假性进展的发生,在anti-PD-1/PD-L1治疗中假性进展的报告率比在anti-CTLA-4中低。在KEYNOTE-001研究中,行帕博利珠单抗(anti-PD-1)治疗的晚期黑色素瘤患者亚组假性进展率为7.3%,比相同标准下的伊匹单抗治疗后假性进展率低[12]。在2/3的病例中,假性进展于12周前(早期)就能被观察到,而1/3的病例假性进展发生在12周后(延迟),这可能会影响早期反应评估的时间和解释。
假性进展率似乎也因肿瘤类型的不同而不同。1项临床试验的回顾性分析显示,在使用阿特珠单抗(anti-PD-L1)的800多例不同恶性肿瘤患者中,黑色素瘤患者的假性进展率高于非小细胞肺癌(non-small cell lung cancer, NSCLC)患者,分别为7.3%及2.3%~2.8%[13]。该报告中,在开始使用阿特珠单抗后90 d内进行评估时,只有靶病灶大小的暂时性增加被认为是假性进展。初始靶病变进展后有消退的患者比后续没有消退的患者总生存期长。此外,与靶病灶有初始进展的患者相比,既往病灶无进展但新病灶有初始进展的患者总生存期相似或更短。因此,无论原有病变是否发生改变,形态学影像上出现新的病变仍具有临床意义。
3.假性进展:18F-FDG PET/CT能做什么?18F-FDG PET/CT评估免疫治疗效果的最佳时间仍不能确定。对治疗反应进行早期分层,有利于最大程度降低ICIs的毒性并减少不必要的经济负担。18F-FDG PET/CT对靶向治疗后早期代谢反应的评价较形态学成像具有显著优势[14],但将这一概念外推到ICIs具有挑战性。在1项初步研究中,20例晚期黑色素瘤患者以anti-CTLA-4治疗为主,1个月时实体瘤治疗疗效PET评价标准(PET response criteria in solid tumors, PERCIST)预测最佳整体反应的准确性低于实体瘤治疗疗效评价标准(response evaluation criteria in solid tumors, RECIST)1.1[15]。通过结合RECIST和PERCIST设计了一套新的标准,即早期预测ICI治疗反应的PET/CT标准,其被证实比RECIST或PERCIST具有更高的准确性(表1和表2)。PET的增值作用在于对RECIST提示疾病稳定但18F-FDG摄取提高了至少15%的患者进行再分类。推测这种摄取增高反映了肿瘤微环境中免疫细胞的浸润或激活。另一项研究表明,在NSCLC患者经anti-PD-L1 ICI(阿特珠单抗)治疗后第6周,18F-FDG PET/CT与CT在评估反应方面没有明显差异[16]。然而,在CT显示疾病稳定的患者中,全身肿瘤代谢体积(whole-body metabolic tumor volume, wbMTV)的增加与较差的生存结局相关,这表明18F-FDG PET/CT代谢参数具有增值作用。

免疫治疗18F-FDG PET反应评估标准——PECRIT、PERCIMT和imPERCIST
免疫治疗18F-FDG PET反应评估标准——PECRIT、PERCIMT和imPERCIST
| 参数 | PECRIT[15] | PERCIMT[17] | imPERCIST 5[18] |
|---|---|---|---|
| 肿瘤类型 | 黑色素瘤 | 黑色素瘤 | 黑色素瘤 |
| ICI | Anti-CTLA-4 | Anti-CTLA-4 | Anti-CTLA-4 |
| n | 20 | 41 | 60 |
| 时间 | 3~4周 | 3个月 | 3个月 |
| 参考标准 | 临床获益:4个月时PR或CR或SD≥6个月,根据RECIST 1.1[45] | 临床获益:综合临床随访、18F-FDG PET/CT、脑MRI和LDH结果 | 随访和总生存 |
| 反应定义 | CR或PR:根据RECIST 1.1 | CR: PE、18F-FDG PET/CT和脑部MRI检查示所有病灶消退;LDH下降或不上升;无新病灶 | CR、PR或SD:根据PERCIST,5个病灶 |
| PR: PE、18F-FDG PET/CT和脑部MRI检查示病灶减小或消退;LDH下降或不上升;无新病灶 | |||
| SD:根据RECIST 1.1和SULpeak增加15.5%(RECIST)[46] | SD:既未CR/PR,又无PD | ||
| 进展定义 | 根据RECIST 1.1 | 无临床获益和18F-FDG PET/CT提示新病灶,如下: | 5个病灶的SULpeak总和变化>30% |
| <1 cm的新病灶≥4个 | |||
| 1~1.5 cm的新病灶≥3个 | 新病灶可合并 | ||
| >1.5 cm的新病灶≥2个 | |||
| 重点和优势 | 结合解剖和代谢标准 | 将临床获益纳入标准 | 新病灶被纳入病灶代谢活性的总和,不立即视为PD |
| 早期反应评估 | 18F-FDG PET/CT上新病灶的数量和代谢的大小 |
注:Anti-CTLA-4为抗细胞毒性T淋巴细胞抗原4;CR为完全缓解;imPERCIST为免疫治疗改良实体瘤治疗疗效PET评价标准(PERCIST);LDH为乳酸脱氢酶;PD为疾病进展;PE为体格检查;PECRIT为早期预测免疫检查点抑制剂(ICI)治疗反应的PET/CT标准;PERCIMT为免疫治疗PET反应评价标准;PR为部分缓解;RECIST为实体瘤治疗疗效评价标准;SD为疾病稳定;SULpeak为瘦体质量校正的SUV峰值(SUVpeak)

免疫治疗18F-FDG PET反应评估标准——LYRIC和iPERCIST
免疫治疗18F-FDG PET反应评估标准——LYRIC和iPERCIST
| 参数 | LYRIC[19,20] | iPERCIST[22] |
|---|---|---|
| 肿瘤类型 | HL | NSCLC |
| ICI | Anti-PD-1 | Anti-PD-1 |
| n | 16 | 28 |
| 时间 | 3个月 | 2个月 |
| 参考标准 | 基于临床和影像学结果的多学科专家共识 | 临床获益且4周后18F-FDG PET/CT或CT证实 |
| 反应定义 | CR或PR:根据Lugano[21] | CMR、PMR或SMD:根据PERCIST |
| 进展定义 | 根据Lugano,但有以下例外: | PMD(根据PERCIST)被认为是UPMD |
| IR1:前12周SPD增加≥50% | ||
| IR2a:新发病灶SPD增加<50% | UPMD需要4~8周后第2次18F-FDG PET/CT确认,才能归类为CPMD | |
| IR2b: SPD增加<50%,治疗期间任何时间病灶或1组病灶PPD增加≥50% | ||
| IR3: 18F-FDG摄取增加,但没有伴随病灶大小增加,符合PD标准 | ||
| 重点和优势 | 在活组织检查或随后的影像学检查证实假进展或真进展之前,先引入IR类别的概念 | 介绍具有临床稳定性的UPMD概念 |
| 允许继续治疗 |
注:Anti-PD-1为抗程序性死亡受体1;CMR为完全代谢反应;CPMD为确定的疾病代谢进展;HL为霍奇金淋巴瘤;iPERCIST为实体瘤免疫治疗疗效PET评价标准;IR为不确定反应;LYRIC为淋巴瘤免疫治疗反应标准;NSCLC为非小细胞肺癌;PMD为疾病代谢进展;PMR为部分代谢反应;PPD为垂直直径的乘积;SMD为疾病代谢稳定;SPD为直径乘积之和;UPMD为未确认的PMD
为解释18F-FDG PET/CT所示新病灶的短暂出现(假性进展),有学者设计了新的评估标准,即免疫治疗PET反应评价标准,该标准纳入了新出现病灶的数量和大小[17]。当新病灶增大,而病灶数量减少时,患者死亡风险需要进一步评估(表1和表2)。而且,在有反应和无反应患者之间,肿瘤组织摄取18F-FDG的变化没有明显差异。
相比之下,另一试图解释假性进展的研究将重点放在18F-FDG摄取的强度上(表1和表2)[18],该研究采用5个病灶的18F-FDG摄取之和(根据PERCIST)的变化值来评价疾病进展,结果示新病灶并未很快表现出进展。这一标准被称为改良的免疫治疗PERCIST 5,研究将其与使用1或5个病灶的PERCIST进行比较。按上述3种方法进行治疗反应评估,18F-FDG PET/CT示有反应患者的2年生存率均有明显提升。
2项关于霍奇金淋巴瘤的研究强调了肿瘤类型在非实体瘤免疫治疗反应评估中的重要性[19,20]。在这2项研究中,基于Lugano标准进行修改的淋巴瘤免疫治疗反应标准被应用在anti-PD-1治疗开始后约3个月。该标准仅在进展的定义上有所不同,并引入了不确定反应类别(需要活组织检查或后续成像来确认或否定进展)的概念(表1和表2)[21]。1项涉及45例患者的多中心研究示,在3个月时反应不确定的16例患者随后均被证实疾病进展[20]。淋巴瘤免疫治疗反应标准和Lugano标准是一致的,都可以预测疾病进展。疾病进展不确定或反应不明确(需进一步确认)这2个概念已被用于实体瘤的形态学成像[4]。在一项针对28例接受纳武单抗治疗的NSCLC患者的研究中,通过应用上述概念,也设计了免疫PERCIST(表1和表2)[22]。在13例疾病代谢进展不确定的患者中,只有4例临床情况稳定,可以在4周后接受后续验证性研究;其余9例因病情恶化而停止免疫治疗。这些研究加强了我们对18F-FDG PET/CT在评估反应中所面临挑战的理解,但目前的证据主要来自于患者数量有限的单中心研究。因此,在不断增加的免疫治疗适应证和策略中,这些标准的外推和验证应当谨慎。
总之,由于假性进展不常见,在按形态学或常规分子影像标准确定为进展后,应当谨慎决定是否继续行免疫治疗,需要考虑患者的毒性反应,以及相关症状在治疗后是否改善或稳定。如果病情稳定,可以考虑对新病变进行随访或组织学评估。由于早期的治疗决策主要基于临床,治疗期间早期成像的重要性有待商榷,除非可获得有预后或治疗意义的其他信息。早期成像的关键作用可能在于识别超进展和irAEs。
4.初始响应阶段中的18F-FDG PET/CT监测。免疫治疗的一个主要特点是其有可能在部分晚期癌症患者中实现持久,有时甚至是完全的反应[23,24]。这种新的反应模式对在疾病进展前或出现毒性前持续治疗的传统观念提出了挑战。其对于持续监测时间也具有意义。持久反应没有标准的定义,且疾病完全缓解情况下的最佳治疗持续时间仍有待确定[25]。在1项回顾性研究中,104例晚期黑色素瘤患者在治疗1年时被认为有反应。其中CT显示28%的患者完全缓解,66%部分缓解,6%稳定;而18F-FDG PET/CT显示75%的患者完全代谢缓解,16%部分代谢缓解,9%代谢稳定或代谢进展。在CT显示部分缓解的患者中,有68%被观察到完全代谢缓解,并且几乎所有完全代谢缓解的患者(96%)对之后的治疗有持续反应(图2)[26]。18F-FDG PET/CT比CT能更好地预测长期预后。这一发现可能会降低影像监测的频度和持续时间,降低成本并减轻长期监测带来的焦虑。获得完全缓解患者的最佳监测模式,以及18F-FDG PET/CT显像能否比CT更早实现监测停止,尚需要进一步的研究来确定。18F-FDG PET/CT的另一个潜在作用是在全身反应的情况下识别寡转移部位,这可能有助于指导包括手术或放疗等在内的局部治疗。


5.评估可能的超进展。在免疫治疗开始后,部分患者肿瘤生长异常加速,这被称为超进展。所有超进展相关报道都涉及anti-PD-1或anti-PD-L1治疗,观察率为4%~29%[25]。虽然这一现象的机制尚不清楚,但1项临床前研究表明,超进展与肿瘤相关巨噬细胞通过与anti-PD-1相互作用进行重编程相关[27]。目前,对于超进展还没有统一的定义。现在主要通过监测肿瘤大小、体积、肿瘤生长动力学或治疗失败的时间等来评估肿瘤生长速率[25]。
与进展患者相比,超进展患者的生存率更低[28]。因此,早期准确识别超进展对于及时更换有效治疗方法或停止现有治疗具有重要的临床意义。有研究在50例接受anti-PD-1 ICI治疗的NSCLC患者中评估了18F-FDG PET/CT的潜在作用[29]。在该研究中,肿瘤的超进展与基线wbMTV相关;多因素分析示wbMTV是总生存的独立预测因子。尽管这一发现还有待进一步验证,但wbMTV增加较其稳定或降低更利于超进展可能性的判断,特别是在患者临床状态稳定或改善的情况下。
6.18F-FDG PET/CT评估形态学成像上的混合反应或寡进展。既往研究显示,有些患者出现了混合或差异反应,这表明部分病灶有免疫反应而部分病灶没有[30]。这种反应模式与先前在细胞毒性或靶向治疗中提到的反应模式并无不同[31]。原发性难治性和继发性耐药性可能反映了免疫逃逸的不同机制(图3)。可能的原因之一:基因组不稳定的肿瘤通过致癌基因突变或肿瘤抑制基因缺失而上调PD-L1,从而抑制了效应T细胞的功能[32]。在NSCLC anti-PD-1或anti-PD-L1治疗中,分离反应率约为8%[30]。但这方面可用的数据有限,可能是由于传统的RECIST标准所限。18F-FDG PET/CT在这方面的潜在优势在于:在其他病变部位有代谢缓解的情况下,发现CT提示残留病灶的持续高代谢活性,尤其适合局部挽救性治疗。


7.18F-FDG PET/CT半定量参数的作用。在几种晚期恶性肿瘤的细胞毒性治疗中,wbMTV等18F-FDG PET/CT代谢参数已被证实是判断预后的重要指标[33]。尽管作用机制不同,但其对于免疫治疗的预后判断同样有意义[34,35]。在1项纳入行anti-PD-1抑制剂治疗的55例黑色素瘤患者的研究中,多因素分析显示18F-FDG PET/CT的基线wbMTV与较短的总生存期有关[34]。另一项研究也有一致的发现:在接受CTLA-4抑制剂治疗的142例黑色素瘤患者中,wbMTV具有独立的预后预测作用[35]。这些研究表明,wbMTV是一种有前景的预后指标,可以改变治疗前的风险分层。然而,需注意到仍存在一些挑战,例如,技术方法的标准化、勾画肿瘤软件的可用性以及肿瘤高负荷与低负荷的阈值确定等。
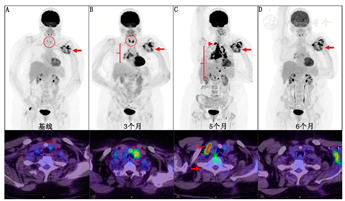
在免疫检查点抑制治疗后,细胞毒性T淋巴细胞最初的募集和扩增发生在淋巴结中,可能表现为新发的全身或引流区域淋巴结的18F-FDG高摄取[36]。在使用伊匹单抗治疗黑色素瘤时,所有18F-FDG PET/CT显像示新发纵隔或肺门淋巴结高摄取(结节样淋巴结病)的患者,都表现出明显的临床获益(图4)[37]。在临床前研究和临床研究中观察到脾和骨髓中免疫细胞组成的动态变化,这会转化表现为18F-FDG PET/CT骨髓代谢活性的增强[38]。这些治疗前后观察到的变化可能有助于预测ICIs治疗是否有效[38]。例如,研究表明18F-FDG PET/CT骨髓代谢的基线增加与黑色素瘤较短的总生存期独立相关[34]。在该研究中,增高的骨髓代谢与调节性T细胞标志物等转录组谱有关。这些结果的应用价值有待进一步的转化和临床研究验证。

免疫治疗策略会破坏健康器官的免疫稳态,并导致炎性不良反应,这通常被称为irAEs。irAEs可能会影响体内的任何器官,现有不同免疫疗法会产生不同的不良反应[39]。例如,结肠炎和垂体炎在anti-CTLA-4中治疗常见,而肺炎和甲状腺炎似乎在anti-PD-1药物的使用中更常见,联合用药则会导致不良反应发生更早和发生率更高[39]。事实上,irAEs发生率可能与ICIs联合用药带来的患者客观缓解率相当,并可能导致严重或长期的器官功能障碍甚至死亡[40]。在缺少判断"金标准"的情况下,临床、生化、组织病理学和影像学等多种技术可能有助于部分irAEs的检测。
病理生理学研究显示,irAEs似乎具有器官特异性[39],但主要涉及免疫介导的T细胞的激活和浸润[40],这使得18F-FDG PET/CT或细胞特异性药物(如抗CD8显像剂)有可能在临床表现出现前检测到这些不良反应。然而,由于缺乏有关影像表现的系统研究,分子影像技术,尤其是18F-FDG PET/CT在监测irAEs中的作用可能在很大程度上被低估[41,42,43]。18F-FDG PET/CT的潜在效用,如其与这些不良反应发生时间、临床表现和严重程度的关联等,需要进一步的研究来证实。
由于18F-FDG PET/CT应用的普及,越来越多的研究使用其评估肿瘤治疗反应,以及监测全身免疫激活过程,包括免疫治疗对非肿瘤部位的影响。这些研究试图解决形态学成像的局限性,但也显示出18F-FDG PET/CT在准确监测反应方面仍面临问题,如评估反应的最佳时机、不同类型的免疫治疗和肿瘤类型的影响,对新发病灶的解读以及参数的设立等,在这些方面尚无确定的答案。为追求理想目标,要仔细考量大规模临床试验的结果和涉及18F-FDG PET/CT应用的经验。18F-FDG PET/CT仍然是临床实践中最常用的分子成像技术,在免疫治疗中具有价值,其可以早期识别治疗失败、肿瘤总负荷的变化和免疫相关的炎性改变,同时最大限度地减少过早放弃其他有效治疗的情况。
尽管18F-FDG摄取活性通常是肿瘤生物学行为因素(包括增殖、乏氧和炎性反应等)的综合体现,但如假性进展所示,虽然18F-FDG在肿瘤部位的活性增加,但其显示出的免疫浸润和激活可能预示着良好的预后。因此,18F-FDG对免疫系统特定成分的成像能力,可以为这个复杂和动态的过程提供重要的信息。已有大量临床前研究致力于开发靶向免疫反应成分生物学特性的新示踪剂。最近的1项研究,综述了可用于选择和监测免疫疗法的探针[44]。在另一篇综述中,笔者将讨论那些正进入临床试验,或具有选择和监测免疫治疗的、可作为18F-FDG PET/CT补充的分子探针,并探讨其在临床实践中可能发挥的价值。



























