
患者女,69岁,因无明显诱因出现胸痛1个月就诊。胸、腹、盆部CT平扫检查发现双肺多发磨玻璃及斑片影,右侧腋窝、纵隔、腹膜后多发肿大淋巴结,多发颈胸腰椎椎体及双侧多根肋骨密度不均;血肿瘤标志物未见异常。患者既往有子宫肌瘤及甲状腺功能减低病史,目前甲状腺激素替代治疗中。因发现肺、淋巴结、骨多发病变,临床怀疑恶性肿瘤可能,遂行18F-FDG PET/CT显像以明确病变性质及分期。18F-FDG PET/CT显像(图1)见双肺多发代谢轻度增高的磨玻璃及斑片影,边界不清,SUVmax 4.0;全身多发代谢增高淋巴结,累及左颈根部、双侧锁骨上、右腋下及胸肌深面、纵隔及双肺门、腹膜后、双侧髂血管旁,淋巴结最大者短径1.6 cm,SUVmax 15.9;扫描野内骨骼大量代谢增高灶,CT上密度不均,SUVmax 12.6,累及脊柱、骨盆、肋骨、胸骨、双侧肱骨、双侧肩胛骨、双侧锁骨、双侧股骨。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,69岁,因无明显诱因出现胸痛1个月就诊。胸、腹、盆部CT平扫检查发现双肺多发磨玻璃及斑片影,右侧腋窝、纵隔、腹膜后多发肿大淋巴结,多发颈胸腰椎椎体及双侧多根肋骨密度不均;血肿瘤标志物未见异常。患者既往有子宫肌瘤及甲状腺功能减低病史,目前甲状腺激素替代治疗中。因发现肺、淋巴结、骨多发病变,临床怀疑恶性肿瘤可能,遂行18F-FDG PET/CT显像以明确病变性质及分期。18F-FDG PET/CT显像(图1)见双肺多发代谢轻度增高的磨玻璃及斑片影,边界不清,SUVmax 4.0;全身多发代谢增高淋巴结,累及左颈根部、双侧锁骨上、右腋下及胸肌深面、纵隔及双肺门、腹膜后、双侧髂血管旁,淋巴结最大者短径1.6 cm,SUVmax 15.9;扫描野内骨骼大量代谢增高灶,CT上密度不均,SUVmax 12.6,累及脊柱、骨盆、肋骨、胸骨、双侧肱骨、双侧肩胛骨、双侧锁骨、双侧股骨。
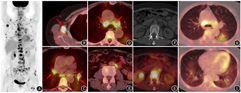

本例病变累及全身淋巴结、骨、肺,恶性病变考虑血液系统肿瘤及实体瘤转移,良性病变则主要鉴别结核等全身播散性感染性疾病。因骨骼病变分布随机,未见多个椎体连续性病变或累及椎间盘,亦未见椎旁脓肿形成,骨骼病变未见骨破坏区周围的反应性硬化带或死骨形成,影像上暂无支持结核等感染性疾病的依据,因此首先考虑恶性病变,主要鉴别血液系统肿瘤和实体瘤转移。仔细观察淋巴结形态,可见纵隔及部分腹膜后淋巴结中央有低密度区,部分淋巴结之间有融合;纵隔和肺门淋巴结以气管周围淋巴结受累为主,而淋巴瘤更容易累及的前纵隔区域受累不明显;淋巴结虽累及全身多个淋巴结区,但没有超过2 cm以上或形成大肿物;再看骨的病变,血液系统肿瘤主要为骨髓弥漫性或局灶性浸润,相较实体瘤而言较少对骨质造成破坏,而本例骨骼病变多处可见骨质密度异常。从上述特点来看比较支持实体瘤转移,而血液系统肿瘤的特征较少。若考虑实体瘤淋巴结转移、骨转移,而PET/CT未见明确的原发灶提示(双肺多发边界不清的磨玻璃及斑片影,更像炎性病变而非肿瘤),则要从隐匿性原发肿瘤转移的方向去考虑。
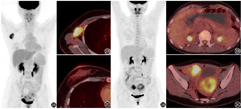
PET/CT上转移灶明确且代谢高,而原发灶"隐匿"的情况并不十分罕见,主要原因是原发灶比较小,阅片时可能被忽略;或原发灶位于周围本底摄取较高的区域,被"掩盖"了;再或者原发灶和转移灶的分化或某些病理特征不同,代谢程度有较大差异。这时,一要仔细观察有较高本底摄取的脏器或部位并采集相关病史,来除外此处肿瘤发生转移(如泌尿系统[1]、肠道、肝脏、口咽部等);二要根据转移模式和病理类型推定可能的原发灶,如出现锁骨上淋巴结转移或腋窝淋巴结转移或骨转移的腺癌需要进一步筛查前列腺癌及乳腺癌,有腹膜转移或腹腔积液的腺癌需要警惕泌尿生殖系统、胰腺及胆道系统原发肿瘤,有肝脏转移的腺癌需进一步检查消化道系统、胰腺及胆道系统、乳腺来源的肿瘤,全身多发转移的腺癌需重点考虑前列腺癌及乳腺癌,头颈部淋巴结或锁骨上淋巴结转移的鳞状细胞癌(简称鳞癌)需重点关注头颈部肿瘤,纵隔淋巴结转移的鳞癌需重点筛查非小细胞肺癌等。如图2为1例右侧腋窝淋巴结转移患者,临床高度怀疑乳腺癌转移,而PET/CT上乳腺未见异常代谢,CT也未见明确占位;随后乳腺超声见右乳内下象限乳腺影像报告和数据系统(breast imaging reporting and data system, BI-RADS) 4b级病变,患者遂行右乳肿物扩大切除术及右腋窝淋巴结清扫术,术后病理提示右乳低分化浸润性癌,伴右腋窝淋巴结转移。图3为1例胃癌伴双侧卵巢转移患者,PET/CT见双侧卵巢转移灶代谢明显增高,而胃壁代谢未见明显异常(胃镜见胃体大弯侧溃疡)。

本病例整体来看,膈上淋巴结较腹盆部淋巴结更多、更广泛,膈上淋巴结又以右腋窝及胸肌深面淋巴结更为突出且更有特征,这是乳腺癌最常见的淋巴引流途径,而其他区域受累淋巴结和骨转移也都可用乳腺癌来解释。部分乳腺癌在PET/CT上可以表现为代谢不高,并且当病灶较小时,CT上的密度及形态也不会有异常表现,所以综合考虑可能为右乳腺来源的恶性肿瘤。患者接受了腋窝淋巴结穿刺活组织检查(简称活检),病理检查发现瘤细胞,免疫组织化学(简称免疫组化)检查示转录因子GATA3(+)、雌激素受体(estrogen receptor, ER;+)、孕激素受体(progesterone receptor, PR;+)、人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2;-)、新天门冬氨酸蛋白酶(Napsin A;-)、配对盒基因8(paired box gene 8, Pax8;-)、甲状腺转录因子1(thyroid transcription factor 1, TTF-1;-),结合免疫组化结果考虑为乳腺来源。患者也进行了乳腺钼靶、乳腺超声及乳腺MRI检查,除了双乳增生,均未提示其他异常。临床综合考虑隐匿性乳腺癌广泛转移,患者后续进行了内分泌治疗。
乳腺超声和钼靶检查是乳腺癌最常用的筛查手段,单用超声或钼靶对乳腺癌的检出率仅略高于50%,若将两者联合能将乳腺癌检出率提高至82%,如果再联合乳腺MRI,则乳腺癌检出率能达到90%左右[2]。PET/CT不常规用于乳腺癌筛查和诊断,主要在乳腺癌的分期、疗效评估及复发监测中应用。本例为原发灶不明的转移瘤,根据转移灶病理免疫组化结果诊断为乳腺癌。
原发灶不明的肿瘤指通过临床、影像学和内窥镜等标准化检查均不能发现原发灶的肿瘤,占所有恶性肿瘤的2.3%~5%,其中有近80%可通过免疫组化、分子学分型、基因型分析等方法对其原发灶进行推定,而其余20%的肿瘤则通过任何方法也无法获得其原发组织来源的线索[3,4]。此类肿瘤的发生机制尚未明确,目前存在2种假说:假说之一认为其都存在原发灶,只是原发灶过小或难以通过现有临床检测手段探查到,随着病程的进展或检测手段精度的提高,原发灶终将被发现;而另一假说则认为,原发灶不明的肿瘤是独立存在的一类特殊肿瘤类型,本身并不存在原发灶,所有原发灶不明肿瘤之间存在着生物学相似性[5]。
基于此类肿瘤的临床特征,患者常因出现转移灶相关的症状、体征就诊。在诊断和评估时最重要的是获得原发组织相关的线索,因此需要综合评估病史、肿瘤标志物、影像学、病理类型、免疫组化、基因表达谱等。大多数原发灶不明的肿瘤组织病理类型为腺癌(60%)及未分化癌(30%),而鳞癌和(或)移行细胞癌(5%~8%)、神经内分泌肿瘤(2%~4%)及肉瘤(1%左右)等相对较为少见[5,6]。最常出现原发灶不明的转移瘤的肿瘤是头颈部肿瘤、乳腺癌、前列腺癌、胰腺及胆道系统原发肿瘤,最常转移的部位包括淋巴结、骨、肝脏、肺等。
针对原发灶不明的肿瘤的治疗方案尚缺乏大型前瞻性临床试验提供确凿的证据。目前的诊治指南认为,如果能对患者肿瘤原发灶进行合理推定,则按照推定的原发灶进行相应治疗,其预后与相应类型原发灶明确的肿瘤预后相当[5,7];如果无法进行推定,则可先对患者进行预后分层,采取经验性化疗或姑息性化疗及其他支持性治疗。随着靶向治疗的发展,有根据原发灶不明的肿瘤的分子分型选择靶向治疗成功的个案报道,但尚未有靶向治疗的大规模队列研究得出明确结论[8,9,10,11,12]。也有研究使用免疫检查点抑制剂治疗原发灶不明的肿瘤,但仅有部分具有某些特定生物学标志物的患者可能从免疫治疗中获益[13]。
无论是PET/CT上隐匿的肿瘤还是临床上原发灶不明的肿瘤,其诊断都充满困难和挑战,因此在对这类患者进行评估时,仔细阅片、充分收集病史、综合实验室结果、影像学检查及病理学检查等至关重要。PET/CT作为一种评价全身肿瘤的影像学方法,虽然可能仍然无法探测部分原发灶,但能对转移的模式、范围、代谢活性进行整体评估,指导后续诊治措施,因而有重要意义,也是原发灶不明肿瘤诊疗指南所推荐使用的重要评估工具。
所有作者声明无利益冲突


























