
患者男,60岁,主诉性格改变、嗜睡5个月,加重伴视力下降2个月。患者5个月前出现情绪烦躁、易怒、言语减少、嗜睡,伴间断性头晕,未予特殊诊治。2个月前出现左眼视力下降,脾气更加暴躁,反应较前明显迟钝。头部增强MRI示左侧颞叶内侧、左侧基底节区、胼胝体、视交叉多发异常信号。外院曾考虑视神经脊髓炎(neuromyelitis optica, NMO)谱系疾病,予泼尼松及静脉丙种球蛋白治疗,未见好转。20余天前右眼视力下降,双眼均有胀痛感,头晕、嗜睡加重。复查头部增强MRI提示:左侧颞叶内侧、胼胝体、视交叉多发异常信号,T1加权成像(weighted imaging, WI)呈低信号,T2WI呈稍高信号,T2液体衰减反转恢复序列(fluid attenuated inversion recovery, FLAIR)呈高信号,信号较均匀,增强明显均匀强化(图1)。血WBC计数、红细胞沉降率、C反应蛋白、肿瘤标志物正常;血抗Ro-52抗体弱阳性(+),抗线粒体M2型抗体阳性(++),选择性结合水通道蛋白-4(-),白细胞介素(interleukin, IL)-6 2.4(括号内为正常参考值范围,下同;<5.9) ng/L,IL-10 36.1(<9.1) ng/L。行腰椎穿刺,脑脊液压力9.5 cmH2O(1 cmH2O=0.098 kPa),WBC计数10(0~8)×106/L,蛋白质、乳酸、免疫球蛋白(immunoglobulin, Ig)G寡克隆区带(oligoclonal bands, OB)(-),IgG合成率3.5(-9.9~3.3) mg/d,IL-6 6.8(<5.9) ng/L、IL-10 158.0(<9.1) ng/L,病原学(-),抗神经抗原抗体、抗神经节苷脂抗体(-)。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,60岁,主诉性格改变、嗜睡5个月,加重伴视力下降2个月。患者5个月前出现情绪烦躁、易怒、言语减少、嗜睡,伴间断性头晕,未予特殊诊治。2个月前出现左眼视力下降,脾气更加暴躁,反应较前明显迟钝。头部增强MRI示左侧颞叶内侧、左侧基底节区、胼胝体、视交叉多发异常信号。外院曾考虑视神经脊髓炎(neuromyelitis optica, NMO)谱系疾病,予泼尼松及静脉丙种球蛋白治疗,未见好转。20余天前右眼视力下降,双眼均有胀痛感,头晕、嗜睡加重。复查头部增强MRI提示:左侧颞叶内侧、胼胝体、视交叉多发异常信号,T1加权成像(weighted imaging, WI)呈低信号,T2WI呈稍高信号,T2液体衰减反转恢复序列(fluid attenuated inversion recovery, FLAIR)呈高信号,信号较均匀,增强明显均匀强化(图1)。血WBC计数、红细胞沉降率、C反应蛋白、肿瘤标志物正常;血抗Ro-52抗体弱阳性(+),抗线粒体M2型抗体阳性(++),选择性结合水通道蛋白-4(-),白细胞介素(interleukin, IL)-6 2.4(括号内为正常参考值范围,下同;<5.9) ng/L,IL-10 36.1(<9.1) ng/L。行腰椎穿刺,脑脊液压力9.5 cmH2O(1 cmH2O=0.098 kPa),WBC计数10(0~8)×106/L,蛋白质、乳酸、免疫球蛋白(immunoglobulin, Ig)G寡克隆区带(oligoclonal bands, OB)(-),IgG合成率3.5(-9.9~3.3) mg/d,IL-6 6.8(<5.9) ng/L、IL-10 158.0(<9.1) ng/L,病原学(-),抗神经抗原抗体、抗神经节苷脂抗体(-)。
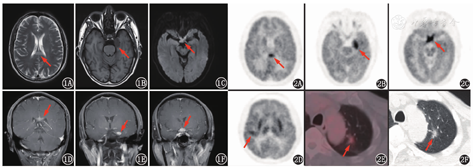

鉴于颅内有多发病变,为评估颅内病变性质,行18F-FDG PET/CT全身显像(图2)。18F-FDG PET/CT图像可见胼胝体体部、左侧颞叶代谢增高灶(图2A,图2B),SUVmax 20.0;视交叉增粗伴代谢增高(图2C),SUVmax 23.9;右侧外侧裂区域皮质代谢增高(图2D),SUVmax 15.2(该处病变头增强MR未见显示)。躯干PET/CT另见左肺上叶混合密度磨玻璃结节,大小1.8 cm×1.1 cm,SUVmax 2.1(图2E,图2F)。本例主要病变位于颅内,累及脑实质皮质及皮质下、白质、视神经,病变均位于幕上,病灶代谢均增高,CT呈等密度,密度较均匀,无明显占位效应,周围未见低密度水肿带,MR信号较均匀,增强扫描除右侧外侧裂区域皮质未见异常,余病变明显强化。患者为老年男性,颅内有多发病变且代谢显著增高,鉴别诊断要考虑颅内恶性肿瘤、脑炎、炎性脱髓鞘性病变、颅内感染性疾病等。
1.颅内转移瘤。因存在左肺上叶可疑恶性结节,首先要除外肺癌伴颅内多发转移瘤。本例与颅内转移瘤明显不同:转移瘤一般为幕上幕下多个病灶,多位于皮髓质交界区,肿瘤中心常发生坏死、囊变和出血而密度不均,病灶周围水肿明显,增强扫描多数为均匀、结节状或环形强化,可表现为不同程度的代谢活性。本例肺内病变为混合磨玻璃密度,即便为恶性也是早期肺癌,发生脑转移概率非常低[1],且多种肿瘤标志物阴性,不符合颅内转移瘤的特点。
2.胶质瘤。胶质瘤是最常见的原发性颅内肿瘤,单发多见。高级别肿瘤表现为密度或信号不均匀,囊变、坏死和出血多见,水肿较重,占位效应明显,增强扫描不均匀强化,18F-FDG摄取明显增高。低级别肿瘤病变表现为密度或信号均匀,多数病灶周围无水肿带,占位效应轻,增强扫描显示无强化或仅轻度强化,18F-FDG摄取仅轻度增高。本例颅内病变代谢明显增高,但CT及MRI密度及信号较均匀,无明显水肿及占位效应,增强扫描大部分明显均匀强化,不符合胶质瘤特点,可排除。
3.中枢神经系统淋巴瘤(central nervous system lymphoma, CNSL)。颅内淋巴瘤以幕上多见,病灶可单个或多个,脑实质型多累及深部灰质结构、脑室旁区和胼胝体,CT上以等或稍高密度为主,MRI以T1WI等或稍低信号、T2WI等或稍高信号为主,密度或信号一般较均匀,也可有出血、坏死、囊变,钙化少见,周围可伴水肿,增强后多呈均匀明显强化,病变可累及颅神经。由于90%的原发CNSL为弥漫性大B细胞淋巴瘤[2],恶性程度高,通常在18F-FDG PET/CT上表现为代谢明显增高。从病变部位、分布、代谢特点来看,本例较符合CNSL。
近年研究表明,CNSL患者的脑脊液IL-10、IL-6水平明显增高,以IL-10升高为主有助于辅助诊断CNSL,其诊断灵敏度和特异性可达88%和99%[3]。颅内感染性疾病患者的脑脊液IL-10、IL-6亦可增高,但以IL-6升高为主[4]。此外,脑脊液IL-10水平可能会比MRI更早地发现肿瘤复发[5]。本例患者在影像学表现,PET代谢特点,脑脊液IL-10、IL-6水平方面均符合CNSL的特点,故需重点考虑。
4.自身免疫性脑炎(autoimmune encephalitis, AE)。本例患者有神经系统症状及视力下降,亚急性起病,进行性加重,MRI及PET/CT发现边缘叶等颅内多发病变,因此还需考虑AE(图3)的鉴别。AE可分为3种主要类型:N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor, NMDAR)抗体脑炎、边缘性脑炎(limbic encephalitis, LE)及其他AE综合征[6]。抗NMDAR脑炎为最常见,约占AE的80%,儿童、青年多见,女性多于男性,急性起病,临床表现多样,主要有精神行为异常、言语及运动障碍、癫发作等,部分患者合并畸胎瘤,脑脊液抗NMDAR抗体阳性。LE以精神行为异常、癫发作和记忆力障碍为主要症状,影像学上常可见边缘系统受累,包括抗副亮氨酸胶质瘤失活蛋白1(leucine-rich glioma inactivated 1, LGI1)抗体、抗γ-氨基丁酸B型受体(γ-aminobutyric acid-B receptor, GABABR)抗体、抗谷氨酸脱羧酶(glutamic acid decarboxylase, GAD)抗体相关脑炎等。在LE中,抗LGI1抗体脑炎面-臂肌张力障碍发作(faciobrachial dystonic seizure, FBDS)是该病特征性的癫发作症状,血清和(或)脑脊液抗LGI1抗体阳性;抗GABABR抗体脑炎的临床症状更明显,严重且难治性癫发作是该病的主要特点,约1/3的患者合并小细胞肺癌,血清和脑脊液抗GABABR抗体阳性;抗GAD抗体脑炎临床上主要表现为僵人综合征和小脑共济失调,血清和(或)脑脊液抗GAD抗体阳性。
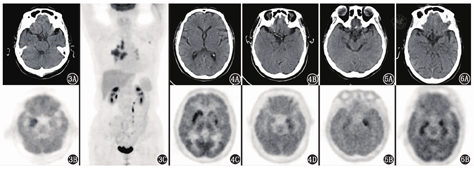

18F-FDG PET检测AE的灵敏度为87%(80%~92%)[7]。抗NMDAR脑炎可表现为基底节高代谢和弥漫性皮质低代谢的混合模式,双侧枕叶代谢明显减低具特征性,有时脑代谢也可接近正常[8];抗LGI1抗体脑炎大多数高代谢灶位于基底节和内侧颞叶(图4);抗GABABR抗体脑炎主要表现为内侧颞叶代谢增高(图5);抗GAD抗体脑炎多数表现为低代谢,病变主要位于内侧颞叶,少部分患者表现为基底节、颞叶代谢增高(图6)。MRI对AE诊断的灵敏度不如18F-FDG PET[7],可无明显异常,或仅有散在的皮质、皮质下点片状异常信号[9]。
本例患者颅内病变代谢程度可符合AE的特点,颞叶内侧又是其常见累及部位,加之左肺上叶有可疑恶性病变,需重点鉴别副肿瘤性AE。但患者颅内病变除累及左颞叶内侧、右侧外侧裂区皮质外,亦累及胼胝体、视神经,这并非AE常见的受累部位,且MRI上病变大多数明显强化、边界清晰,不符合AE的典型影像学表现。再者,副肿瘤性AE相关肺内肿瘤以小细胞肺癌多见,而本例左肺上叶病变为混合磨玻璃结节,即便是恶性也很可能为肺腺癌;且患者脑脊液多种中枢神经系统自身免疫性抗体检测均为阴性,故考虑不支持AE的诊断。
5.炎性脱髓鞘性病变。本例影像学表现为颅内多发病变且累及视神经,故鉴别需考虑多发性硬化、NMO这类炎性脱髓鞘性病变。从代谢程度上来看,多发性硬化、NMO一般18F-FDG代谢活性不高[10];再看病变分布及特点,多发性硬化颅内病变多位于侧脑室周围白质区,且新旧不一,NMO以视神经和脊髓受累为主。本例病变的代谢、分布均与之不同,加之临床上本例的脑脊液OB、NMO-IgG、选择性结合水通道蛋白-4均阴性,激素治疗效果不佳,亦不支持多发性硬化或NMO的诊断。
6.颅内感染性疾病。颅内感染一般有随时间逐步进展的特点,而本例2次MRI间隔2个月,病变部位、强化程度无显著变化。化脓性脑炎与病毒性脑炎强化程度不高,可无强化,或斑点状、小片状、脑回状强化,脓肿形成后脓肿壁可明显环形强化,18F-FDG代谢可增高[11],与本例病变边界清晰的明显均匀强化不同。
本例患者后行立体定向颅内占位病灶活组织检查术,术后病理示弥漫性大B细胞淋巴瘤(非生发中心来源),与上述分析结论一致。在分析颅内病变影像学表现时,除了要分析18F-FDG PET代谢特点外,CT及MRI上密度、信号及强化等特点也有重要的鉴别意义;部分疾病有较特异性的临床特点、体征或检验指标,在考虑鉴别诊断时不容忽视。将影像学表现及临床特点紧密结合,逐一排除、各个击破,才有可能做出更准确的诊断。
所有作者声明无利益冲突


























