
影像学在嗜铬细胞瘤(PCC)和副神经节瘤(PGL)的诊疗中起着至关重要的作用,常用于指导治疗。肿瘤相关易感基因的发现使人们对临床和影像学表型有了更好的了解。功能显像在PCC和PGL亚型中具有灵敏度和特异性优势,因此有着重要意义。目前已有几种靶向PCC和PGL特定受体和代谢过程的放射性药物被开发,包括131I/123I-间碘苄胍、6-氟-18-L-3,4-二羟基苯丙氨酸、18F-FDG和68Ga-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)-生长抑素类似物,其中2种已被用于治疗。该文重点关注目前用于PCC和PGL的显像方法,这些方法因临床表型和基因表型而异。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
WHO将副神经节瘤(paraganglioma, PGL)定义为起源于神经嵴组织的神经内分泌肿瘤[1]。PGL最常见于肾上腺,称为嗜铬细胞瘤(pheochromocytoma, PCC),而位于肾上腺外的称为肾上腺外PGL。副交感神经PGL多起源于头颈部,即头颈部PGL(head and neck PGL, HNPGL),而交感神经源性肿瘤多起源于膈肌下方。大多数PCC和PGL看似良性,但2%~26%会发生转移[2],组织病理学无法区分其良恶性。因此,WHO使用术语"转移性"而不是"恶性"。转移性疾病的定义是肿瘤存在于通常不存在嗜铬细胞或副神经节的部位(如淋巴结和骨骼)[2]。
PCC的典型临床症状为高血压、头痛、心悸、面色苍白、出汗和焦虑,而PGL常表现为疼痛或占位效应[3]。生化表型(分泌模式:去甲肾上腺素、肾上腺素和多巴胺及其代谢物)反映了基因型[4]。PCC和PGL可能在超过10%的病例中出现生化沉默[2],一小部分作为偶发肿瘤存在[3]。
PCC和PGL是一组最常与基因突变相关的肿瘤。有研究在95%的患者中发现了驱动突变、融合基因或拷贝数改变,并发现了20余个种系或体细胞基因突变[5]。最常见的突变是SDH(A/B/C/D/AF2)中的突变,统称为SDHx。突变状态对临床、生化和影像表型均有影响。例如,VHL、RET、NF1、MAX、TMEM12和HRAS突变最常出现在PCC中,而SDHx、FH、PHD1/2和EPAS1/HIF2A突变最常出现在PGL中。散发性PCC和PGL通常在NF1、VHL、RET和MAX基因中发生体细胞突变[5]。目前已有3个PCC和(或)PGL基因簇被描述:簇1,影响乏氧信号通路的假性乏氧簇(SDHx、FH、VHL/EPAS1);簇2,酪氨酸激酶信号簇(RET、NF1、TMEM127、MAX、HRAS);簇3,Wnt信号簇(CSDE1,MAML3)[5]。目前基因检测已被推荐用于所有PCC或PGL患者。
影像学检查在PCC和PGL中的作用包括:在生化结果阳性或处于临界值时确定诊断;确定手术位置、范围和最佳术式;评估多灶性或转移性疾病(分期);评估疗效(再分期);对疾病的存在或复发进行监测筛查;筛选合适的患者应用治疗[90Y/177Lu-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid, DOTA)-生长抑素类似物(somatostatin analog, SSA)或131I-间碘苄胍(metaiodobenzylguanidine, MIBG)治疗]。影像学手段包括解剖成像(主要为CT和MRI)和依赖生理过程或受体靶向的功能显像。本文重点关注目前已批准或广泛用于PCC和PGL的影像学手段。
1.131I/123I-MIBG。核素标记的MIBG(131I/123I-MIBG)与去甲肾上腺素转运蛋白结合,后者通过囊泡单胺转运蛋白被内化并转运到分泌颗粒中[6]。
(1)患者准备、给药、药代动力学、生物分布及剂量测定。123I/131I-MIBG的PCC或PGL的显像流程指南已发布[7]。注射前,必须确定患者没有服用干扰MIBG的药物(见补充材料表1;补充材料见http://jnm.snmjournals.org)。由于游离123I/131I可能会释放,需要保护甲状腺,最常见的是在注射MIBG前2~24 h使用饱和KI溶液,并在此后持续数天。
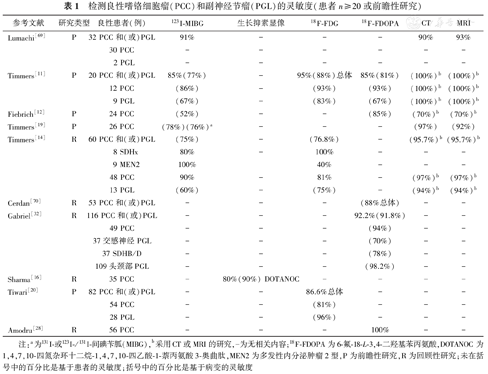
检测良性嗜铬细胞瘤(PCC)和副神经节瘤(PGL)的灵敏度(患者n≥20或前瞻性研究)
检测良性嗜铬细胞瘤(PCC)和副神经节瘤(PGL)的灵敏度(患者n≥20或前瞻性研究)
| 参考文献 | 研究类型 | 良性患者(例) | 123I-MIBG | 生长抑素显像 | 18F-FDG | 18F-FDOPA | CT | MRI |
|---|---|---|---|---|---|---|---|---|
| Lumachi[69] | P | 32 PCC和(或)PGL | 91% | - | - | - | 90% | 93% |
| 30 PCC | - | - | - | - | - | - | ||
| 2 PGL | - | - | - | - | - | - | ||
| Timmers[11] | P | 20 PCC和(或)PGL | 85%(77%) | - | 95%(88%)总体 | 85%(81%) | (100%)b | (100%)b |
| 12 PCC | (86%) | - | (93%) | (93%) | (100%)b | (100%)b | ||
| 9 PGL | (67%) | - | (83%) | (67%) | (100%)b | (100%)b | ||
| Fiebrich[12] | P | 24 PCC | (52%) | - | - | (85%) | (70%)b | (70%)b |
| Timmers[19] | P | 26 PCC | (78%)(76%)a | - | - | - | (97%) | (92%) |
| Timmers[14] | R | 60 PCC和(或)PGL | (75%) | - | (76.8%) | - | (95.7%)b | (95.7%)b |
| 8 SDHx | 80% | - | 100% | - | - | - | ||
| 9 MEN2 | 100% | 40% | - | - | - | |||
| 48 PCC | 90% | - | 81% | - | (97%)b | (97%)b | ||
| 13 PGL | (60%) | - | (75%) | - | (94%)b | (94%)b | ||
| Cerdan[70] | R | 53 PCC和(或)PGL | - | - | - | (88%总体) | - | - |
| Gabriel[32] | R | 116 PCC和(或)PGL | - | - | - | 92.2%(91.8%) | - | - |
| 49 PCC | - | - | - | (94%) | - | - | ||
| 37交感神经PGL | - | - | - | (70%) | - | - | ||
| 37 SDHB/D | - | - | - | (78%) | - | - | ||
| 109头颈部PGL | - | - | - | (98.2%) | - | - | ||
| Sharma[16] | R | 35 PCC | - | 80%(90%) DOTANOC | - | - | - | - |
| Tiwari[20] | P | 82 PCC和(或)PGL | - | - | 86.6%总体 | - | - | - |
| 54 PCC | - | - | (81%) | - | - | - | ||
| 28 PGL | - | - | (96%) | - | - | - | ||
| Amodru[28] | R | 56 PCC | - | - | - | 100% | - | - |
注:a为131I-或123I-/131I-间碘苄胍(MIBG),b采用CT或MRI的研究,-为无相关内容;18F-FDOPA为6-氟-18-L-3,4-二羟基苯丙氨酸,DOTANOC为1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸-1-萘丙氨酸3-奥曲肽,MEN2为多发性内分泌肿瘤2型,P为前瞻性研究,R为回顾性研究;未在括号中的百分比是基于患者的灵敏度;括号中的百分比是基于病变的灵敏度
123I-MIBG更适合用于显像[8],131I-MIBG更适合用于治疗前剂量测定或记录治疗后的生物分布。给药活性和剂量测定见补充材料表1。服用MIBG后,血液清除迅速,2~5 d全身排泄超过80%,主要通过肾排泄[9]。正常的生物分布包括肝、肺、心脏、脾和唾液腺的摄取(图1)。肾上腺通常也有摄取,在CT无异常的情况下,摄取等于或低于肝水平被认为是生理性的。
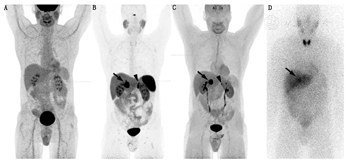

(2)临床效果。有荟萃分析显示,123I-MIBG对非转移性和转移性PCC或PGL的灵敏度分别为96%和79%[10]。最近入组更多PGL患者的研究显示,MIBG检查的总体灵敏度较低,尤其是在遗传性PCC或PGL中(表1,表2)。基于病灶的转移性PCC或PGL的灵敏度通常低于60%[11,12,13,14,15,16];而在一些基于患者的研究中,灵敏度可达80%~92%[17,18,19,20]。这些差异可能与患者群体或方法学差异有关。通常,123I-MIBG检测PCC的灵敏度高于PGL,分别为88%和67%[21]。其他研究报道其对PCC的灵敏度为76%~92%,对PGL的灵敏度为35%~70%[3,11,17,22,23]。MIBG对SDHx患者的灵敏度较低[14,24]。随着新型放射性药物的使用,核素标记的MIBG在PCC和(或)PGL显像中的关键作用已降低成仅作为131I-MIBG治疗的筛选检查。
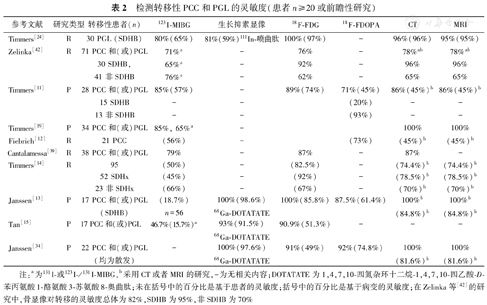
检测转移性PCC和PGL的灵敏度(患者n≥20或前瞻性研究)
检测转移性PCC和PGL的灵敏度(患者n≥20或前瞻性研究)
| 参考文献 | 研究类型 | 转移性患者(n) | 123I-MIBG | 生长抑素显像 | 18F-FDG | 18F-FDOPA | CT | MRI |
|---|---|---|---|---|---|---|---|---|
| Timmers[24] | R | 30 PGL (SDHB) | 80%(65%) | 81%(59%)111In-喷曲肽 | 100%(97%) | - | 96%(96%) | 95%(95%) |
| Zelinka[42] | R | 71 PCC和(或)PGL | 71%a | - | 76% | - | 78%ab | 78%ab |
| 30 SDHB, | 65%a | - | 92% | - | 96% | 96% | ||
| 41非SDHB | 76%a | - | 62% | - | 65% | 65% | ||
| Timmers[11] | P | 28 PCC和(或)PGL | 85%(57%) | - | 89%(74%) | 71%(45%) | 86%(45%)b | 86%(45%)b |
| 15 SDHB | - | - | (20%) | - | - | |||
| 13非SDHB | - | - | (93%) | - | - | |||
| Timmers[19] | P | 34 PCC和(或)PGL | 85%, 65%a | - | 100% | 100% | ||
| Fiebrich[12] | R | 21 PCC | (56%) | - | (73%) | (45%)b | (45%)b | |
| Cantalamessa[39] | R | 38 PCC和(或)PGL | 79% | - | 87% | - | 87% | - |
| Timmers[14] | R | 95 | (50%) | - | (82.5%) | - | (74.4%)b | (74.4%)b |
| 52 SDHx | (45%) | - | (92%) | - | (78.5%)b | (78.5%)b | ||
| 23非SDHx | (66%) | - | (67%) | - | (70%)b | (70%)b | ||
| Janssen[13] | P | 17 PCC和(或)PGL | (18.7%) | 100%(98.6%) | 100%(85.8%) | 87.5%(61.4%) | 100%b | 100%b |
| (SDHB) | n=56 | 68Ga-DOTATATE | (84.8%)b | (84.8%)b | ||||
| Tan[15] | P | 17 PCC和(或)PGL | 46.7%(15.7%)a | 93%(91.5%) | 90.9%(51.3%) | - | - | - |
| 68Ga-DOTATATE | ||||||||
| Janssen[34] | P | 22 PCC和(或)PGL | - | 100%(97.6%) | 91%(49%) | 92%(74.8%) | 100% | 100% |
| (均为散发) | 68Ga-DOTATATE | (81.6%)b | (81.6%)b |
注:a为131I-或123I-/131I-MIBG,b采用CT或者MRI的研究,-为无相关内容;DOTATATE为1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸-D-苯丙氨酸1-酪氨酸3-苏氨酸8-奥曲肽;未在括号中的百分比是基于患者的灵敏度;括号中的百分比是基于病变的灵敏度;在Zelinka等[42]的研究中,骨显像对转移的灵敏度总体为82%,SDHB为95%,非SDHB为70%
2.6-氟-18-L-3,4-二羟基苯丙氨酸(6-18F-fluoro-L-3,4-dihydroxyphenylalanine, 18F-FDOPA)。18F-FDOPA(IASOdopa; IASON GmbH)是一种核素标记的氨基酸,其作为用于帕金森病或神经内分泌肿瘤的多巴胺合成标记物,已获欧洲药品管理局和美国食品与药品监督管理局的批准,但在美国的可用性有限。18F-FDOPA通过较大的中性氨基酸转运蛋白-1转运到靶细胞,再脱羧为18F-多巴胺,通过囊泡单胺转运蛋白被转运至分泌囊泡中或被其他酶降解。
(1)患者准备、给药、药代动力学、生物分布及剂量测定。18F-FDOPA的显像流程指南已发布[25,26]。没有药物会干扰显像的相关报道。卡比多巴是一种外周脱羧阻断剂,可提高显像剂在PCC和PGL中的摄取[27],但并未用于所有研究[28]。
给药活性和剂量测定见补充材料表1。18F-FDOPA的药代动力学和生物分布研究显示其血液清除迅速[29],大多数肿瘤摄取发生在给药后30 min内[27]。基底神经节、肝和胰腺有生理性摄取(图1),肠道和食管见轻度摄取。18F-FDOPA在正常肾上腺中为低摄取(平均SUVmax,1.9),与123I-MIBG的显著摄取相比,这对肾上腺肿瘤显像更为有利[30]。
(2)临床效果。18F-FDOPA在PCC和(或)PGL显像中的应用见表1,表2。一项PCC和PGL的荟萃分析显示,18F-FDOPA PET/CT的灵敏度和特异性分别为91%和79%(基于患者)及95%和95%(基于病变)[31]。表1显示18F-FDOPA诊断良性PCC具有较高的灵敏度(85%~100%),优于MIBG。18F-FDOPA诊断良性PCC的灵敏度优于对良性交感神经PGL的灵敏度(94%与70%)[32];在非SDHx转移性PCC中,其检测转移性PCC灵敏度可达90%以上[23,33,34];尽管其他研究显示,其检测良性疾病的灵敏度为81%,检测恶性疾病的灵敏度为45%,但许多病灶可能被漏诊(图2)[11]。
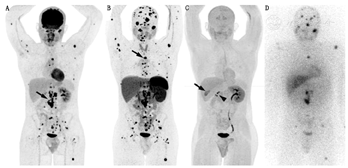

综上,18F-FDOPA检测良性PCC或PGL和转移性PCC(散发性或与非SDHx突变相关)有较高的灵敏度,但对转移性PGL的灵敏度较低。显像流程指南推荐在非转移性PCC和PGL的检查中使用18F-FDOPA[35]。最近对68Ga-DOTA-SSA的研究显示,在HNPGL、转移性散发性PCC或PGL、转移性SDHx相关PCC或PGL中,68Ga-DOTA-SSA显像的灵敏度高于18F-FDOPA和其他显像剂。
3.18F-FDG。18F-FDG是葡萄糖代谢的替代标志物,由葡萄糖转运蛋白(通常为转运蛋白1)介导进入肿瘤,继而通过己糖激酶2磷酸化,滞留在细胞内作为标记物。
(1)患者准备、给药、药代动力学、生物分布及剂量测定。18F-FDG显像流程指南适用于PCC或PGL患者[25,36]。患者准备、给药活性和剂量测定结果见补充材料表1。正常的生理性摄取包括脑、泌尿系统、肝和脾,另有不同程度的心脏和肠道摄取(图1)。正常肾上腺的摄取低于肝(平均SUVmax,1.6)[14]。
(2)临床效果。18F-FDG在PCC和(或)PGL显像中的应用见表1,表2。有荟萃分析显示,18F-FDG诊断转移性PCC和PGL的灵敏度为85%,特异性为55%[37]。另有研究者报道,在15%的患者中发现了传统影像学检查未发现的新病灶,从而影响了管理策略[38]。
PCC和PGL中18F-FDG的摄取存在差异:在簇1类肿瘤中,由于乏氧信号通路的激活,SUVmax为13.0±6.5;相比之下,簇2类肿瘤SUVmax为3.9±3.1,突变阴性肿瘤为9.0±7.2[20]。18F-FDG对多发性内分泌肿瘤2型相关PCC(簇2类)患者的灵敏度仅有40%[14]。
对于良性PCC和PGL,18F-FDG的灵敏度不同,通常低于或类似于MIBG显像的灵敏度(图1)。在一项早期研究中,18F-FDG检测肿瘤的灵敏度为58%,而MIBG的灵敏度为83%[18]。在包括非转移性PCC和PGL的单独报告中,18F-FDG的灵敏度为76.8%~88.0%[11,14]。
18F-FDG在检测转移性病变方面常优于MIBG[33,39],高达90%的MIBG阴性病变18F-FDG显像呈阳性(图2)[15]。在转移性PCC和PGL中,18F-FDG的灵敏度为51%~100%,通常超过80%[11,14,15,24,39,40]。这种较大的差异可能与纳入患者群体特征不同、是否存在特定基因突变,以及采用的"金标准"有所差异有关(表2)。在一项前瞻性研究中,Timmers等[24]首次报告了18F-FDG显像在SDHB突变患者中的优势,其对区域转移灶的灵敏度为97%,而123I-MIBG为65%,111In-喷曲肽为50%,骨显像为83%。随后的研究证实,18F-FDG在SDHx患者中的灵敏度为79.4%~100%[11,13,20,41,42,43,44]。因此,18F-FDG是转移性病变、尤其是SDHx肿瘤患者的首选显像方式,灵敏度为83%~92%,而对非SDHx肿瘤的灵敏度为62%[11,42]。然而,正如接下来所讨论的,该建议是在68Ga-DOTA-SSA评估前提出的。
4.68Ga-DOTA-SSA。生长抑素是一种14个氨基酸的肽类激素,与生长抑素受体(somatostatin, SSTR)1、2、3、4和5结合。在体外,PCC和PGL主要表达SSTR2和SSTR3[45,46]。
尽管111In-喷曲肽是第一个被批准用于神经内分泌肿瘤(neuroendocrine tumor, NET)显像的SSA,但其已被DOTA-SSA取代,后者采用更强的螯合物,并用半衰期为68 min的正电子发射体68Ga标记。68Ga-DOTA-SSA包括DOTA-酪氨酸3-奥曲肽(DOTA-Tyr3-octreotide, DOTATOC;SSTR2和5)、DOTA-1-萘丙氨酸3-奥曲肽(DOTA-1-Nal3-octreotide, DOTANOC; SSTR2、3和5)和DOTA-D-苯丙氨酸1-酪氨酸3-苏氨酸8-奥曲肽(DOTA-D-Phe1-Tyr3-Thr8-octreotide, DOTATATE; SSTR2)[47]。68Ga-DOTATATE(Netspot; Advanced Accelerator Applications)已获得美国食品与药品监督管理局和欧洲药品管理局的批准。本文重点介绍68Ga-DOTA-SSA,尤其是68Ga-DOTATATE,因为其在PCC和(或)PGL显像中使用最广泛;68Ga-DOTATOC也是一种有效的68Ga-DOTA-SSA,而64Cu-DOTATATE(Detectnet;Curium)可能是合适的替代(见补充材料表1),但尚未发表关于PCC或PGL的文献报道。鉴于68Ga-DOTA-SSA在临床实践中的优势,推荐18F-FDG显像的现有指南可能会显得过时。
(1)患者准备、给药、药代动力学、生物分布及剂量测定。68Ga-DOTA-SSA的显像流程指南已发布[25,26]。在显像前中止SSA治疗的建议可能不是必要的(见补充材料表1)。给药活性、特殊注意事项和剂量测定见补充材料表1。68Ga-DOTATATE/TOC的生物分布已有报道[48],其在血液中快速清除。显像剂主要经肾清除,在脾、肾、肾上腺、垂体和肝中显著摄取(图1),不同类似物间的差异很小[48]。大多数肿瘤摄取发生在注射后30 min。唾液腺和甲状腺可见低摄取。68Ga-DOTATATE在正常肾上腺的SUVmax高于良性腺瘤(范围16.4~20.3与6.3~11.8)[49]。相比之下,PGL的平均SUVmax为94.2(范围33.15~155.2)。
(2)临床效果。68Ga-DOTA-SSA在PCC和(或)PGL显像中的应用见表1,表2。68Ga-DOTA-SSA研究显示,在检测PCC和PGL方面,基于病变的灵敏度很高,通常超过92%[16,40,50]。最近的报道显示,68Ga-DOTA-SSA在广泛的突变范围内具有高检出率[34,44,51,52]。一项比较18F-FDG和68Ga-DOTA-SSA灵敏度的荟萃分析显示,68Ga-DOTA-SSA的灵敏度高于18F-FDG(95%与85%)。即使考虑到种系突变,68Ga-DOTA-SSA的病灶灵敏度为97%,而18F-FDG为79%[37]。另一项荟萃分析表明,68Ga-DOTA-SSA(93%)的灵敏度高于18F-FDOPA(80%)、18F-FDG(74%)和123I/131I-MIBG(38%)[53]。
在一项对22例散发性转移性PCC或PGL患者的前瞻性研究中,68Ga-DOTATATE检出98%的转移灶,优于18F-FDG(49.2%)、18F-FDOPA(74.8%)和CT/MRI(81.6%)[34]。在具有SDHx突变的患者中,68Ga-DOTATATE基于病灶的灵敏度高于18F-FDG(图2)或CT/MRI[13,43,44]。总体来说,68Ga-DOTATATE应被视为评估转移性PCC、转移性PGL、SDHx突变和HNPGL的首选显像剂。但对于红细胞增多症相关、MAX突变相关的PCC或PGL,或明显散发性PCC,18F-FDOPA可能是首选。针对评估SSA在良性PCC中应用的研究有限。在一项纳入32例患者的研究中,111In-喷曲肽的灵敏度为25%[54],而68Ga-DOTA-SSA的灵敏度预期更高,18F-FDOPA仍是首选显像剂。
5.CT和MRI。CT和MRI(见补充材料图1)在PCC或PGL患者的诊断、分期和治疗反应评估中发挥着重要作用,用于术前确定疾病部位及与其他结构的关系。目前的指南建议对生化阳性患者进行初始定位时使用CT而不是MRI[35]。由于无辐射,MRI更适合儿童患者和筛查。
一小部分PCC患者表现为肾上腺偶发瘤,而约75%的偶发瘤为腺瘤[55]。CT和MRI用于区分腺瘤和其他肾上腺病变,包括PCC(见补充材料图1)。在平扫CT上,99.6%的PCC超过10 HU[56]。尽管大多数腺瘤HU≤10,但不太常见的乏脂性腺瘤HU也可超过10。对比增强CT用于确定门静脉相和延迟相间的绝对和相对百分比洗脱率;至少60%的绝对洗脱率和至少40%的相对洗脱率是乏脂性腺瘤的典型特征,但与PCC的值重叠[57]。88%的PCC静脉期增强CT值至少为85 HU,但腺瘤仅为16%。因为PCC可能很大,可能表现为中央坏死,CT或MRI上无增强(环形征)。无论洗脱情况如何,不断增长的肾上腺病变和大于4~5 cm的病变通常需进一步治疗,如切除或活组织检查。
MRI还可通过使用化学位移序列的脂质含量来识别腺瘤,发现高脂含量通常是腺瘤的诊断依据。乏脂性腺瘤的MRI表现可能与PCC相似[58]。T2加权图像上的高信号,特别是脂肪抑制,是PCC和PGL的特征(见补充材料图1),其具有高灵敏度,但缺乏特异性。
转移性病变患者行全身CT或MRI,以对PCC和PGL进行分期和术前评估,并评估疾病进展和治疗反应。但对于转移灶病变,功能显像通常具有更高的灵敏度,尤其是骨转移和小的软组织病变的发生率很高,而这些病变可能难以在CT或MRI上被观察到。
HNPGL最常见于颈动脉体和颈静脉鼓室区域,但颈部以下也可并发肿瘤。种系突变最常见的是SDHD和SDHB,占HNPGL的25%~50%[59]。
用于HNPGL分期、确定病变范围和治疗决策的一线显像方法通常为解剖成像,如MRI、MR血管造影、CT和CT血管造影[60]。在CT图像上(图3),HNPGL血管丰富,早期动脉期强化明显,在增强MRI上亦是如此,常呈"椒盐"征。MRI和MR血管造影通常用于确定受累程度、疾病管理支持、风险评估和预后评估。MRI涉及一系列耗时的序列。一项SDHx相关的HNPGL前瞻性研究将序列限制为短对比增强MRI方案,包括三维飞行时间MR血管造影序列和具有脂肪饱和的轴位平面快速自旋回波T1加权序列。上述序列识别HNPGL的灵敏度和特异性分别为88.7%和93.7%[61]。
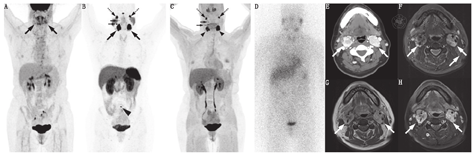

68Ga-DOTA-SSA、18F-FDOPA和18F-FDG显像(较小程度上)诊断HNPGL具有高灵敏度(图3),而123I/131I-MIBG的灵敏度较差(10%~42%)(图3;表3)。68Ga-DOTATATE对HNPGL的灵敏度为100%,可检出其他显像无法检出的额外病变[52]。18F-FDOPA的灵敏度也很高(97%);对于头颈部以外病变,18F-FDOPA仅检出60%,18F-FDG仅检出70%,CT或MRI仅检出77%,而68Ga-DOTATATE可检出100%[52]。
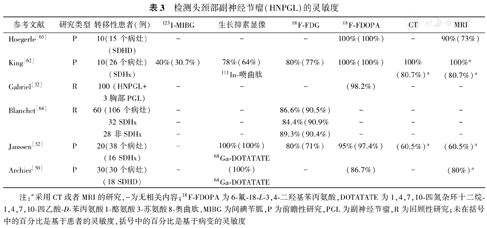
检测头颈部副神经节瘤(HNPGL)的灵敏度
检测头颈部副神经节瘤(HNPGL)的灵敏度
| 参考文献 | 研究类型 | 转移性患者(例) | 123I-MIBG | 生长抑素显像 | 18F-FDG | 18F-FDOPA | CT | MRI |
|---|---|---|---|---|---|---|---|---|
| Hoegerle[63] | P | 10(15个病灶) | - | - | - | 100%(100%) | - | 90%(73%) |
| (SDHD) | ||||||||
| King[62] | P | 10(26个病灶) | 40%(30.7%) | 78%(64%) | 80%(77%) | 100%(100%) | 100% | 100%a |
| (SDHx) | 111In-喷曲肽 | (80.7%)a | (80.7%)a | |||||
| Gabriel[32] | R | 100 (HNPGL+ | - | - | - | (98.2%) | - | - |
| 3胸部PGL) | ||||||||
| Blanchet[64] | R | 60 (106个病灶) | - | - | 86.6%(90.5%) | - | - | - |
| 32 SDHx | - | - | 84.4%(90.9% | - | - | - | ||
| 28非SDHx | - | - | 89.3%(90.4%) | - | - | - | ||
| Janssen[52] | P | 20(38个病灶) | - | 100%(100%) | 80%(71%) | 95%(97.4%) | (60.5%)a | (60.5%)a |
| (16 SDHx) | 68Ga-DOTATATE | |||||||
| Archier[50] | P | 30(30个病灶) | - | (100%) | - | (86.7%) | - | (80%)a |
| (18 SDHD) | 68Ga-DOTATATE |
注:a采用CT或者MRI的研究,-为无相关内容;18F-FDOPA为6-氟-18-L-3,4-二羟基苯丙氨酸,DOTATATE为1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸-D-苯丙氨酸1-酪氨酸3-苏氨酸8-奥曲肽,MIBG为间碘苄胍,P为前瞻性研究,PGL为副神经节瘤,R为回顾性研究;未在括号中的百分比是基于患者的灵敏度,括号中的百分比是基于病变的灵敏度
18F-FDOPA对HNPGL的灵敏度较高(86.7%~100%)[23,31,32,50,62,63],超过MRI(表3)[50,62,63]。此外,18F-FDOPA比MR血管造影更具可重复性,且通常能比MRI提供更多信息,尤其对于可能会被遗漏的病灶[50,63]。18F-FDOPA被认为是HNPGL的一线显像手段,尽管最新研究显示68Ga-DOTA-SSA的效果更优[25,35]。
18F-FDG在HNPGL中的灵敏度为71%~90.5%[52,62,64],低于68Ga-DOTA-SSA或18F-FDOPA。有研究报道,在独立HNPGL患者组中,18F-FDG PET/CT基于病灶灵敏度为71%,而18F-FDOPA可达97%[52]。
综上所述,对于HNPGL或HNPGL高风险的患者,功能显像具有较高的灵敏度,应与MRI结合使用,后者用于手术和治疗决策。在绝大多数情况下,68Ga-DOTA-SSA被认为是首选,其次是18F-FDOPA,再次是18F-FDG(图4)。
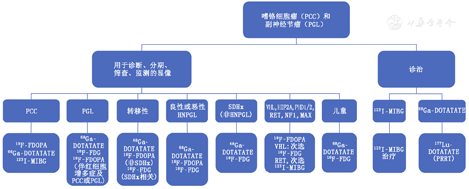

10%~20%的PCC和PGL发生于儿童[65],且多为遗传性[66]。19%的病例为双侧PCC,4%~65%的病例伴有或发展为转移[67,68]。Babic等[68]报道了多种检查手段在儿童PCC中的灵敏度:CT(100%)、MRI(93%)、18F-FDG(86%)、MIBG(91%)、18F-FDOPA(100%)和68Ga-DOTATATE(100%)。Jha等[44]分析9例SDHx PCC或PGL患儿发现,18F-FDG和68Ga-DOTATATE基于患者的灵敏度均为100%,但基于病灶的灵敏度较低(分别为79.4%和93.5%)。此外,68Ga-DOTATATE比CT或MRI更为灵敏(73.8%)。然而,对于腹部病变,68Ga-DOTATATE的灵敏度为67%,而18F-FDG和CT或MRI的灵敏度均为80%。因此,建议将68Ga-DOTATATE PET/CT作为SDHx患儿的功能显像方法,但腹部病变除外;腹部病变建议行68Ga-DOTATATE PET/CT或PET/MR对比增强扫描,但该结果仍需大样本研究加以证实。
尽管对某些突变的研究还非常有限,但一般认为不同种系突变的显像特点不同。补充材料表2提供了一些描述灵敏度结果的研究,以及与突变(RET、VHL、NF1、SDHx、EPAS1和MAX)相关的PCC和PGL患者的特征。最好的显像数据是SDHx相关PCC和PGL,其中68Ga-DOTATATE是首选显像剂。18F-FDG对该类患者也具有高灵敏度,尽管对于HNPGL,18F-FDOPA是第二选择(见补充材料表2)。在VHL、RET和NF1突变的患者中,18F-FDOPA是检测肿瘤最灵敏的显像剂,但与68Ga-DOTATATE和18F-FDG的比较有限。Sharma等[16]的研究显示,68Ga-DOTANOC对RET突变患者具有高灵敏度(见补充材料表2)。与HIF2A(也称为EPAS1)和EGLN1相关的PCC和PGL伴有红细胞增多症,与MAX相关的PCC用18F-FDOPA显像效果更好,而18F-FDG或68Ga-DOTA-SSA显像的灵敏度较低(见补充材料表2)。
PCC和PGL是复杂的分子驱动疾病,被发现的驱动基因突变数量不断增加。由于PCC和PGL较少见,研究有限,通常是小规模、回顾性的研究。已确定的PCC和PGL基因型验证了显像表型,虽然不能完全预测,但为最佳功能显像方法提供了指导。通常,68Ga-DOTA-SSA PET/CT在所有显像方式中具有最高的诊断准确性。123I-MIBG、18F-FDOPA和18F-FDG亦有价值,尤其是在某些临床表现、特定突变或治疗选择评估时。其他靶向去甲肾上腺素转运蛋白的显像剂并不是常规可用的,因此不在本文讨论范围内。本文参考了大量经美国食品与药品监督管理局或欧洲药品管理局批准的放射性显像剂的研究,在其基础上,笔者提出了图4所示的显像流程。



























