
患者女,28岁,2021年5月出现阵发性血压升高,伴头痛、大汗、心悸,血压最高可达210/125 mmHg(1 mmHg=0.133 kPa),发作间期血压可恢复正常,为查明高血压原因入本院。高血压按病因可分为原发性高血压和继发性高血压,患者为青年女性,原发性高血压的可能性较小,首先需排除继发性高血压,如肾血管性高血压、肾实质性高血压及内分泌性高血压,其中内分泌性高血压的病因又包括嗜铬细胞瘤/副神经节瘤(pheochromocytomas and paragangliomas, PPGL)、原发性醛固酮增多症、库欣综合征、甲状腺功能亢进症等。患者入院后实验室检查提示:血3-甲氧基去甲肾上腺素(3-normetanephrine, 3-NMN)12.1[正常参考值范围(下同):<0.9] nmol/L、3-甲氧基肾上腺素(3-metanephrine, 3-MN) 0.1(<0.5) nmol/L、3-甲氧基酪胺(3-methoxytyramine, 3-MT) 0.038(<0.039) nmol/L,24 h尿去甲肾上腺素(norepinephrine, NE) 1 124.7 (<76.9) μg、肾上腺素6.4(<11.0) μg、多巴胺566.6(<459.9) μg;肾功能及尿常规、甲状腺功能、血钾、血皮质醇及促肾上腺皮质激素、肾血管超声检查结果均正常。由于患者NE及代谢产物明显升高,临床考虑PPGL可能性大。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,28岁,2021年5月出现阵发性血压升高,伴头痛、大汗、心悸,血压最高可达210/125 mmHg(1 mmHg=0.133 kPa),发作间期血压可恢复正常,为查明高血压原因入本院。高血压按病因可分为原发性高血压和继发性高血压,患者为青年女性,原发性高血压的可能性较小,首先需排除继发性高血压,如肾血管性高血压、肾实质性高血压及内分泌性高血压,其中内分泌性高血压的病因又包括嗜铬细胞瘤/副神经节瘤(pheochromocytomas and paragangliomas, PPGL)、原发性醛固酮增多症、库欣综合征、甲状腺功能亢进症等。患者入院后实验室检查提示:血3-甲氧基去甲肾上腺素(3-normetanephrine, 3-NMN)12.1[正常参考值范围(下同):<0.9] nmol/L、3-甲氧基肾上腺素(3-metanephrine, 3-MN) 0.1(<0.5) nmol/L、3-甲氧基酪胺(3-methoxytyramine, 3-MT) 0.038(<0.039) nmol/L,24 h尿去甲肾上腺素(norepinephrine, NE) 1 124.7 (<76.9) μg、肾上腺素6.4(<11.0) μg、多巴胺566.6(<459.9) μg;肾功能及尿常规、甲状腺功能、血钾、血皮质醇及促肾上腺皮质激素、肾血管超声检查结果均正常。由于患者NE及代谢产物明显升高,临床考虑PPGL可能性大。
PPGL是一类起源于嗜铬细胞的儿茶酚胺类肿瘤,发生于肾上腺髓质的肿瘤称为嗜铬细胞瘤,发生于肾上腺外的交感或副交感神经者称为副神经节瘤。PPGL的诊断分2步:定性诊断和定位诊断。定性诊断依赖于患者的临床表现及血、尿儿茶酚胺水平。本例定性诊断是否明确?首先,患者的临床症状十分典型——即阵发性头痛、心悸、大汗"三联征";其次,血、尿NE及代谢产物水平升高。需要注意的是,儿茶酚胺升高不一定都是PPGL导致的,文献报道儿茶酚胺升高的假阳性率可达20%[1]。不恰当的抽样方式或检测方法可以导致假阳性,这时需要多次采样检测;此外,某些药物可能干扰人体内儿茶酚胺的代谢,从而导致假阳性,如5-羟色胺重吸收抑制剂、三环类抗抑郁药等可抑制血清儿茶酚胺的重吸收,单胺氧化酶类药物可抑制儿茶酚胺向其他物质的转化,拟交感神经类药物如咖啡因、尼古丁、麻黄碱等可增加儿茶酚胺类物质的释放。这些药物可以导致患者体内儿茶酚胺水平升高,应至少停药2周再进行检测[1],但在临床实践中,部分患者可能因合并其他疾病难以停药,这为PPGL的诊断带来一定的困难。一般来说,因检测不当或药物影响而升高的儿茶酚胺水平一般很少超过正常上限的3~4倍,超过的情况多是病理性因素导致的[1]。本例患者临床表现典型,多次检测血、尿NE及其代谢产物水平升高10倍以上,考虑PPGL定性诊断明确。下一步进行病灶的定位诊断。
在儿茶酚胺类肿瘤中,嗜铬细胞瘤占80%~85%,副神经节瘤占15%~20%[2],所以可先行肾上腺CT,以明确肾上腺是否有占位。本例患者肾上腺CT未见异常。不同部位的PPGL分泌的儿茶酚胺类物质有所区别,一般来说,嗜铬细胞瘤以分泌肾上腺素为主,而起源于交感神经的副神经节瘤则主要分泌NE,这是因为NE转化为肾上腺素时需要大量皮质醇作为催化反应的辅助因子;而起源于副交感神经的副神经节瘤(如位于头颈部者)则可以无功能,不分泌儿茶酚胺类物质[1]。本例患者的儿茶酚胺升高以NE及其代谢产物升高为主,而肾上腺素的水平正常,表明定位诊断应该是位于肾上腺外的交感神经起源的副神经节瘤,这也是肾上腺CT未见异常的原因。
由于PPGL具有高表达生长抑素受体(somatostatin receptor, SSTR)并摄取NE的类似物间碘苄胍(meta-iodobenzylguanidine, MIBG)的特点,SSTR显像及131I-MIBG也是PPGL定位诊断的重要工具。SSTR显像诊断嗜铬细胞瘤的灵敏度约50%,但对肾上腺外的副神经节瘤的灵敏度达90%;而131I-MIBG显像诊断嗜铬细胞瘤的灵敏度为85%,诊断副神经节瘤的灵敏度为56%~75%[3],这其中的差别可能与嗜铬细胞瘤和肾上腺外副神经节瘤的功能不同、2种显像的生物分布和图像分辨率不同有关。本例患者行99Tcm-联肼尼克酰胺-酪氨酸3-奥曲肽(hydrazinonicotinamide-Tyr 3-octreotide, HYNIC-TOC)SSTR显像和131I-MIBG肾上腺髓质显像,均可见盆腔类圆形肿物,大小约6.3 cm×6.0 cm,显像剂摄取异常增高(图1,图2)。
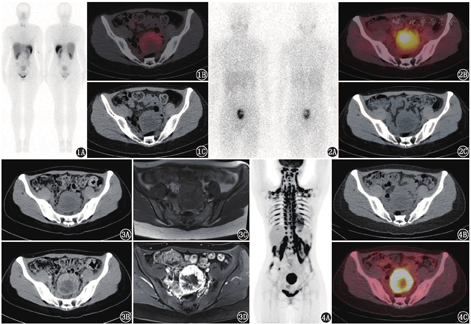

本例定性诊断已明确——PPGL所致的继发性高血压,所以盆腔占位考虑PPGL可能性大。值得注意的是,部分非PPGL(或非神经内分泌肿瘤)也可能在SSTR显像或肾上腺髓质显像中表现为阳性,如胃肠道间质瘤、肾上腺皮质腺瘤、副脾、淋巴瘤、肝血管瘤、血管平滑肌脂肪瘤等在肾上腺髓质显像中可能表现为阳性,而乳腺癌、肾癌、肺癌、淋巴瘤、正常子宫或者子宫肌瘤等可在SSTR显像中出现高摄取[4]。为进一步明确病变诊断及其与周围组织、血管的关系,本例患者行增强CT和MRI,结果显示盆腔肿物明显不均匀强化(图3),符合PPGL的影像特点。
由于PPGL存在恶性潜能,并且1/4的患者可有多个解剖学起源(同时/异时存在多个病灶)[5],患者之后行18F-FDG PET/CT以评估病变良恶性及探测病灶数量,显像见盆腔病灶代谢异常增高,中心坏死,全身棕色脂肪代谢异常增高(图4),除此之外未发现其他病灶或转移灶。
一般来说,肿瘤的葡萄糖代谢越活跃,提示肿瘤的分化程度越差、恶性程度越高。但PPGL的FDG代谢并不一定与其分化程度相关,而是和参与三羧酸循环的酶的突变有关。超过1/3的PPGL患者为家族遗传性,以琥珀酸脱氢酶(succinate dehydrogenase, SDH)、冯希佩尔-林道(Von Hippel-Lindau, VHL)、多发性内分泌腺肿瘤病2型(multiple endocrine neoplasia type 2, MEN2)、神经纤维瘤病1型(neurofibromatosis type 1, NF1)基因等胚系基因突变为主[5]。SDH基因突变造成SDH失活,细胞内琥珀酸盐水平升高,葡萄糖代谢活跃。此外,基因突变的类型也可以影响儿茶酚胺分泌的模式:MEN2、NF1基因突变者同时分泌NE和肾上腺素,而VHL及SDH基因突变的患者以分泌NE或多巴胺为主[6]。因此,本例患者比较符合SDH突变的副神经节瘤特点。
本例患者18F-FDG PET/CT除发现盆腔病灶外,还显示全身棕色脂肪广泛摄取,这是什么原因,又有什么提示呢?文献报道25%~30%的PPGL患者会出现全身棕色脂肪组织活化(健康人中仅6%出现此类情况,且多发生于寒冷刺激后)[7]。PPGL可通过3种机制使棕色脂肪组织活化:(1)交感神经通过β3受体激活棕色脂肪组织,使FDG摄取增高;(2)儿茶酚胺类物质通过化学作用刺激棕色脂肪组织活化;(3)肾上腺能促进白色脂肪组织向棕色脂肪组织分化[8,9]。有研究显示,棕色脂肪组织代谢增高的PPGL患者的基因突变类型与代谢不高的患者之间没有明显差异,但棕色脂肪代谢增高患者的NE水平更高,预后也更差[10]。一方面,NE水平本身就是预后的预测因子之一,NE水平高的患者交感神经兴奋强、预后差;另一方面,棕色脂肪活化的患者可能产生过多的能量消耗,更容易出现恶病质,从而导致更差的预后。
本例患者PPGL的定性和定位诊断都十分明确,鉴别诊断不难。需要注意的是,PPGL是异质性很强的疾病,尤其是遗传相关性PPGL,具有很大程度的多样性。核医学检查对PPGL以及其相关综合征的全面评估非常重要,其提供的不仅仅是定位诊断,还包括了分子遗传特征、提示预后的信息,对PPGL的诊疗具有重要意义。
所有作者声明无利益冲突


























