
患者女,50岁,因发现甲状腺结节1年余、甲状腺功能异常2周就诊。患者2020年自觉颈部增粗,外院甲状腺超声提示双侧甲状腺结节,建议定期复查。2021年10月于本院复查甲状腺超声:甲状腺右叶中部见1.7 cm×1.3 cm×1.1 cm的低回声结节,峡部偏左侧见0.4 cm×0.3 cm×0.4 cm的低回声结节,均形态不规则,边界不清,右叶中部结节可见数个点状强回声,彩色多普勒血流显像(color Doppler flow imaging, CDFI)血流信号丰富,考虑均为有风险结节;双叶内另见数个形态规则、边界清楚的中低回声结节,较大者位于左叶下部,大小为3.3 cm×1.6 cm×1.6 cm,考虑良性倾向。因甲状腺超声提示甲状腺右叶中部结节有风险,遂行甲状腺右叶中部结节细针穿刺活组织检查(简称活检),病理提示甲状腺乳头状癌。临床考虑甲状腺癌诊断明确,准备行手术。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,50岁,因发现甲状腺结节1年余、甲状腺功能异常2周就诊。患者2020年自觉颈部增粗,外院甲状腺超声提示双侧甲状腺结节,建议定期复查。2021年10月于本院复查甲状腺超声:甲状腺右叶中部见1.7 cm×1.3 cm×1.1 cm的低回声结节,峡部偏左侧见0.4 cm×0.3 cm×0.4 cm的低回声结节,均形态不规则,边界不清,右叶中部结节可见数个点状强回声,彩色多普勒血流显像(color Doppler flow imaging, CDFI)血流信号丰富,考虑均为有风险结节;双叶内另见数个形态规则、边界清楚的中低回声结节,较大者位于左叶下部,大小为3.3 cm×1.6 cm×1.6 cm,考虑良性倾向。因甲状腺超声提示甲状腺右叶中部结节有风险,遂行甲状腺右叶中部结节细针穿刺活组织检查(简称活检),病理提示甲状腺乳头状癌。临床考虑甲状腺癌诊断明确,准备行手术。
2021年11月完善术前检查,甲状腺功能:促甲状腺激素(thyroid stimulating hormone, TSH)<0.008(0.38~4.34;括号内为正常值范围,下同) mU/L,游离三碘甲状腺原氨酸(free triiodothyronine, FT3) 5.65(1.80~4.10) ng/L,游离甲状腺素(free thyroxine, FT4)17.4(8.1~18.9) ng/L,三碘甲状腺原氨酸(triiodothyronine, T3) 2.37(0.66~1.92) μg/L,甲状腺素(thyroxine, T4)165.0(43.0~125.0) μg/L,甲状腺过氧化物酶抗体(thyroid peroxidase antibody, TPOAb)、甲状腺球蛋白抗体正常,TSH受体抗体(TSH receptor antibody, TRAb)<1 U/L;血常规基本正常;肝功能:丙氨酸氨基转移酶(alanine aminotransferase, ALT)629(7~40) U/L,天冬氨酸氨基转移酶(aspartate aminotransferase, AST) 385(13~35) U/L,总胆红素55.0(5.1~22.2) μmol/L,直接胆红素30.0(≤6.8) μmol/L,碱性磷酸酶(alkaline phosphatase, ALP)193(50~135) U/L,γ-谷氨酰转肽酶(gamma-glutamyl transferase, GGT)119(7~45) U/L。患者在病程中否认怕热、手抖、心悸、吞咽困难、声音嘶哑等不适,既往无特殊病史。
本例患者明确诊断甲状腺乳头状癌,术前检查发现甲状腺功能亢进(简称甲亢),因甲亢会明显增加甲状腺手术风险,若术前准备不充分、未控制好甲亢,术中操作可能导致大量甲状腺激素释放入血,严重者围手术期可能发生甲亢危象,因此临床拟先行甲亢治疗,待控制甲状腺功能后再行手术。
甲亢有不同的病因和发病机制,可由甲状腺激素合成过多导致,也可由甲状腺组织炎性反应和破坏导致已合成的甲状腺激素释放到循环中,2类发病机制可通过甲状腺摄碘试验进行鉴别。该患者24 h摄碘率为49.94%,表明患者甲亢由激素合成过多引起。激素合成过多引起的甲亢常见病因有格雷夫斯病(Graves disease, GD)、毒性腺瘤和毒性多结节性甲状腺肿等,均可用131I、药物或手术进行治疗。
除甲状腺功能异常外,患者术前检查还发现肝功能异常,ALT、AST呈10余倍升高,胆红素亦明显升高。甲亢有时可引起肝功能损伤,其中的可能机制包括体内过量的甲状腺激素对肝脏的直接毒性作用,如抑制肝脏中葡萄糖醛酸基转移酶活性、影响胆红素与葡萄糖醛酸结合,进而影响胆红素从胆汁中排泄,导致血中胆红素升高;另外,甲亢导致机体基础代谢率增高,各组织器官耗氧量明显增加,但肝脏血流量并不相应增加,使肝脏相对缺氧,同时亢进的分解代谢会引起肝脏相对营养不足;甲亢还会促进动脉血液流速加快,对肝动脉末稍支与门脉支的压力调节可能造成干扰,使肝内不易维持正常压力,周围血窦充血扩张,继而压迫肝细胞引起肝功能损伤[1]。上述因素导致的肝功能损伤程度通常较轻,很难解释本例患者ALT、AST的明显升高,因此还需进一步筛查导致肝功能损伤的其他原因,如病毒性肝炎、自身免疫性肝病等。进一步检查发现,患者HAV抗体免疫球蛋白M(HAV-immunoglobulin M, HAV-IgM)阳性,考虑合并甲型病毒性肝炎,予多烯磷脂酰胆碱胶囊、熊去氧胆酸胶囊等保肝药物治疗。
在甲亢治疗的方面,采用硫脲嘧啶类药物治疗时,可能发生皮疹、关节痛、肌痛、胃肠道反应、肝功能损伤、粒细胞减少等不良反应,其中肝功能损伤是相对常见的不良反应。丙硫氧嘧啶(propylthiouracil, PTU)相关肝损伤的发生率为2.7%,多发生在初次用药后3个月内,最常表现为ALT、AST和胆红素的中度升高;而甲巯咪唑相关肝损伤发生率为0.1%~0.2%,多为肝功能轻度受损[2]。患者需在甲状腺癌术前控制甲亢,但该例患者同时合并甲型病毒性肝炎,使甲亢的药物治疗受到一定限制,因此患者寻求131I治疗,以期先用131I控制甲亢,再行手术。
接下来需要考虑的问题是:(1) 131I治疗能否快速控制甲亢,及时为手术创造条件?如果131I治疗甲亢的周期较长,是否会影响患者甲状腺癌的病情?(2) 131I治疗带来的放射性损伤是否会增加手术难度?是否会对甲状腺癌产生潜在影响?(3)除了131I治疗,是否还有其他选择?如何衡量?
131I治疗甲亢是利用射线破坏、清除甲状腺组织,从而达到治疗目的。射线对组织的破坏是1种缓慢持续的过程,一般在治疗后3~6个月患者甲状腺功能逐渐恢复正常。如果患者先行131I治疗控制甲亢,甲状腺癌手术可能要推迟至少3个月。甲状腺乳头状癌是1种相对惰性的肿瘤,除限期手术外,积极的观察等待也是治疗策略之一。既往有研究随访观察了291例低风险的甲状腺乳头状癌患者,其中59例的肿瘤最大径为1.1~1.5 cm,经过中位25个月的积极随访观察后,患者均未出现区域淋巴结转移,仅有3.8%的患者肿瘤增大3 mm以上,但肿瘤体积的增长并未转化为更高的死亡风险,也没有患者因采取观察等待的治疗策略而死亡、发生远处转移或接受更广泛范围的手术[3]。因此,即使131I治疗甲亢的恢复周期较长,也并不会延误手术时机,导致肿瘤进展或影响治疗。
那么,131I治疗带来的放射性损伤是否会影响甲状腺癌或影响手术?电离辐射可能会诱导发生组织纤维化,若要在放疗后的照射野进行手术,可能会因为存在组织纤维化、粘连等导致手术难度增加。电离辐射诱导的组织纤维化通常发生在放疗后4~12个月,发生机制主要是由于电离辐射会损害暴露场中的细胞,导致产生促炎细胞因子[4],随后中性粒细胞、淋巴细胞和单核细胞到达损伤部位,并且募集基质成纤维细胞,之后肌成纤维细胞增殖、细胞外基质降解减少,导致纤维化、血管减少和细胞缺乏。经过131I治疗后,甲状腺组织可能也会发生辐射诱导的组织纤维化,但并不像放疗那样同时影响照射野的所有组织,131I治疗对甲状腺周围组织并不产生明显影响,其带来的放射性损伤可能不会增加手术难度或创伤。
综合来看,本例患者若先行131I治疗控制甲亢,应不会给甲状腺癌和手术带来不利影响,是可行方案。但其是否为最优方案,患者是否还有其他治疗选择?回顾患者病史,甲状腺激素为轻中度升高,其中FT4处于正常范围,患者没有甲亢相关症状或高代谢体征,体格检查心率约90次/min,24 h摄碘率在正常范围,表明患者甲亢程度不太严重。那么在药物治疗中,除了硫脲嘧啶类药物,是否可用其他辅助用药暂时控制甲状腺功能,为手术创造条件?硫脲嘧啶类药物主要通过抑制甲状腺过氧化物酶(thyroid peroxidase, TPO)活性起到阻止甲状腺激素合成的作用,抑制甲状腺内碘与酪氨酸的结合-阻止碘化酪氨酸耦联成T3或T4,另外PTU还能阻止外周组织中的T4向T3转化。除硫脲嘧啶类药物外,甲亢术前还可使用碘剂、短期应用肾上腺皮质激素等方法暂时控制甲状腺激素水平,为手术创造条件,降低围手术期风险。碘剂是通过抑制蛋白质水解酶,减少甲状腺球蛋白的分解,从而抑制T4的释放;碘剂还可减少甲状腺血流量,减少腺体充血,使腺体缩小变硬,减少术中甲状腺组织损伤。肾上腺皮质激素则是通过降低TSH水平来抑制T4向T3转化,并降低周围组织对TSH的反应,保持内环境稳定及抗水肿,预防围手术期甲亢危象的发生。
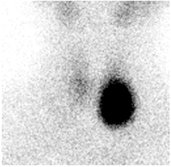
另外,本例患者TRAb阴性,并不支持GD的诊断,那么是否是其他病因造成的甲亢?为进一步明确诊断,患者行甲状腺显像(图1),结果显示甲状腺左叶"热"结节,正常甲状腺组织受抑制,提示甲状腺左叶自主高功能腺瘤可能性大,左叶"热"结节大小与超声所见的左叶下部良性倾向的结节一致。甲状腺毒性腺瘤是手术的良好适应证,围手术期风险明显低于GD,患者为甲状腺左叶毒性腺瘤合并右叶乳头状癌,直接手术是首选的方案。

患者行保肝药物治疗1周后肝功能明显好转,ALT 65 U/L,AST 74 U/L,ALP 132 U/L,GGT 62 U/L,总胆红素29.3 μmol/L,直接胆红素15.4 μmol/L ,HAV-IgM转阴。之后继续保肝药物治疗,并加用甲巯咪唑5 mg,1次/d,共1周,再次复查甲状腺功能FT3、FT4正常,TSH<0.008 mU/L,之后单用碘剂至术前。患者行甲状腺癌根治术,术后病理提示右侧甲状腺乳头状癌(经典型,最大径1.3 cm,侵及甲状腺被膜),左侧甲状腺结节性甲状腺肿伴腺瘤样增生,淋巴结未见转移。
综上,甲亢131I治疗已有多年历史,在临床实践中有时会遇到两难的境地,如何仔细考虑、分析患者面临的问题,权衡利弊,为患者提供最优的选择,是核医学医师要不断修炼的功力。
所有作者声明无利益冲突


























