感染性疾病所致死亡率上升是越来越令人关注的公共卫生问题。早期诊断和治疗是成功治愈急性细菌感染的关键,但这并非易事。CT和MRI等结构影像技术常被引入这一诊疗过程,然而这些技术通常依赖于继发性炎性反应改变,对诊断感染并没有特异性。核医学技术可提供关键的补充信息,并能可视化结构影像无法观察的感染病理生理改变。该篇综述将讨论目前用于诊断细菌感染的结构影像和功能影像技术及其在不同临床情况下的作用。文中还将介绍几种正在开发的新型显像剂,重点关注于靶向细菌特异性代谢的探针。病毒病原体的显像也可遵循类似思路。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
感染性疾病是紧迫的公共卫生问题。即便当前已经发现了多种新的抗微生物靶点[1],并开始关注疾病的早期诊断,但多耐药细菌感染,特别是与医疗行为相关的感染的增加,仍导致死亡率上升[2]。早期诊断对患者的管理至关重要,但实现起来却并非易事。尽管临床病史、体格检查、血清培养和单纯X线平片均有助于诊断感染,一些情况还需更为复杂的影像学检查[3]。导致诊断困难的重要原因之一是感染性疾病和非感染性炎性疾病患者具有相似的症状和体征,尤其是在慢性感染、免疫缺陷和老年人群患者中[4,5,6]。
当诊断需要更复杂的影像学技术介入时,CT、MRI和超声等结构影像通常是下一步诊断方案的首选。这些技术擅长识别体内异常液体,包括器官组织内的或散在分布的(如脓肿)。这种液体的异常分布与血管舒张和血管通透性增加有关,可导致组织水肿和正常脂肪信号的改变。然而,这些征象是非特异性的,即在感染和其他非感染性炎性反应中均可出现[7,8]。此外,慢性感染发生的解剖改变,如骨髓炎中的骨破坏可影响研究者对活动性病变和治疗后改变的区分[8,9]。
SPECT和PET等核医学技术已被用于解决这一问题。该技术可将结构影像不能显示的感染的病理生理改变可视化。联合使用结构影像,可进一步提高SPECT和PET的诊断准确性,并可利用较单独核医学技术更高的分辨率精确定位病灶[10]。因此,PET/CT、PET/MR和SPECT/CT双模态显像技术在感染性疾病显像领域具有巨大潜力。
本综述讨论了当前用于细菌感染诊断的显像技术,重点是使用的核医学方法及其局限性,以及适用的常见临床情况,同时简要回顾了目前正在开发的新型显像剂,重点介绍针对细菌代谢的显像剂。
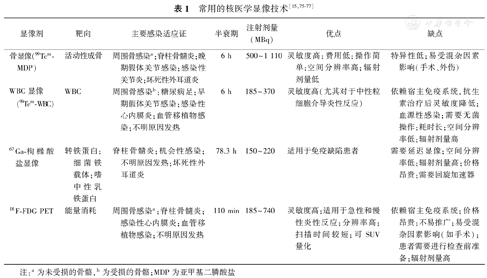
影像学检查常被用于诊断急性感染,包括X线平片、超声、CT和MRI在内的结构成像可以确定常伴随细菌感染的异常组织或积液的存在,如在急诊科,实时超声可以作为有效工具尽早识别感染性病灶[11],胸部X线平片可用于检测肺组织充气部分被液体或实性组织填充而导致的实变影,同样CT和MRI也可以显示炎性反应和脓肿的存在。上述结构影像提供的诊断信息可由核医学技术(PET和SPECT)进一步补充,因为核医学技术代表了一种分子成像,可用于研究生化和生理异常。PET和SPECT非常有助于疑难病例或组织取样困难病例的诊断。本节内容总结了结构影像和当前临床核医学技术(图1)。

1.结构影像技术。评估组织结构改变最常用的无创性检查法是CT。这种广泛使用的检查可产生高分辨率图像,被认为是多种临床情况下的一线选择[12]。然而,CT对早期感染的探测灵敏度较低,因为早期病变常没有解剖结构的改变;而在疾病后期,持续的解剖异常往往又会掩盖慢性活动性感染。此外,电离辐射以及一些患者对碘造影剂的过敏反应也限制了CT的使用[6,12,13]。相比之下,MRI不会产生电离辐射[12],即使在没有对比剂的情况下也能提供非常好的软组织区分[10],可用于评估非钙化组织(如韧带和内脏),而对组织含水量的高度敏感使其可用于诊断炎性反应、肿瘤、缺血和其他病变[14]。但MRI对术后患者的评估价值较低,对有金属植入物或心脏起搏器的患者可能存在潜在风险[6,9]。
2.功能影像技术。近年来,人们对核医学技术(如SPECT和PET)用于感染性疾病的兴趣越来越浓厚[15,16],并预测其发现的代谢异常要先于结构影像发现的形态异常[17,18]。核医学与结构影像结合的技术(如PET/CT)可以实现更好的分辨率、更精确的病理定位,使得该法极具吸引力[19,20]。下文讨论了目前在感染诊断中临床可用的核医学显像技术(表1)。
| 显像剂 | 靶向 | 主要感染适应证 | 半衰期 | 注射剂量(MBq) | 优点 | 缺点 |
|---|---|---|---|---|---|---|
| 骨显像(99Tcm-MDP) | 活动性成骨 | 周围骨感染a;脊柱骨髓炎;晚期假体关节感染;感染性关节炎;坏死性外耳道炎 | 6 h | 500~1 110 | 灵敏度高;费用低;操作简单;空间分辨率高;辐射剂量低 | 特异性低;易受混杂因素影响(手术、外伤) |
| WBC显像(99Tcm-WBC) | WBC | 周围骨感染b;糖尿病足;早期假体关节感染;感染性心内膜炎;血管移植物感染;不明原因发热 | 6 h | 185~370 | 灵敏度高(尤其对于中性粒细胞介导炎性反应) | 依赖宿主免疫系统,抗生素治疗后灵敏度降低;血源性感染;需要无菌操作;耗时长;空间分辨率低;辐射剂量高 |
| 67Ga-枸橼酸盐显像 | 转铁蛋白;细菌铁载体;嗜中性乳铁蛋白 | 脊柱骨髓炎;机会性感染;不明原因发热;坏死性外耳道炎 | 78.3 h | 150~220 | 适用于免疫缺陷患者 | 需要延迟显像;空间分辨率低;辐射剂量高;价格昂贵;需要回旋加速器 |
| 18F-FDG PET | 能量消耗 | 周围骨感染a;脊柱骨髓炎;感染性心内膜炎;血管移植物感染;不明原因发热 | 110 min | 185~740 | 灵敏度高;适用于急性和慢性炎性反应;分辨率高;扫描时间较短;可SUV量化 | 依赖宿主免疫系统;价格昂贵;不易推广;易受混杂因素影响(如手术);患者需要进行检查前准备;辐射剂量高 |
注:a为未受损的骨骼,b为受损的骨骼;MDP为亚甲基二膦酸盐
(1)骨显像。骨显像是1种具有高灵敏度的技术[20,21],使用标记的二膦酸盐[最常用的是99Tcm-亚甲基二膦酸盐(methylene diphosphonate, MDP)]作为活性骨形成的标记物。其在病理过程中的摄取主要取决于2个因素:骨转换和血流灌注[16,19,20]。在大多数骨骼病变(如感染、创伤和肿瘤)的情况下,骨转换和血流灌注均会出现异常,因此骨显像通常需要1种补充的显像方法来实现诊断[20]。骨显像通常根据所怀疑的病变采用单时相或不太常用的三时相显像。单时相显像在注射后几个小时内进行,用于显示骨骼自身的代谢活性。相对于单时相显像,三时相骨显像(triple-phase bone scan, TPBS)使用3个不同的时间点采集图像:血流相,在注射后即刻显像,用于显示炎性反应部位的血流灌注;血池相,显示血流和毛细血管扩张导致血液在软组织和骨组织中的积聚;骨摄取相,显示大部分软组织显像剂被洗出后的骨骼重建过程[19]。在鉴别骨感染与其他常见临床情况时,TPBS尤其有价值。例如,与骨髓炎不同,软组织感染在骨摄取相不会显示出显像剂积聚[19]。
(2)标记自体白细胞显像(WBC显像)。WBC显像是1种相当常用且灵敏的技术,可探测到被标记的WBC通过趋化和血细胞渗出迁移到感染部位[3,22,23],被认为是多种感染性疾病的标准检查方法,但也存在一些缺点[23]。WBC显像费力、耗时,且医务人员有暴露于血液制品的风险。WBC显像需要仔细的患者识别,并从全血样本中提取和分离WBC,随后将WBC与99Tcm或111In一起温育,然后去除未结合的显像剂,并在显像前将细胞重新注入患者体内[22,24]。由于淋巴细胞对辐射敏感,并且这种检查要求患者至少有2 000个WBC(细胞/ml),所以不适合机会性感染或慢性感染患者,也不适用于粒细胞减少症患者[22,24,25]。此外,网状内皮细胞在骨髓中对标记WBC的吞噬作用可以模拟正常的造血过程,因此导致感染与骨髓反应性增生难以区别。一种可能的解决方案是将WBC显像与额外的骨髓显像结合起来,这种联合技术可获得1组额外的99Tcm-硫胶体图像,以显示正常的骨髓分布,从而提高影像诊断的特异性[26]。
(3) 67Ga-枸橼酸盐显像。尽管相较于过去,67Ga-枸橼酸盐显像的使用有所下降[17,18,25],但对于几种疾病其仍是良好的选择,特别是对于脊柱骨髓炎[25]。67Ga-枸橼酸盐显像常作为无法使用MRI或18F-FDG PET/CT时的替代方法,其与骨显像结合有很高的灵敏度[4,13]。不同于WBC显像,67Ga-枸橼酸盐显像不需要免疫细胞的直接参与,因此更适合于有免疫缺陷的患者[27]。镓在感染部位积聚有不同的可能机制。由于镓与铁类似,其与转铁蛋白结合,在血管通透性增加和血流增加的帮助下被招募到炎性反应部位;镓也可结合细菌铁载体和中性粒细胞中激活的乳铁蛋白,被巨噬细胞部分吸收[6,18,27]。
(4) 18F-FDG PET。PET最初用于肿瘤学,目前在核医学技术中占主导地位[15,17],最广泛使用的显像剂是18F-FDG,这是1种葡萄糖类似物,可在肿瘤、活跃的炎性反应细胞等代谢率高的细胞中积聚。尽管并非特异性地针对细菌本身的存在[17],但炎性反应细胞(中性粒细胞、巨噬细胞和淋巴细胞)在感染不同阶段表现的糖酵解增加使得18F-FDG适用于各种急、慢性疾病的检出[17,18]。此外,18F-FDG具有良好的药代动力学特性,能够在缺血部位灌注,并可于注射后约60 min的显像,这一较短时间延迟有助于提高显像效率[17,18]。然而,这种检查费用昂贵,且并未普及应用[17],其要求患者保持低碳水化合物饮食,并在显像前6 h禁食,避免类固醇药物使用,调节葡萄糖水平,同时在检查前24 h避免高强度运动[28]。因此,患者检查前准备过程的差异会给显像结果带来很大的可变性。
影像学检查对于评估深部感染至关重要,例如发生于胸部、腹盆腔的感染或原因不明的感染。这种情况通常见于住院患者,需使用多种结构影像和功能影像进行评估,包括X线平片、超声、CT和MRI。一般结构影像足以识别脓肿或其他病变,核医学技术则对以下讨论的3种感染情况具有更重要和广泛的作用:肌肉骨骼感染,包括发生于关节、骨骼及骨科假体的感染;心血管系统感染,特别是心脏赘生物和植入物相关感染;原因不明的感染,即不明原因发热(fever of unknown origin, FUO)。
1.肌肉骨骼感染——骨髓炎。骨髓炎是1种骨骼及其周围组织的感染性病变,常由金黄色葡萄球菌引起。这种疾病常通过血液传播,但也可局部扩散,特别是在创伤或手术情况下[9,16]。由于骨髓炎的临床症状缺乏特异性,可无发热或疼痛,且体格检查与实验室检查结果可能并不匹配,故延误诊断的情况常见[29],这种延误对于假体关节感染可能会带来较严重的后果,需将移除受感染的假体作为唯一的治疗方法[30]。对于有持续性症状且无神经功能损伤的患者,临床检查首选X线平片。但X线平片灵敏度和特异性较低,往往在疾病晚期才表现阳性,故主要用于排除其他疾病[31]。平扫MRI是一种更准确的检查,可以在感染发生的2 d内发现组织变化,并确定骨骼和周围组织的受累情况,因MRI同时具有较高的灵敏度、特异性及阴性预测值,若发病1周仍为阴性,足以作为排除诊断的依据[16,31,32]。对于大多数疑似骨髓炎的患者来说,核医学技术通常作为补充方法使用,因为其具有高灵敏的特征[20]。但以现有的技术准确诊断骨髓炎,目前研究尚存差异[31,33]。
(1)外周骨感染。未受损的骨骼发生急性感染时,推荐使用TPBS,并以SPECT/CT技术辅助[9,31],这种高灵敏技术是排除感染的极佳方法,尤其在疾病发生概率低的情况下[31]。然而,一旦骨骼经历过干预(如创伤、手术或放置金属硬件等),TPBS的低特异性会因为骨重塑过程的影响而进一步降低,从而使WBC显像或骨髓显像成为首选检查[9,26,31]。18F-FDG PET/CT对受损的骨骼诊断效果也不佳,目前主要推荐用于临床怀疑有弥散性疾病的情况[31]。
(2)脊柱骨髓炎。在脊柱骨髓炎诊断中,67Ga-枸橼酸盐显像常与骨显像联合应用,可很好地替代MRI,其灵敏度和特异性均在90%以上[4]。然而,18F-FDG PET/CT在诊断脊柱骨髓炎方面比67Ga-枸橼酸盐显像和骨显像更具优势[34]。有研究表明,18F-FDG PET/CT对于早期感染(2周内)和低毒力感染的诊断效能优于MRI,且在检测慢性骨髓炎方面也表现优异,各疾病阶段的总体灵敏度为96%[35]。然而,18F-FDG PET/CT缺乏区分感染与无菌性炎性反应的能力[36]。不推荐WBC显像用于脊柱骨髓炎,因其灵敏度低,且脊柱骨髓炎的影像表现与一些刺激骨髓转换的其他疾病类似[4,9]。
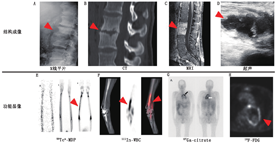
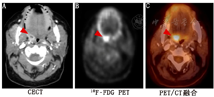
(3)假体关节感染。TPBS常被用于诊断假体关节感染,但在术后2年内骨重建过程会使其应用受到一些限制。在这一早期阶段,推荐使用WBC显像或骨髓显像,因为准确性高,具有排除诊断能力[15,33]。然而,最近1项有关慢性肩关节假体感染的研究却发现了与上述观点相悖的结果,WBC或骨髓显像的灵敏度仅为18%[37]。图2为WBC显像在1例64岁女性膝关节置换术后患者中诊断假体关节感染的示例。

虽然18F-FDG PET/CT在假体关节感染诊断中的作用尚不完全明确[15],但18F-FDG标记的WBC PET/CT在有关节疼痛症状的关节置换术后患者中显示出了良好效果,表明这种方法可能比单独使用18F-FDG PET/CT更具特异性[38]。
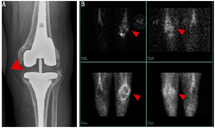
2.心血管系统感染。近年研究显示,核医学影像,特别是与结构影像结合的技术在心血管系统感染诊断中起着重要作用。虽然核医学影像一般仅用于其他影像方法无法诊断的情况或评估并发症和治疗反应,但其在心血管疾病中的应用正在不断拓展[39]。2015年,根据人工瓣膜心内膜炎Duke标准,核素标记的WBC SPECT/CT和18F-FDG PET/CT作为辅助方法被纳入欧洲心脏病学会感染性心内膜炎指南,用于协助诊断可能的感染性心内膜炎,同时检测心外感染灶和监测治疗反应[40]。无论有无症状,18F-FDG PET/CT可在约40%的感染性心内膜炎患者中检出阳性栓子[39],但栓子小于5 mm时易出现假阴性,术后非特异性显像剂摄取可能会使其应用受限[40]。相比之下,核素标记WBC SPECT/CT灵敏度较低,但更具特异性,即便在术后也不受影响[41]。上述2种显像方法联合应用时,特异性近100%,充分展示了多种显像协同作用的优势[40,42]。图3为1例59岁感染性心内膜炎患者的18F-FDG PET/CT图像示例。
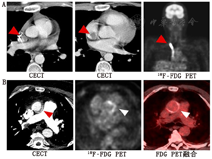

另一方面,核医学技术还可用于一些少见疾病的诊断,如血管移植物感染,而这些疾病通常是靠CT血管造影诊断的。最近的荟萃分析显示,WBC SPECT/CT的整体灵敏度和特异性明显高于18F-FDG PET/CT或CT血管造影,提示前者可能是诊断此类疾病最准确方法[42]。
3.FUO。虽然FUO影像检查通常从胸部X线平片和腹部超声开始[13],但最近研究显示出18F-FDG PET/CT显像的价值,并建议在疾病评估的早期阶段进行该项检查[13,43]。以往在FUO诊断中,67Ga-枸橼酸盐显像曾作为可选的核医学方法[24],但最近的荟萃分析表明,其灵敏度、特异性和诊断率都较低[44]。另1项67Ga-枸橼酸盐SPECT/CT与18F-FDG PET/CT的比较研究显示,后者具有更高的灵敏度和临床贡献[45]。
标记WBC显像是另1种可考虑的方法,尽管研究者认为其对那些高度怀疑感染的患者是准确的,尤其是对于术后患者[46],但多项使用WBC诊断FUO的研究却显示其灵敏度和诊断率低,特别是与18F-FDG PET/CT比较时[13,44,47]。尽管许多研究已表明了18F-FDG PET/CT在FUO诊断中的优势,但在18F-FDG PET/CT无法获得使用的情况下,仍可采用67Ga-枸橼酸盐和WBC显像[13,47]。图4为1例转移癌患者在18F-FDG PET/CT检查中偶然发现了扁桃体脓肿,显示出该法对隐匿性感染灶的定位能力。

当前越来越多的文献报道了PET和SPECT显像在感染诊断中的应用,显示了人们对这一领域的兴趣日益增加。除了上述临床使用的显像剂外,有关用于区分感染和无菌炎性反应的多种新方法也有报道,其中不乏一些显像剂针对特定的微生物途径,包括细菌特异的糖转运、叶酸生物合成、铁蓄积和细胞壁成分(特别是肽聚糖)[17,18,48]。本节简要回顾近10年来作为细菌敏感PET显像剂的小分子(相对分子质量<1 000)(表2),其中不包括一些基于蛋白质和肽的创新显像剂方法(包括核素标记抗体)。一些显像实例及相关显像剂结构图见图5,图6。


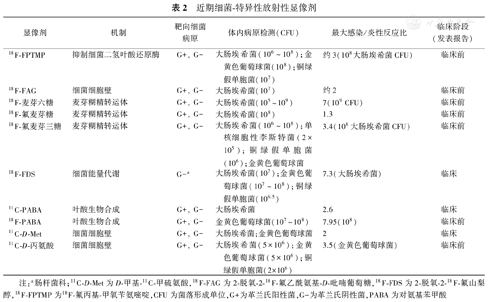
近期细菌-特异性放射性显像剂
近期细菌-特异性放射性显像剂
| 显像剂 | 机制 | 靶向细菌病原 | 体内病原检测(CFU) | 最大感染/炎性反应比 | 临床阶段(发表报告) |
|---|---|---|---|---|---|
| 18F-FPTMP | 抑制细菌二氢叶酸还原酶 | G+,G- | 大肠埃希菌(106~108);金黄色葡萄球菌(108);铜绿假单胞菌(107) | 约3(108大肠埃希菌CFU) | 临床前 |
| 18F-FAG | 细菌细胞壁 | G+,G- | 大肠埃希菌(107) | 约2 | 临床前 |
| 18F-麦芽六糖 | 麦芽糊精转运体 | G+,G- | 大肠埃希菌(105~109) | 7(109 CFU) | 临床前 |
| 18F-氟麦芽糖 | 麦芽糊精转运体 | G+,G- | 大肠埃希菌(108) | 1.3 | 临床前 |
| 18F-氟麦芽三糖 | 麦芽糊精转运体 | G+,G- | 大肠埃希菌(106~108);单核细胞性李斯特菌(2×105);铜绿假单胞菌(106);金黄色葡萄球菌 | 3.4(108大肠埃希菌CFU) | 临床前 |
| 18F-FDS | 细菌能量代谢 | G-a | 大肠埃希菌(107);金黄色葡萄球菌(107~108);铜绿假单胞菌(106.5) | 7.3(大肠埃希菌) | 临床 |
| 11C-PABA | 叶酸生物合成 | G+,G- | 大肠埃希菌 | 2.6 | 临床 |
| 18F-PABA | 叶酸生物合成 | G+,G- | 金黄色葡萄球菌(107~108) | 7.95(108) | 临床前 |
| 11C-D-Met | 细菌细胞壁 | G+,G- | 大肠埃希菌;金黄色葡萄球菌 | 2 | 临床 |
| 11C-D-丙氨酸 | 细菌细胞壁 | G+,G- | 大肠埃希菌(5×106);金黄色葡萄球菌(5×106);铜绿假单胞菌(2×106) | 3.5(金黄色葡萄球菌) | 临床前 |
注:a肠杆菌科;11C-D-Met为D-甲基-11C-甲硫氨酸,18F-FAG为2-脱氧-2-18F-氟乙酰氨基-D-吡喃葡萄糖,18F-FDS为2-脱氧-2-18F-氟山梨醇,18F-FPTMP为18F-氟丙基-甲氧苄氨嘧啶,CFU为菌落形成单位,G+为革兰氏阳性菌,G-为革兰氏阴性菌,PABA为对氨基苯甲酸
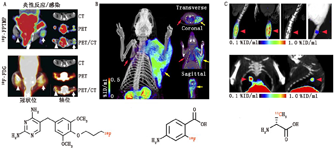
1.抗生素。许多抗生素和抗真菌药物作为细菌特异性的诊断显像剂已被研究,其中对环丙沙星的研究最为深入。尽管最初认为99Tcm-环丙沙星有希望用于显像,但几个临床试验显示出不一致和令人不满意的结果,表明其对细菌感染的特异性较低[49,50]。近期1项研究推测,这种低特异性可能与抗药性细菌的增加有关[51]。Sellmyer等[52]最近发表了1项更有前景的研究,报道了用PET研究1种细菌性二氢叶酸还原酶抑制剂的类似物18F-氟丙基-甲氧苄氨嘧啶,其可在啮齿动物模型中区分感染、化学性炎性反应和肿瘤(图5A)。为了证明其临床应用前景,研究者对11C-甲氧苄氨嘧啶进行的剂量学研究结果表明,患者吸收的辐射剂量在安全范围内[53],目前这种显像剂正在临床试验中行进一步评估。其他氟喹诺酮类、头孢菌素类和几种抗结核药物的影像学研究数据尚未获得令人满意的结果[18,48,54]。
2.碳水化合物。2-脱氧-2-18F-氟乙酰胺-D-吡喃糖是第1批被探索作为感染特异性显像剂的碳水化合物之一,其是1种氨基葡萄糖,可在大鼠中识别大肠埃希菌感染,其显像剂在感染组织与炎性反应组织中的累积量约为计算值的2倍[55]。细菌普遍存在的己糖磷酸转运体也是研究对象之一,Mills等[56]将18F-FDG磷酸化,生成该转运体的底物2-脱氧-2-18F-氟-D-葡萄糖-6-磷酸,在体外显示出很好的效果。然而,尽管该显像剂可在小鼠中区分感染和无菌炎性反应,但较低的信号和与18F-FDG相似的生物分布使研究者对其临床应用有所担忧。
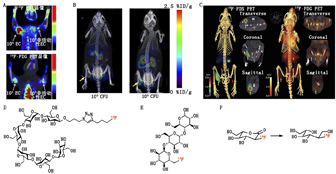
一些研究团队将研究瞄准了麦芽糊精转运体,这是1个众所周知的负责细菌细胞中碳水化合物吸收的系统。有研究者在大肠埃希菌感染的早期阶段将18F-麦芽六糖用于区分活菌和死菌,在感染大肠埃希菌的大鼠中取得了令人欣慰的初步结果(图6A),其灵敏度和特异性均高于18F-FDG,在感染组织中显像剂的累积量是无菌对照组织的7倍,且对耐药菌敏感[57]。Gowrishankar等[58]也用18F-氟麦芽糖进行了相似的研究,结果显示该显像剂在感染组织中的摄取比无菌炎性反应和高背景噪声增加约1.3倍。随后,该研究小组研发的二代显像剂18F-氟麦芽三糖显示出更好的结果,在大肠埃希菌和铜绿假单胞菌中均有积累,大肠埃希菌感染组织中的摄取比无菌对照高3.4倍,信噪比也得到改善(图6B)[59]。
2-脱氧-2-18F-氟山梨醇(2-deoxy-2-18F-fluorosorbitol, 18F-FDS)是1种氟化山梨糖醇类似物,于2008年首次被Li等[60]作为潜在的癌症生物标志物被报道。这种糖醇由18F-FDG的少量化学还原生成。2014年Weinstein等[61]以这种糖在革兰氏阴性菌中的代谢为前提进行了研究,发现在有免疫力的小鼠和免疫缺陷的小鼠中,被肠杆菌感染的组织对18F-FDS的摄取均比无菌性炎性反应高7倍(图6C)。此外,被感染了大肠埃希菌的药物敏感小鼠和耐药小鼠在以头孢曲松治疗后,显像剂信号均显著下降。上述结果表明,18F-FDS不仅可帮助监测抗菌治疗,还可识别耐药细菌,从而使患者获得更精准的治疗[61]。此后的临床试验还以健康志愿者证实了18F-FDS的安全性[62]及其良好的肾动力学[63]。
3.辅因子或DNA合成。叶酸生物合成途径已被用做抗生素治疗的靶点,最具代表性的是甲氧苄氨嘧啶或磺胺甲恶唑治疗(分别抑制二氢叶酸还原酶和二氢蝶呤还原酶)。对氨基苯甲酸(paraaminobenzoic acid, PABA)作为叶酸前体存在于细菌中,但不存在于哺乳动物细胞中,11C-PABA[8]和18F-PABA[64]均曾作为其核素标记形式被研究。PABA在革兰氏阳性菌和革兰氏阴性菌均有表达,可用于识别感染组织。在大肠埃希菌和金黄色葡萄球菌感染中,感染组织与无菌性炎性反应组织对11C-PABA和18F-PABA的摄取比值分别为2.6和7.95(图5B)。有趣的是,当作为饱和代谢过程中的1种手段将未标记的氟-PABA添加到含有18F-PABA的溶液中时,显像剂摄取明显增加,感染与无菌性炎性反应摄取比可高达9.38±2.43。此外,有研究报道经抗生素治疗后的感染组织对18F-PABA的摄取减少,这一发现可能在未来观察治疗反应中发挥作用[64]。因此,这些叶酸前体与以叶酸生物合成18F-氟丙基-甲氧苄氨嘧啶为靶点的抗生素衍生出的PET显像剂密切相关。
核苷类似物124I-氟-碘阿糖呋喃基尿嘧啶(5-iodo-2′-fluro-1-beta-D-arabinofuranosyluracil, FIAU)是1种更明确的针对细菌DNA合成的显像剂,被胸苷激酶磷酸化后滞留于细菌细胞内[16]。虽然在动物研究中,这种显像剂的前景被看好[18],但临床试验的结果尚不确定。虽然124I-FIAU在1组少数患者中成功诊断了肌肉骨骼感染,但评估假体关节感染的特异性低,且图像质量也不佳[65]。
4.铁运输与储存。67Ga-枸橼酸盐是1种广为人知且成熟的SPECT显像剂,但其在核医学影像中的作用正在下降。然而,铁代谢仍然是核医学显像研究的热点,镓(Ⅲ)则被广泛认为是铁(Ⅲ)的替代品。68Ga-枸橼酸盐是1种半衰期为68 min的PET显像剂,可当日显像,且图像质量优于67Ga[66,67],但诊断价值存在争议。尽管68Ga-枸橼酸盐在诊断椎间盘炎和骨髓炎[68]、区分假体关节的脓毒性和无菌性炎性反应[69]及鉴别活动性和非活动性结核病变[70]方面表现出很高的灵敏性,但在动物模型中却未能显示出较以往方法(如标记WBC显像和18F-FDG PET)所具有的优势。此外,在60例疑似骨关节感染或FUO的患者中,其诊断效能甚至低于67Ga-枸橼酸盐(P<0.05)[67]。
铁载体是细菌和真菌共同使用的分泌型铁螯合剂,已被广泛用于细菌和真菌特异性检测的研究[48]。Petrik等[71,72]几项研究显示了病原体特异性铁载体用于显像研究的潜力,他们先以体外和体内研究表明68Ga-三乙酰镰刀菌碱C和68Ga-铁氧胺E均可作为真菌显像的有效工具,后来又证实68Ga-铜绿假单胞菌铁载体-PAO1(1种由绿脓杆菌感染导致含铁细胞产生的铁载体)在被假单胞菌感染的肺组织中摄取增加,且在动物模型中的分布优于18F-FDG和68Ga-枸橼酸盐[72]。
5.D-氨基酸。另1种针对细菌特异性结构的方法是研究细菌细胞壁底物,特别是肽聚糖。由于哺乳类动物细胞一般使用L-氨基酸作为代谢底物,D-氨基酸被认为对细菌代谢更具特异性。此外,在革兰氏阳性和革兰氏阴性细菌中D-氨基酸能快速结合到细菌肽聚糖中,这为感染显像提供了值得关注的靶点。Neumann等[36]发现感染大肠埃希菌和金黄色葡萄球菌的小鼠快速摄取D-甲基-11C-甲硫氨酸,而在无菌性炎性反应对照组中则未见摄取[36]。此外,最近Parker等[73]发表的论文显示,在小鼠模型中11C-D-丙氨酸在急性细菌性肌炎的积累量是无菌炎性反应对照组的3.5倍,而68Ga-枸橼酸盐在同一模型中的累积量仅是无菌炎性反应对照组的2倍;另外,在椎间盘炎-骨髓炎模型中,11C-D-丙氨酸的摄取是相邻椎间盘的3.3倍;在铜绿假单胞菌肺炎中的摄取是正常肺组织的1.8倍(图5C)[73]。
目前,探测细菌感染核医学显像的局限性激发了许多针对细菌特异性蛋白和代谢途径新方法的探索,尽管研究的显像剂仍需要进一步验证,但该领域的成功可能会在临床实践中改变对感染性疾病的诊疗管理。