
SPECT心肌灌注显像作为确诊或可疑冠状动脉粥样硬化性心脏病(简称冠心病)患者诊疗流程中必不可少的一项技术,已获得临床的广泛认可。计算机技术为SPECT心肌灌注显像的标准化提供了客观的定量评价,极大地推动了其临床推广和应用。软件平台已成为为临床提供经过研究、开发并验证具有临床实用性的定量算法的1个重要渠道,可以让世界各地的临床专家都能从中受益。该篇医学继续教育文章(第1部分)介绍了诸多临床上已明确并应用的定量工具,更为重要的是描述了临床医师如何将其常规用于对冠心病患者的诊断、临床管理和指导治疗方案的制定。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
核心脏病学包括对心肌灌注、右心室和左心室(left ventricular, LV)功能、收缩同步性、心肌底物代谢、神经支配和炎性反应的评估。核心脏病学影像技术本质上是数字化的和可定量分析的,其图像很容易被转换成数字像素的阵列。核心脏病学的科学性和临床价值已被过去40年来出版的众多书籍和文章所提供的大量证据证实[1]。已发布的SPECT和PET显像指南中阐述了诸多有明确临床应用价值的定量参数[2,3]。
本项继续教育分2篇文章,旨在对定量核心脏病学的现状进行简要介绍。作者的目的有二。第一是介绍软件,包括第1部分的诸多临床上经过验证的定量分析软件,以及第2部分的在核心脏病学中正发展或新兴的软件;第二,毫无疑问是最重要的,即让诊断医师使用现有的软件来提高对心脏病患者的科学管理,学习新软件并将其应用于临床实践中。
1.心肌灌注显像(myocardial perfusion imaging, MPI)相对定量数据库。(1)灌注定量分析。LV心肌灌注定量分析是核心脏病学软件包的基本模块之一。进行该定量分析时,心肌灌注的三维放射性分布被投射到1个标准模板中,以减少不同患者之间LV大小和形状的差异。灌注分布从LV短轴图像中获取,并且以周向计数曲线的形式表现。将从LV基底部(靶心图的外周)到心尖部(靶心图的中心)的放射性计数剖面投射到同心圆中,形成二维靶心图的标准模板(图1)[4]。采用这种方式分别计算并获得负荷图像和静息图像的靶心图,从而评估负荷试验导致的心肌灌注异常变化,并通过进一步与静息图像比较,将心肌灌注减低部位区分为缺血心肌或梗死心肌。然后以LV最正常区域(放射性摄取最高的部位)的心肌放射性摄取作为标准,将靶心图的分布归一化为100%,从而获得其余心肌节段的相对心肌灌注,即每个节段区域相对于最正常心肌部位的放射性摄取百分比(%)。
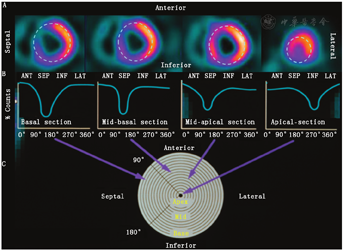

通过相对心肌灌注图,可以用简单的阈值将心肌节段分为轻度(例如<70%)、中度(例如<60%)和重度(例如<50%)灌注减低区。该方法假设整个LV心肌正常灌注分布是均匀的。不足之处:有些处理会在计算放射性计数时导致不均匀性(最明显的是光子衰减),导致光子减少或错位,使获得的放射性分布图像与真实的心肌灌注分布不一致。最明显的放射性衰减伪影是乳腺软组织导致的组织衰减,这使靶心图显示的前间隔部位放射性计数减少,此外,因膈肌或躯干组织导致的组织衰减会使靶心图显示的后侧壁部位放射性计数减少。
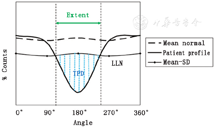
(2)放射性分布相对值与数据库定量分析对比。光子衰减非常依赖于身体特性和组织密度,因此不同患者间的光子衰减存在明显差异。为了评估局部因素对心肌灌注分布的影响,通常从年龄相匹配且冠状动脉粥样硬化性心脏病(coronary artery disease, CAD)验前概率低(≤5%)的人群获得靶心图放射性分布(计数),把大样本数据(例如>20例)的放射性分布值进行平均,从而获得靶心图中每个心肌区域估算的平均值和标准差(standard deviation, SD),以这种方式绘制的靶心图被称为正常心肌灌注数据库。平均值和SD估算来自每个靶心图节段区域,因此可以通过设定几个SDs来定义每个心肌节段的阈值,例如,当1个节段区域的平均值为80%,SD为5%,则可以使用2个SDs作为轻度减低的阈值(70%=80%-2×5%),4个SDs(60%)定义为中度减低,6个SDs(50%)定义为重度减低。该方法仍然是心肌灌注定量分析的标准方法(图2)[5]。当行常规SPECT MPI而未行衰减校正(attenuation correction, AC)时,该方法可以用于解释衰减效应。所以,与采用统一阈值相比,其具有更高的准确性。

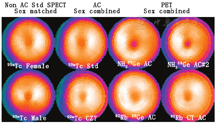
(3)正常心肌灌注数据库。局部衰减效应需要使用正常数据库,该数据库由与测试患者身体特性相匹配的人群组成。因此,平均体质量指数约为30的北美数据库不应该用于平均体质量指数较低的国家,如平均体质量指数为22的日本[6]。影响衰减的其他因素有显像体位(仰卧、俯卧、直立)和光子能量,这意味着应使用与患者情况匹配的数据库。图像重建算法也会影响对心肌灌注分布的计算,平滑程度取决于采用的重建算法、滤波函数和迭代次数。迭代重建的优点之一是可以在重建过程中对光子衰减进行建模和校正。当采用适当的建模和校正时,测量的放射性分布与真实的心肌灌注分布会非常一致。在这种情况下,数据库可以在不同性别、不同患者群体、光子能量和成像位置之间互换使用,这在心脏PET显像中更为常见。
最新一代心脏专用SPECT相机和先进的迭代重建软件方法[7,8,9,10,11]显著减少了显像时间和使用的放射性药物剂量[12,13,14,15,16]。但是,对于减少剂量/时间的图像,如果重建参数未根据增加的噪声进行相应的调整,则可能需要使用"计数匹配"的正常数据库,以避免出现普通正常数据库和减少剂量/时间的图像之间噪声不匹配导致的偏差[15,16,17]。另一影响正常心肌灌注分布的因素是显像技术。图3举例说明了SPECT和PET正常显像模式、标准SPECT与碲-锌-镉显像、AC与未衰减校正(non-attenuation correction, non-AC)显像之间平均正常心肌灌注靶心图显示的局部相对灌注差异。

(4)心肌节段的灌注评分标准。对心肌灌注异常部位和程度的视觉评估方法在2002年被标准化为17节段法,其为整个LV心肌灌注的异常程度提供了简便的评分模板(0到4:正常到灌注缺损)[18]。采用前面描述的正常数据库定量方法,可以将阈值对应的每个具体的心肌灌注减低异常程度进行评分,从而自动生成17个心肌节段的评分图。分别对负荷和静息图像的17节段进行评分,可以获得17个心肌节段的心肌灌注异常的部位、严重程度以及从负荷到静息的差值。
节段的负荷总积分(summed stress score, SSS)和静息总积分(summed rest score, SRS)对核心脏病技术评估患者预后有增益价值[19]。使用上述总积分可以评估心肌灌注减低占LV百分比(%LV)的范围,即SSS与最大总积分的比率[SSS/68(即17个节段×4的最大得分)×100%],这是对总心肌灌注减低范围的严重性进行的加权估算。图4说明了SSS为18如何转换成LV灌注减低范围26%。由于定量靶心图有几百个心肌区域(sector),与简化的17个心肌节段相比,其对心肌灌注减低的严重程度评估可通过连续的异常评分直接获得,对心肌灌注减低范围的估测更准确,评估结果常被称为总灌注缺损(total perfusion deficit, TPD)[20](图2)。TPD及其严重性权重的%LV为核心脏病学显像诊断CAD和评估个体化特点提供了更定量化的方法。表1列出了已明确的LV心肌灌注定量方法及其判断心肌灌注异常的阈值标准。
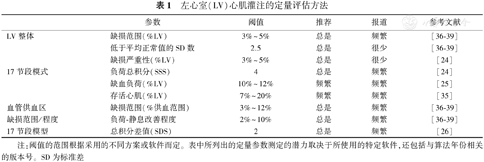
左心室(LV)心肌灌注的定量评估方法
左心室(LV)心肌灌注的定量评估方法
| 参数 | 阈值 | 推荐 | 报道 | 参考文献 | |
|---|---|---|---|---|---|
| LV整体 | 缺损范围(%LV) | 3%~5% | 总是 | 频繁 | [36,37,38,39] |
| 低于平均正常值的SD数 | 2.5 | 总是 | 很少 | [36,37,38,39] | |
| 缺损严重性(%LV) | 3%~5% | 总是 | 很少 | [24] | |
| 17节段模式 | 负荷总积分(SSS) | 4 | 总是 | 频繁 | [24] |
| 缺血负荷(%LV) | 10%~12% | 频繁 | 频繁 | [25] | |
| 存活心肌(%LV) | 7%~20% | 频繁 | 频繁 | [35] | |
| 血管供血区 | 缺损范围(%供血范围) | 3%~12% | 总是 | 频繁 | [36,37,38,39] |
| 缺损范围/程度 | 负荷-静息改善程度 | 2%~10% | 总是 | 频繁 | [36,37,38,39] |
| 17节段模型 | 总积分差值(SDS) | 2 | 总是 | 频繁 | [26] |
注:阈值的范围根据采用的不同方案或软件而定。表中所列出的定量参数测定的潜力取决于所使用的特定软件,还包括与算法年份相关的版本号。SD为标准差
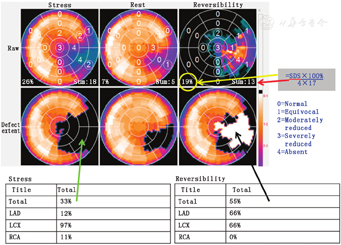

2.可逆性心肌缺血/缺血负荷。(1)可逆性。可逆性分布是指与负荷高峰状态下的心肌灌注相比,静息状态心肌灌注改善的程度和范围。通常是将静息分布中的同一部位归一化到负荷分布中最正常的部位,以生成可逆性靶心图。归一化后,从归一化静息分布中减去归一化负荷分布(表示为0~100%),即为静息灌注改善的部位或可逆性靶心图。然后将心肌可逆性分布与正常限值进行比较,以确定差异是否具有统计学意义(图5)[21]。在正常心肌灌注中,由于没有相对变化,平均正常可逆性值应该为零,该方法已在多中心试验中得到验证[22]。虽然MPI研究中获得的可逆性程度是负荷和静息状态下心肌血流的相对变化情况,但临床上通常将其看作心肌缺血的程度。心肌缺血的直接显像可以通过游离脂肪酸类似物和葡萄糖类似物等放射性药物显像来实现[23]。

可逆性量化的另1种方法是使用总积分差值(summed difference score, SDS)(图4)。SDS定义为SSS减去SRS。为了进行风险分层,对SDS按照低危(0~2)、中危(3~7)或高危(>7)进行了分级[24]。
(2)缺血负荷。比较现代的评估LV心肌缺血程度的方法是缺血负荷,该参数的量化来源于采用17节段模型得出的SDS(图4),将SDS除以最大可能的SDS(4×17节段分数=68)并乘以100%,使SDS转换为心肌缺血负荷占LV整体面积的百分比(%LV)。图4说明了SDS为13如何转换为19%LV缺血负荷。一些有影响力的研究表明,以10% LV缺血负荷为阈值,可以区分出接受血运重建术可降低心脏死亡风险的患者(≥10%)和更加适合单独药物治疗的患者(<10%)[25,26],因此这一评分得到普及。上述结果表明,只有当LV心肌缺血达到一定程度,才能通过行血运重建术等侵入性手术方式来降低患者心脏死亡的风险。
一些临床医师将负荷灌注减低量(%LV)作为心肌缺血负荷的一个指标,其通过将SSS除以68再乘以100%获得(将SSS转换为%LV)。用SSS替代SDS的前提是:假定负荷状态下心肌放射性计数的减少完全由心肌缺血所致,只有当已知患者既往未发生心肌梗死,且在使用SPECT时通过AC或结合仰卧位和俯卧位图像解释了所有潜在的衰减伪影时,该假设才成立。
3.梗死面积/存活心肌。(1)梗死面积。用SPECT MPI对梗死心肌面积进行定量的基本原理是:存活心肌节段在静息状态时显示对心肌灌注显像剂的摄取,而非存活心肌节段则没有该表现。这种算法寻找整个LV心肌放射性分布的最大计数(%),将低于该计数(%)的心肌节段判定为非存活心肌。使用201Tl时该百分比通常为45%~50%[27],而使用99Tcm灌注显像剂时该百分比为60%[28]。这种测法已经被许多其他测量梗死面积的方法所验证[29]。此外,可以用正常数据库来评价静息心肌灌注的减低程度和范围,该方法与增强MRI延迟扫描定义的梗死心肌面积具有良好的相关性[30]。
(2)存活心肌。SPECT MPI测量梗死心肌面积已被临床广泛应用,尤其是在临床试验中。然而,人们普遍认为SPECT MPI低估了心肌的存活性,尤其对于LV功能严重障碍患者[31]。葡萄糖负荷18F-FDG PET显像,特别是结合静息灌注显像,仍然是测量心肌活性的"金标准"[32,33]。
通过静息MPI和葡萄糖负荷18F-FDG联合方法来检测存活心肌,需要在比较2种显像之前将1种放射性分布对另1种进行归一化。此归一化要先对静息MPI的分布与适当的正常数据库进行比较。利用正常数据库来识别心肌灌注减低区,其余正常区域则用于归一化。对灌注显像和18F-FDG显像均计算正常灌注区的整体平均放射性计数,然后对18F-FDG的分布进行标定,使其在正常区域的平均值与灌注显像中的平均值相等。归一化后,从归一化代谢分布(18F-FDG)中减去归一化的心肌灌注分布,所得差异用占归一化代谢分布的百分比表示。这个百分差异的阈值可以设置为任何水平[34],通常为5%~10%。分布高于阈值且心肌灌注异常的区域,即心肌代谢相对增加而心肌灌注相对减少的区域,被称为不匹配区域。任何高于阈值且心肌灌注异常的区域均可视为不匹配区域,该区域与冬眠心肌相一致,被认为是存活区域。如果某心肌节段在统计学上灌注减低,在18F-FDG分布中未超过预期改善阈值,则认为该部位是匹配的,无存活心肌。存活心肌和非存活心肌的范围均用%LV来量化。若计算心肌质量,则可以用心肌组织的克数来表示。尽管存活心肌的存在意味着通过血运重建术改善心功能的可能性更高[32,33],但目前对于用心肌存活的范围来预测改善的定量阈值缺乏共识,各研究的阈值范围在7%到20%间[35],这个概念与上文解释的%LV心肌缺血负荷概念非常接近,但其通常适用于更晚期的心脏病患者,如心力衰竭。
4.LV整体功能。(1)整体功能的测定。强烈建议在行SPECT和PET显像时进行心电门控采集,以评估除心肌灌注变量之外的多个心室功能参数。基于计算机自动化测定的整体功能定量指标包括LV射血分数(LV ejection fraction, LVEF)、舒张末期容积(end-diastolic volume,EDV)、收缩末期容积(end-systolic volume, ESV)、一过性缺血扩张(transient ischemic dilation, TID)、心肌质量、负荷和静息时的舒张功能。
可以使用多种算法对门控SPECT MPI获得的心室功能和容积进行定量分析,最常用的算法基于在整个心动周期中采用三维方法针对心内膜和心外膜表面的点进行自动检测,也可以考虑整个心动周期中质量恒定的原则,以提高对心肌轮廓检测的稳定性(图6)[36,37,38,39]。一些用SPECT MPI测定LVEF的独立研究表明,门控MPI与其他测量LVEF的标准方法间具有良好到非常好的一致性,尤其是当对LVEF从高到低进行连续性统计时[40,41,42,43]。尽管不同的定量算法测得的LVEF高度相关,但LVEF异常的阈值仍存在一定的差异[43]。对于某些方法,门控SPECT MPI图像所测整体LVEF的正常阈值可能低于其他成像方式或不同算法测量的阈值。将每个心动周期分为8帧是导致门控法LVEF明显较低的原因之一,除非该法使用傅里叶时间滤波法重建图像[44]。近年来,16帧门控在SPECT MPI中更为常见,该方法减少了对LVEF的低估。不同性别患者的LVEF和LV容积的正常限值存在差异,这可能是因为相对于SPECT的图像分辨率,LV绝对大小之间存在差异,导致心脏较小患者的ESV被低估[45],尤其是当ESV小于15 ml时。表2列出了已明确的LV功能定量参数及其异常阈值标准。
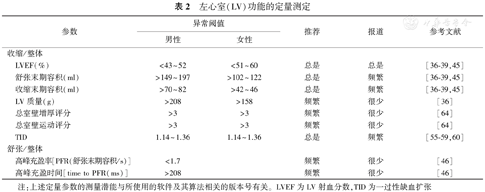
左心室(LV)功能的定量测定
左心室(LV)功能的定量测定
| 参数 | 异常阈值 | 推荐 | 报道 | 参考文献 | ||
|---|---|---|---|---|---|---|
| 男性 | 女性 | |||||
| 收缩/整体 | ||||||
| LVEF(%) | <43~52 | <51~60 | 总是 | 总是 | [36,37,38,39,45] | |
| 舒张末期容积(ml) | >149~197 | >102~122 | 总是 | 频繁 | [36,37,38,39,45] | |
| 收缩末期容积(ml) | >70~82 | >42~46 | 总是 | 频繁 | [36,37,38,39,45] | |
| LV质量(g) | >208 | >158 | 频繁 | 很少 | [36] | |
| 总室壁增厚评分 | >3 | >3 | 频繁 | 很少 | [64] | |
| 总室壁运动评分 | >3 | >3 | 频繁 | 很少 | [64] | |
| TID | 1.14~1.36 | 1.14~1.36 | 总是 | 频繁 | [55,56,57,58,59,60] | |
| 舒张/整体 | ||||||
| 高峰充盈率[PFR(舒张末期容积/s)] | <1.7 | 频繁 | 很少 | [46] | ||
| 高峰充盈时间[time to PFR(ms)] | >208 | 频繁 | 很少 | [46] | ||
注:上述定量参数的测量潜能与所使用的软件及其算法相关的版本号有关。LVEF为LV射血分数,TID为一过性缺血扩张

(2)舒张功能。另1组可通过MPI获得的代表整体心室功能的参数是舒张功能指标,特别是高峰充盈率(peak filling rate, PFR),即舒张早期最大充盈率。传统上通过超声心动图和门控心血池显像来评估舒张功能。PFR对应门控帧式放射性曲线舒张期的峰值[46],可以归一化为EDV,为临床提供直观的指标。此外,还可获得以毫秒为单位的高峰充盈时间。LV舒张功能异常可能是CAD、充血性心力衰竭和其他心脏病的早期征兆。门控SPECT MPI评估舒张功能的可行性已经得到证实[47]。使用16帧门控时,PFR和高峰充盈时间的正常限值与门控心血池显像的结果相似。使用32帧门控时,SPECT和MRI在PFR和高峰充盈时间上具有一致性[48]。整体高峰充盈时间的灵敏度低于局部参数[49]。整体舒张功能的评估尚未得到广泛应用,MPI评估舒张功能的临床价值需要进一步研究。
(3)非灌注参数。除灌注缺损情况外,SPECT MPI还能观察到非心肌灌注的特征,如LV质量[50]、形状[51]和TID[52]等。由于LV轮廓经门控和非门控采集获得,可以通过计算心外膜和心内膜表面之间的体积来估计心肌质量[53]。心内膜和心外膜表面的确定,需要通过计算机算法生成三维表面,如心肌边界的测定。根据负荷后MPI测定LV质量的观察者间重复性很高[54]。SPECT MPI测定的LV质量与CT的测定值相关,但是一致性界限较宽,存在较低值被高估和较高值被低估的现象[54]。
(4) TID。定量TID作为MPI提供的1项心脏高危情况的指标,已经引起临床的广泛关注。该指标即负荷状态下与静息状态下的LV心腔容积比值,通常根据非门控静息和负荷图像计算得出。然而,其也可以通过门控SPECT获得的舒张末期图像计算得到[55]。当负荷后图像显示LV心腔容积大于静息图像心腔容积时,则认为存在TID[52]。这种现象代表明显的心腔扩张或心内膜下缺血,这解释了为什么在负荷后数小时内可以看到TID,而功能的异常可能不再存在(图7)。药物诱导的TID与运动所引起的TID具有相似的预后意义[56]。定量TID评估与灌注评估相结合可以提高严重CAD的检出率[55]。TID异常的阈值取决于显像设备种类、负荷种类和使用的显像方案[57]。1项针对8种不同方案(包括基于运动和血管扩张剂)、由5个影像中心开展的大型跨国注册多中心研究(REFINE-SPECT)纳入了1 672例CAD可能性低且显像结果正常的患者[58]。研究结果表明,在目前使用的各种临床方案中,TID异常阈值从1.18到1.52不等[58,59]。82Rb方案的负荷灌注图像是在更接近负荷高峰的情况下采集的,其正常TID往往较低,这是由于负荷状态下LV容积减小所致。82Rb PET MPI研究中,TID的上限为1.15[60],低于SPECT。上述现象表明,将定量TID用于临床时,应注意将TID定量阈值与相应的MPI方案相结合。


(5)钙化积分。SPECT/CT能通过AC更加全面地评估CAD。非增强CT图像可用于SPECT的AC,当进行心电门控采集时,可评估冠状动脉钙化积分[61,62]。这2种方法都可提高诊断性能[62]。冠状动脉钙化是CAD的特征,对于SPECT MPI正常、未诊断CAD的患者,钙化积分可以重新划分风险等级、改进诊断。此外,冠状动脉无钙化(积分值为0)与未来心血管事件发生的低概率具有相关性[62]。该参数的应用可以显著降低CAD的验后概率,并增加医师排除阻塞性疾病的诊断信心。检测钙化积分的实验室经常报告这个参数。
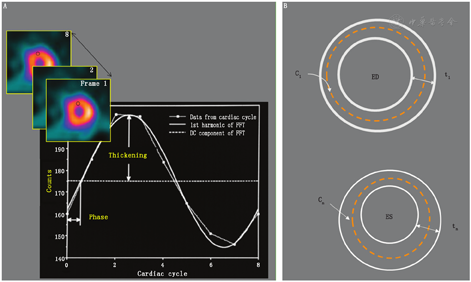
5.LV局部心功能。(1)心肌增厚率。由于显像设备与心肌厚度相比空间分辨率有限,心肌增厚率的测定基于以下观察结果:心肌节段最大计数的线性变化是对心肌厚度变化的直接响应[63]。因此,相对增厚率是以整个心动周期内每个心肌节段最大计数的百分比来衡量的。尽管在门控MPI研究中常规使用每个心动周期8~16帧,应用傅里叶变换仍可提高增厚率的时间分辨率[44]。可认为该数学步骤是将8帧中的每帧中来自相同心肌部位的离散计数拟合到正弦波,然后将节段增厚率更好地近似为正弦波的振幅,该振幅与这些部位的计数相匹配。定量程序显示局部(相对)增厚率的靶心图,通常将其与正常区域增厚率的数据库进行比较。LV心尖部平均增厚率40%以上,其余部位增厚率超过25%,被认为是正常的。
(2)心肌室壁运动。为了测量心肌心内膜运动,需要测定三维LV心内膜,心内膜边界的确定可用边缘检测技术、心肌厚度的假设、心肌体模的校准或这些技术方法的组合来完成。
边缘检测技术在MPI研究中的应用受到核素显像系统低空间分辨率的限制。利用已知厚度的心肌体模进行校准,可以提高该方法的准确性。其他的方法则需要测定绝对心肌的厚度。增厚率法测量的是相对增厚,而不是绝对厚度。有种方法是使用心肌最大计数的位置(散射校正)来确定心肌壁节段的中点[37,44]。假设舒张末期LV心肌厚度为1 cm,即中点两侧5 mm,这就定义了三维心内膜和心外膜的表面。然后利用从舒张末期开始的局部计数变化来确定心内膜/心外膜表面位置的变化,例如,如果在收缩末期结束时某段心肌计数增加1倍,其厚度也将增加1倍,从1 cm增加到2 cm。
(3)心肌的室壁运动与增厚率。利用心肌室壁增厚率来代表局部心功能已经获得较好的临床应用。其基本原理是心肌必须增厚,以便心内膜完成有意义的室壁运动。心内膜可能在没有相应增厚的情况下移动,但这是增厚区域牵拉或者心脏扭动所致。这2种现象都不影响心脏每博量。全自动的SPECT MPI LV局部室壁运动和增厚率的评分在检测CAD方面优于有经验的观察者[64]。
6.已明确应用方法的诊断性能。(1)诊断性能。已将SPECT和PET MPI相对定量的诊断准确性与侵入性血管造影进行大量的对比。在世界范围内MPI主要采用SPECT进行(>90%)。1项纳入995例患者的大型临床研究将自动定量SPECT分析与视觉分析进行比较[65]。以血管造影示至少70%的冠状动脉狭窄为标准,经AC或non-AC的SPECT MPI数据的全自动计算机分析对每例患者而言是等效的,并且可能优于每支血管的分析[66]。先进的全自动相对定量方法针对SPECT MPI进行了优化和验证。相同的软件也可以用于PET的相对灌注定量。对于PET而言,定量MPI的小型研究也显示出较高的诊断准确性[67]。
(2)自动化。与视觉分析相比,基于计算机的心肌灌注相对定量的主要优势在于客观性和可重复性。即便是临床专家,审阅风格也可能不同,这会导致主观结果的差异性。2位专家观察者之间的诊断一致性是有限的,节段总评分的误差幅度很大[68]。软件分析的可重复性则好很多。1项比较单次注射后重复扫描所获参数的视觉评价和定量分析的可重复性的研究显示,心肌灌注缺损定量分析的变化度约是同一研究者对心肌节段的评分(相同的观察者3周内重复阅片)变化度的一半[69]。当对同一患者所有图像(包括负荷、静息、门控、非门控)进行处理时,自动化处理的不断改进可以减少技术人员的手动处理,从而进一步提高定量结果的可重复性。
据文献报道,心肌灌注定量自动分析的重复性系数已降低到2.6%,灌注图像分析的失败率已降低到1%以下[70]。自动化标记LV心肌节段性灌注减低的技术已经被开发[71]。近期的大型预后研究表明,上述方法可以在很少需要操作者手动的情况下自动处理MPI图像[72]。
(3) AC与双体位显像。自动定量分析可以在有或无AC的情况下进行[73]。对大多数MPI AC研究的分析表明,与non-AC研究相比,AC可以显著提高对CAD的诊断特异性[74]。然而,部分研究显示AC图像心肌灌注定量分析在诊断准确性方面仅取得了中度的改善(~3%)[75]。与non-AC数据相比,采用AC心肌灌注定量可以不使用特定性别的数据库[76]。若衰减图像无法用于校正,则可以使用对同一患者多体位(仰卧、俯卧、直立)获取的断层图像来综合评估图像计数的放射性减低是否与衰减伪影有关,因为患者位置的移动会导致衰减伪影[77]。定量技术已经被开发用于同时从2种显像体位来评估心肌灌注缺损的大小——用传统显像设备分别采集仰卧位和俯卧位图像[78,79]以及在心脏专用机上分别采集直立位和仰卧位的图像[80]。与AC分析类似,这些定量技术可以通过减少衰减伪影来改善对阻塞性疾病的诊断。
(4)定量风险预测。自动化分析的整体准确性和精准度对于准确诊断至关重要。定量分析有直接用于预后风险评估的潜力[66,72,81]。最终预测对治疗后获益情况可以通过定量分析而不是视觉评估心肌缺血来实现。然而,迄今为止,关于指导治疗的心肌缺血范围阈值的验证研究并没有使用定量确定的心肌缺血负荷(%LV),而是依赖于将SDS的主观视觉评分转化为心肌缺血负荷(%LV)[26]。
核心脏病学技术中的定量分析软件工具使得对心肌灌注、心功能、心肌代谢、心脏神经支配和炎性反应的评估实现客观化和标准化,这是该技术的主要优势。上述已明确的工具已常规用于行核心脏病学检查的大多数心脏病患者,用来提高临床医师的诊断准确性,并协助研究、解释、临床管理和指导治疗。



























