
定量分析已广泛用于核心脏病学图像的处理和解读、改进疾病诊断和危险分层。该文为继续教育文章(含2部分)的第2部分,将对新兴的定量分析工具的临床潜在应用进行综述,介绍机械运动同步性、心室功能、灌注和融合显像定量分析技术,对PET和SPECT评估心肌血流量的新方法进行讨论。心肌活性、微钙化定量检测及心脏结节病和心脏淀粉样变的定量评估亦在文中描述。人工智能在改善图像分析、提高疾病诊断效能和风险预测方面的潜在作用将在文末进行论述。上述新技术的临床潜在应用及优化实施方法将在文中重点阐述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
核心脏病学,包括SPECT和PET,已成为心血管疾病确诊或疑诊患者的重要无创影像方法。定量分析已广泛用于核心脏病学图像的处理和解读。本文将展示反映定量核心脏病学现状的更新内容,是一篇继续教育文章(含2部分)的第2部分。该继续教育文章第1部分讨论了临床已经确立的量化工具,以及如何将其完美地融入临床实践[1,2];第2部分将论述新出现的或发展中的定量方法的临床潜在应用,由于其临床价值尚未明确,因此将其与第1部分的技术分开阐述。本文将综述心室灌注和功能量化的新方法,包括心肌灌注显像(myocardial perfusion imaging, MPI)、相位分析、右心室分析、运动校正和融合显像分析。本文还将讨论绝对心肌血流量(myocardial blood flow, MBF)的测量方法,包括快速发展的SPECT MBF定量的研究证据。定量微钙化的影像学新方法也将在文中论述。本文不仅关注冠状动脉(简称冠脉)粥样硬化性心脏病(coronary artery disease, CAD)的最新进展,还将讨论心脏结节病(cardiac sarcoidosis, CS)和心脏淀粉样变(cardiac amyloidosis, CA)患者的定量分析。最后,本文将讨论人工智能(artificial intelligence, AI)在改进图像分析、提高疾病诊断效能和风险预测方面的潜在作用。所有这些新技术的临床潜在应用及优化实现方法将在文中重点阐述。
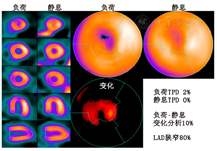
1.心室灌注变化的定量检测。局部心肌灌注的定量分析已成为评估灌注的可靠方法,可作为视觉分析的补充。灌注定量评估与专家视觉分析的诊断准确性相似,但其观察者间的变异性较低[3]。即使心肌灌注视觉评估正常,心肌灌注定量仍可为患者更精确的危险分层提供依据[4]。心肌灌注的自动定量检测主要通过与正常值数据库进行比较(详见第1部分内容);也可以通过比较来自同一患者的负荷和静息显像图来识别心室灌注的细微变化,称为"变化分析"。例如,一项研究对比分析了204例接受双核素SPECT MPI患者的静息-负荷图像[5],结果表明,左心室负荷总灌注缺损程度(total perfusion defect, TPD)与静息总计数的量化比值(即缺血)与正常值数据库进行量化相比,可以更准确地诊断冠脉狭窄(ROC AUC分别为0.88和0.82)[5]。心肌缺血的量化可识别未来发生主要不良心血管事件(major adverse cardiovascular event, MACE)风险较高但能从早期血运重建中获益的患者[6],"变化分析"可更准确地评估缺血负荷。患者示例见图1。

运动校正相对心肌灌注和MBF定量的综述,请参见补充资料。
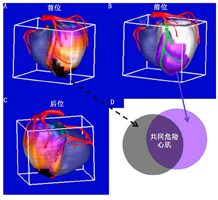
2.影像技术融合:SPECT/CT融合分析。因确诊或疑诊CAD而接受冠脉CT血管造影(coronary computed tomography angiography, CCTA)的患者数量持续增加。通过特定技术将CCTA获得的信息与SPECT或PET MPI相结合,可以提高诊断准确性。例如,可以通过CCTA提取三维冠脉血管,并将其融合到定量SPECT MPI的左心室表面[7];融合配准后的图像可以用于校正MPI的轮廓和调整血管支配区域,成功率达96%[7],与不经配准和调整的方法相比,融合配准提高了严重CAD的检出率。Yoneyama等[8]证明,使用不同软件系统生成的融合图像诊断右冠脉狭窄的准确性也有相似的改进。
SPECT MPI/CCTA融合图像的相对定量也已开发出来(如图2所示),在解剖学上通过CCTA评估冠脉狭窄程度,同时在生理上通过MPI评估心肌灌注缺损来评估危险心肌[9]。Piccinelli等[9]证明,与CCTA或MPI单独评估相比,解剖和生理上同时受累的危险心肌的定量分析对阻塞性CAD具有更高的诊断准确性。CCTA还可以与动态PET灌注图像融合,以使MBF和心肌血流储备(myocardial flow reserve, MFR)量化更符合特定患者的血管分布[10]。因融合显像可像冠脉造影一样帮助制定血运重建的治疗决策,因此融合显像数据可能更适用于CCTA或MPI结果不明确的患者[11]。

1.PET血流量。PET用于人体MBF绝对定量的无创评估已得到公认。PET扫描仪的改进和专用临床软件的使用使得动态PET和MBF评估能够从科研工具发展到更广泛的常规临床应用[12]。MBF绝对量化的价值在于其能恢复真实的潜在的灌注缺损对比度(图2)[12]。MBF评估的临床重要性在于其评估整个冠脉系统的能力,包括微血管、心外膜血管弥漫性和局灶性病变对冠脉血流的影响[12,13]。以静息和充血峰值时局部MBF来计算绝对MFR(负荷MBF除以静息MBF)。同样地,相对MFR(也称为RFR)为特定灌注缺损区内的充血MBF除以远端正常灌注心肌的充血MBF。和有创血流储备分数一样,RFR是一种与特定冠脉分布相关的区域性测量,其值为0.0~1.0之间。然而,RFR可能与血流储备分数不一致,因为RFR受弥漫性动脉粥样硬化或微血管疾病的影响[12]。
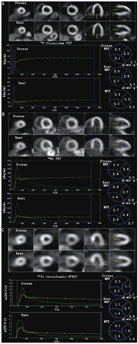
PET获得的每个定量指标(MBF、MFR、RFR)与相对血流灌注一样提供有关冠脉生理学的补充信息[12,13]。整体MFR可测量弥漫性动脉粥样硬化和微血管功能障碍,为微血管性心绞痛提供无创诊断依据[14]。PET血流量参数最好互相结合应用[12,13]。例如,示踪剂的摄取提供了灌注缺损的相对程度和范围,而负荷MBF和MFR可视为"冠脉血流能力",它整合了额外的关于血流受阻生理学严重程度的补充信息[13]。根据当前的共识指南[12]:(1)如果整体充血状态的MBF(>2 ml·min-1·g-1)和整体MFR(>2)正常,可以可靠地排除高风险血管造影证实的CAD;(2)如果整体MFR重度降低(<1.5),应被视为PET MPI的高风险特征,提示多支血管阻塞性病变的可能性增加,可能需要血管造影评估;(3)对于PET MPI正常且单个血管区域内局部充血MBF(<1.5 ml·min-1·g-1)和(或)MFR(<1.5)严重降低的患者,应考虑单支血管狭窄引起了缺血。图3提供了PET MBF定量分析的范例。

临床动态PET面临一些影响血流测量准确性和可靠性的技术挑战,包括示踪剂的选择、输液系统、PET扫描仪计数率性能、图像重建、后滤波技术、运动校正、合适的时间取样和示踪动力学模型[12,15]。上述的部分难题正在通过技术的不断发展加以解决。PET动态显像,包括血池相患者运动的自动校正技术已经有所介绍[16,17,18,19]。82Rb PET因发生器制备生产便捷成为最常用的血流量示踪剂,通过使用恒定活度比率输注方案代替常用的恒定流量方案,82Rb PET MBF检测的重复性得到了改善[20]。随着超导微型回旋加速器支持下的新型按需给药模式的应用,经美国食品与药品监督管理局(Food and Drug Administration, FDA)批准的具有更好心肌血流特性的示踪剂13N-NH3·H2O的临床可及性正在增加[21]。目前正在临床开发研究阶段的灌注示踪剂2-叔丁基-4-氯-5-[4-(2-氟-18F-乙氧基甲基)苯基甲氧基]-3(2H)-哒嗪酮(18F-flurpiridaz)也具有良好的MBF测量特性[22]。最近一项来自18F-flurpiridaz的首次临床Ⅲ期多中心试验的亚组分析证实了上述优势,并表明了MBF和MFR相对于冠脉造影定量评估的额外诊断价值[22]。尽管自由扩散示踪剂15O-H2O具有理想的血流特性,并且在心肌图像生成方面取得了重大进展,但其应用目前仍局限于专业研究领域[23]。临床动态PET实施中的技术改进,甚至可能实现应用与82Rb评估MBF动力学相同的模型同时评估心肌活性[24]。随着这些技术的进步,提高MBF方法的标准化程度仍然是帮助完善异常血流量阈值和提高结论可靠性的一个重要目标。
2.SPECT血流量。自20世纪90年代就已经开始利用传统的Anger相机,通过动态SPECT对MBF和MFR进行绝对定量研究。然而,最近推出的固态、以心脏为中心的碲镉锌(cadmium zinc telluride, CZT)SPECT,具有显著改进的空间、时间和能量分辨率及探测器灵敏度和计数率性能[25],激发了人们对临床SPECT测量MBF更广泛的兴趣。这种相机的动态成像能力能够使用房室模型[26,27,28]和简化的提取模型[29,30]对绝对MBF进行量化。图3C为SPECT MBF定量示例。
常用的SPECT灌注示踪剂具有的已知的局限性催生了一种类似于82Rb PET方法的出现,该方法使用一种经验性Renkin-Crone提取模型校准至独立的PET MBF的测量,以校正流量依赖性示踪剂的提取[28]。虽然上述方法在82Rb PET已得到良好验证[12,13],但其在SPECT中的应用面临着一些独特的挑战。首先,99Tcm标记的示踪剂在充血性状态下的心肌提取显著低于PET显像剂[28], Renkin-Crone校正导致相应MBF的差异更大[15]。201Th具备更优良的提取性能,但也有其他的局限性,如与血液成分相结合的比例过高[28]。虽然可以通过基于人群的血液结合校正或适当校准Renkin-Crone模型进行补偿[28],但这些校正也可能增加MBF的变异性。其次,虽然近期研究表明MFR阈值为2时,左心室心肌整体MFR和患者诊断不受衰减校正(attenuation correction, AC)的影响[31],但CZT SPECT相机因普遍缺乏AC,会降低局部MBF的准确性和精确度[28,29,30]。影响SPECT MFR准确性的另一个因素是适当校正动态显像前定位扫描或一日法显像方案中前次显像后残余示踪剂的活性[32]。最后,MBF变异性的增加导致MFR变异性的增加,而不会在MFR比率中抵消。短期重复性研究对于确立临床SPECT MFR的可重复性是必要的。在迄今为止报告的唯一一项研究中[33],SPECT MBF和MFR重复测试的精确度和操作者间的变异性比PET更差,这可能源于99Tcm标记的灌注示踪剂的固有提取率低。虽然存在上述挑战,但是与"金标准"PET相比,单中心小样本人体研究结果显示,SPECT MFR具有应用前景[26,27,28,29,30],而且正在进行的前瞻性临床试验旨在更好地确定SPECT MFR的准确性、可重复性(https://clinicaltrials.gov/ct2/show/NCT02280941)及诊断和预后效能(https://clinical-trials.gov/ct2/show/NCT03637725, https://clinicaltrials.gov/ct2/show/NCT02697760)。
1.相位分析测量左心室收缩不同步。许多心力衰竭(简称心衰)患者伴有左心室收缩不同步。心脏再同步化治疗(cardiac resynchronization therapy, CRT)可改善左心室功能和临床预后。心肌病患者的心肌受累范围、瘢痕负荷及QRS间期是机械不同步的3个决定性因素。但是,机械不同步和每个因素的相关性都不高(r分别为-0.49、0.50~0.65和0.25~0.50)[34],提示机械不同步可能具有额外的临床意义。因此,左心室收缩不同步的定量分析对预测哪些患者受益于再同步化治疗具有潜在的重要作用。门控心肌显像将左心室不同步量化为左心室心肌机械收缩(onset of mechanical contraction, OMC)开始区域的时间延迟[35]。相位直方图、相位标准差(standard deviation, SD)、直方图带宽和相位熵是左心室不同步最重要的定量指标。
相位SD测量左心室机械收缩开始时间的偏差程度,因此,SD越大,左心室越不同步。正常患者的SD范围为5.1°~31.4°,男性的平均值为14.2°,女性的平均值为11.8°。相位直方图带宽是包含95%相位分布的相位范围(收缩开始),带宽越大,左心室越不同步。相位熵是一种"无序"的度量,显示范围在0~1(0%~100%);左心室无序程度越高,不同步程度越高[36]。左心室不同步的定量是完全自动化处理获得的,但如果处理结果不符合相关规范,则应对处理过程进行质量控制和更正[37]。该技术已被证明具有约99%的观察者间和观察者内再现性和可重复性[38,39]。左心室不同步参数也与组织多普勒成像参数具有良好的相关性[40]。与其他应用一样,测量不同步的具体算法各不相同,操作者应注意测量值和临床阈值的潜在差异。
舒张期不同步的评估见补充资料。
2.相位分析用于CRT应答和指导。关于测量左心室机械不同步来预测伴左束支传导阻滞(left bundle branch block, LBBB)心衰患者CRT应答的研究已广泛开展。在一项含42例患者的回顾性研究中,相位SD的界值为43°时,CRT应答的灵敏度为74%,特异性为81%[41]。CRT后,不同步参数即可发生变化,并可预测远期左心室反向重构[42]。同样地,CRT 6个月后左心室不同步改善与否(但不是基线相位SD)与临床预后相关[43]。图4示3例患者的相位分析结果及如何用于评估患者是否适于CRT。伴LBBB、左心室射血分数(left ventricular ejection fraction, LVEF)<35%、QRS增宽(>130 ms)、左心室不同步(相位SD>43°)的心衰患者有望获益于再同步化治疗。

已经有软件开发用于将OMC激动及存活心肌显像相融合来识别心肌最晚激动的存活部位,有助于优化左心室起搏电极导线的定位[44]。充满前景的回顾性研究结果促使努力将该方法自动化,以用于指导CRT左心室起搏电极导线的定位。前瞻性、多中心、国际临床试验VISION-CRT连续纳入了195例患者[43],该试验旨在确定将左心室CRT导线放置在自动相位分析(靶向)定位的节段与其他节段之间的结果差异[43]。结果表明,基线不同步性及靶向节段放置导线均对CRT应答无预测作用;然而,基线到CRT后6个月,相位SD的改善与CRT应答有关。该研究表明,准确预测CRT的应答是一个复杂的过程,在临床常规应用之前仍需改进软件和方法。
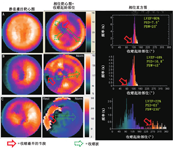
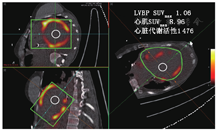
CS和CA属于一类广泛的限制性心肌病,由心肌僵硬度增加引起[45]。舒张功能受损和心衰症状可能影响单个或双心室,常见心律失常和传导异常[45]。CS以心肌局灶性炎性反应和纤维化为特征[45]。目前尚无诊断"金标准",包括心脏MR、放射性核素显像在内的多种显像方法通常是必要的,可排除严重CAD的存在并识别结节病的活动性[46]。FDG PET联合MPI评估在检测心肌炎性反应中发挥重要作用;但患者显像前精细准备以抑制心肌生理性FDG摄取对诊断准确性至关重要[46]。近期一项荟萃分析表明,根据日本卫生、劳动和福利省标准,FDG PET检测伴系统性结节病的CS患者具有良好的灵敏度(89%)和特异性(78%)[47]。虽然标准化FDG PET图像的视觉评估已广泛应用,但有证据表明,各种基于SUV的定量指标可能更可靠,尤其是基于系列FDG PET显像评估治疗反应[46]。图5示1例可疑CS患者FDG PET定量评估的结果。除FDG PET定量分析外,初步研究显示灌注定量也有一定作用。近期研究表明,灌注定量评估诊断CS的准确性高于视觉评估[48]。一项类似的正在进行的随机多中心临床试验旨在通过对灌注图像的静息总评分进行半定量评估,将其作为心肌纤维化的一项衡量指标,确定临床活动性CS患者的最佳治疗策略[49]。同样,回顾性研究表明,FDG PET定量分析可能有助于预后判断[50],系列PET定量评估可用于指导免疫抑制治疗[51]。最近一项更大规模的研究中,灌注代谢不匹配和FDG代谢异质性的定量测量结果显示可增加预后价值[52]。上述方法的临床实用性需要进一步的多中心研究来验证,以便为CS患者提供预后信息或指导治疗决策。

CA的特征是心肌细胞外错误折叠蛋白的沉积,即淀粉样蛋白,其中最常见的是免疫球蛋白轻链相关蛋白(light chain-associated, AL)和转甲状腺素相关蛋白(transthyretin-related, ATTR),每种蛋白对应于不同的预后和治疗选择[45]。亲骨示踪剂平面显像视觉评估或计算心脏与对侧(heart-to-contralateral, H/CL)比值均可对ATTR-CA进行可靠诊断,如99Tcm-焦膦酸盐(pyrophosphate, PYP)、99Tcm- 3,3-双膦酸-1,2-丙二甲酸(3,3-diphosphono-1,2-propanedicarboxylic acid, DPD)和99Tcm-羟基二膦酸盐(hydroxydiphosphonate, HDP)[53]。在最近的2项多中心试验中,平面放射性核素显像诊断可疑ATTR-CA患者的灵敏度为91%~99%,特异性为86%~92%[54,55], H/CL比值≥1.6可预测全因死亡率[54]。此外,经SPECT量化的99Tcm-PYP在ATTR-CA患者中的局部分布显示其与死亡风险增加相关[56]。但是,亲骨SPECT显像剂的结合不是CA特异性的,无法可靠地检测AL-CA,尤其是区分AL与ATTR。因此,人们对开发PET显像剂越来越感兴趣,这种显像剂可能对CA的检测更加灵敏,特别是能区分AL和ATTR,并且能够量化疾病负荷和治疗反应[57]。目前还要进一步研究阐明这些PET显像剂在CA诊断、预后和治疗监测中的临床应用。
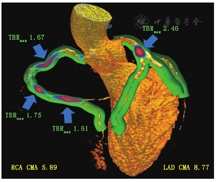
FDA批准的18F-NaF最初用于骨恶性病变显像,其也可在动脉粥样硬化的钙化过程中被摄取,提供有关动脉粥样硬化形成和进展的信息。Dweck等[58]证明冠脉粥样硬化患者的18F-NaF活性更高,与冠脉钙化积分相关。近期,新的冠脉18F-NaF活性定量技术不断发展。冠脉18F-NaF PET定量可用于分开采集的PET和CCTA,有助于对CCTA可疑狭窄病变进行风险评估[59]。心脏、呼吸和运动校正的使用是实现良好再现性和高信噪比的关键[60,61]。定量冠脉血管整体18F-NaF负荷是可行的,即冠脉微钙化活性(coronary microcalcification activity, CMA),其可以提供类似于CT冠脉钙化积分的冠脉粥样硬化的整体测量方法。在一项293例患者队列研究中,与CT冠脉钙化积分和CAD程度相比,CMA显示出更高的预后判断准确性[62]。多支病变CAD患者整体血管定量评估18F-NaF活性见图6。冠脉18F-NaF定量可能会成为改善CAD患者高危斑块风险预测和识别的一项重要检测方法。

AI泛指设计用于执行通常需要人类智能任务的计算机系统。虽然有许多不同的AI技术,但大多数技术可分为基于特征分析的"机器学习"(machine learning, ML)或基于图像的深度学习(deep-learning, DL)技术[63]。ML算法使用预定义的特征(但无其他特定规则)建立数学模型,以进行预测。DL算法直接从成像数据进行预测,无需编程检测特定特征。对于所有AI方法,关键是要确保使用大型、多样的数据集进行训练,并在后续的精准性测试阶段确保不再以任何方式使用在模型训练期间已经使用过的数据。
1.心肌节段划分的AI方法。DL已被应用于改进SPECT和PET MPI的图像节段划分,这是所有心肌灌注和功能定量技术的基础。传统的图像处理方法具有较高的图像节段划分精度,只有一小部分情况需要手动校正;但是,二尖瓣层面常出现问题。使用支持向量机的经典ML已经被建议用于改善瓣膜层面定位,从而实现完全自动化[64]。最近,初步的DL方法也被提出用于SPECT MPI左心室心肌节段划分[65]。这些方法是否能优于目前临床使用的经典图像处理技术还有待观察。AI也可用于改善显像中放射性核素剂量低或采集时间短的图像的质量。Shiri等[66]使用卷积神经网络建立了DL算法,提高半采集时间或半数投影数量SPECT MPI的图像质量。与半时间采集图像相比,预测的全时间采集图像改善了图像质量和信噪比[66]。
2.疾病预测和结局的AI方法。AI技术非常适于客观地整合核心脏病学研究中大量的临床参数。Arsanjani等[67]表明,与定量灌注分析相比,使用ML方法提高了MPI诊断阻塞性CAD的准确性(86%与81%;P<0.01)。基于DL技术的靶心图已直接用于阻塞性CAD的预测。在一项包含来自9个中心的1 638例患者的大型SPECT MPI注册研究中[68],无论是局部还是患者水平,DL方法在识别CAD方面均优于灌注定量分析[69]。在随后的包括1 160例患者的分析中,与图像的联合定量分析相比,DL模型诊断阻塞性CAD的诊断准确性得到了提高,其准确性类似于专家临床解读[70]。Spier等[71]开发了一种单独的基于DL的算法,与专家视觉判读的一致性约为90%。这些研究表明,基于AI的技术有可能增强医师的判读能力,从而提高阻塞性CAD的诊断水平。
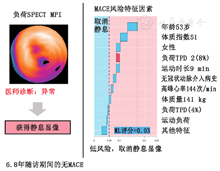
除了疾病诊断,最近的研究表明,基于AI的技术可以改善心脏事件的预测。Betancur等[72]应用基于特征的ML来确定临床和影像SPECT MPI特征相结合的优势。与专家视觉判读、心肌TPD和缺血性TPD相比,采用10倍交叉验证的ML具有更高预测MACE的能力[72]。此外,根据ML评分,在MACE风险最高百分位(第95位)的患者中,近20%的患者被专家视觉判读为灌注"正常"。经典ML预测SPECT MPI后血运重建的准确性与专家相似[73],并且在预测单支血管和单个患者的血运重建优于灌注定量分析[74]。
虽然基于AI的技术在疾病诊断或风险预测方面的改进潜力是显而易见的,但将其应用于临床实践的方法仍需细化。生成自动结构化报告是一个潜在的实现方案。Garcia等[75]表明,AI算法可以生成自动结构化报告,其诊断准确性不亚于专家判读。在20 414例患者中,Hu等[76]证明了基于ML算法识别负荷显像后无需静息显像患者的MACE风险较低。使用自动化、基于AI图像分析方法可以取消60%的静息显像,该组患者的年MACE风险为1.4%;而根据视觉分析判断是否需要取消静息显像患者的年MACE风险为2.1%[76]。最后,患者个体化的风险预测方法对临床实践至关重要。对于一些ML方法,可以展示对特定受试者的风险评分有意义的由ML导出的个体化特征(图7)。

以灌注和不同步性定量分析改善疾病诊断或风险预测的方法将继续细化,并且应被考虑临床实施。这对于患病率较低的疾病尤其重要,如CS和CA。PET MBF测量结果可靠,可用于识别严重CAD,改善预后,为临床常规应用做好准备。在现有技术发展的同时,SPECT MBF等新技术和18F-NaF等显像剂的出现已经显示出潜在的临床应用价值。基于AI的技术有潜力改善疾病诊断和风险预测,为医师解读补充信息。将AI有效地融入临床实践的方法仍需进一步验证和完善。核心脏病学领域将不断发展,我们应不断探索如何将新技术融入临床实践。
Slomka博士获得美国国立卫生研究院和德国Siemens公司的资助,并从美国Cedars-Sinai医疗中心获得软件使用费。Moody博士、Renaud女士和Ficaro博士是INVIA的员工。Renaud女士是美国Jubilant DraxImage公司的顾问,从FlowQuant®软件的销售中收取版税。Miller博士没有相关的声明。Garcia博士获得了美国国立卫生研究院的资助,从美国Synterm公司获得特许权使用费,并拥有该公司的股权。他还是美国GE公司的顾问



























