
甲状腺良性疾病,尤其是甲状腺功能亢进症(简称甲亢)和甲状腺功能减退症(简称甲减),是最常见的内分泌疾病。甲亢常见的病因是自身免疫性甲亢(格雷夫斯病,即GD)、毒性多结节性甲状腺肿(TMNG)、毒性甲状腺腺瘤(TAs);其他少见病因包括破坏性甲状腺炎(胺碘酮导致的甲状腺功能异常)和人为甲亢。GD主要由促甲状腺激素受体抗体(TRAb)引起;TMNG和TAs由体细胞功能激活获得突变引起。甲亢患者典型的实验室表现为促甲状腺激素(TSH)降低,游离三碘甲状腺原氨酸(FT3)和游离甲状腺素(FT4)升高,以及GD患者TSH受体自身抗体升高。超声检查主要用于明确甲状腺大小、血供以及甲状腺结节的位置、大小、数目及影像特征。甲状腺超声和实验室检查是明确甲亢病因的一线诊断方法。甲状腺显像(131I或99TcmO4-甲状腺显像)可用于鉴别不同类型的甲亢,为131I治疗提供策略指导。甲状腺显像可帮助鉴别GD、TMNG、TAs和破坏性甲状腺炎。99TcmO4-可鉴别胺碘酮导致的1型和2型甲亢。测定甲状腺摄碘率(RAIU)有助于明确甲亢131I治疗的放射性活度。治疗甲亢的方案主要包括抗甲状腺药物(ATD)治疗、手术或131I治疗。当患者ATD治疗失败、或有手术治疗禁忌或拒绝手术,可以考虑131I治疗。对于TMNG或TAs患者,131I治疗目的在于恢复正常甲状腺功能。对于GD患者,131I治疗的目的在于诱发甲减,这种状态易通过口服甲状腺激素替代疗法治疗。可根据甲状腺大小和RAIU的计算剂量法指导131I治疗的放射性活度。131I治疗的早期毒性及不良反应(甲状腺床区轻微疼痛)可通过非甾体抗炎药来处理;晚期毒性及不良反应主要是甲减和辐射诱导的恶性肿瘤(发生率极低)。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
甲状腺是人体最大的内分泌腺。血液循环中充足的甲状腺激素对于机体组织和器官功能的正常运行具有重要作用。甲状腺疾病是最常见的内分泌疾病[1]。欧洲1项关于1975至2012年甲状腺功能异常的meta分析显示,临床甲状腺功能减退症(简称甲减)和甲状腺功能亢进症(简称甲亢)的发病率分别为3.05%和0.75%,而未明确诊断的甲减和甲亢发病率更高,分别为4.94%和1.72%,提示近11%的人群存在甲状腺功能异常[2]。相比之下,美国有研究显示,1.2%的人群存在甲状腺功能异常(0.5%临床甲亢和甲减,0.7%亚临床甲亢和甲减[3,4])。美国甲状腺协会提示,超过12%的美国人一生中会出现甲状腺功能异常。特殊人群甲状腺功能异常发生率更高,如老年人[5,6]或肥胖人群[7]。
本文重点讨论核医学在甲状腺良性疾病诊治中的作用,涵盖了甲状腺常见的良性疾病。甲状腺结节为恶性的可能性低于5%,而甲状腺癌占所有恶性肿瘤的比例不到1%。
碘的发现纯属偶然。1792至1815年,欧洲战乱不断,法国是主要参战国之一。法国人由此需要充足的火药,火药主要由硫磺(10%)、木炭(15%)、硝酸钾(75%)混合而成。制作火药耗尽了木材,因此法国人通过燃烧海草获得木炭和硝酸钾。Bernard Courtois和他的父亲负责生产硝酸钾。1811年,Courtois燃烧海草生产硝酸钾时,加入了过多的硫酸,导致生成了紫色云,而紫色云在邻近低温金属物体上凝结成碘晶体。过量的酸可能氧化了凝结的碘晶体,进而形成碘,氧化后的碘升华为紫色的水蒸气。为了明确紫色晶体的性质,Courtois将样本交给法国化学家Joseph-Louis Gay-Lussac和英国化学家Humphry Davy。Gay-Lussac证明这种晶体是1种新元素,并根据希腊语ioeides将其命名为iode,意为紫罗兰色。Davy又将iode改为iodin,即目前常说的碘(iodine)。
瑞士内科医师Jean-Francxois Coindet曾用烧过的海绵和海藻治疗甲状腺肿,他认为海藻活性成分主要为碘。1819年,他发现给予甲状腺肿患者碘酒,1周内可使甲状腺缩小。1820年,他发表了研究结果;1896年,Baumann报告甲状腺内存在大量的碘[8]。
在碘摄入充足的人群(成人150 μg/d)中,80%的甲亢由自身免疫性甲亢[格雷夫斯病(Graves disease, GD)]所致。在碘缺乏人群中,毒性多结节性甲状腺肿(toxic multinodular goiter, TMNG)是甲亢的最常见原因,这是1种非免疫相关的疾病[9];约5%的甲亢由毒性甲状腺腺瘤(toxic thyroid adenomas, TAs)所致。上述疾病多见于女性,男女比例1∶6。其他导致甲亢的病因[如人为甲亢或垂体产生过量的促甲状腺激素(thyroid-stimulating hormone, TSH)]非常少见[10]。垂体产生过量TSH的主要原因包括分泌TSH的垂体腺瘤(占比低于1%的垂体腺瘤)和垂体甲状腺素抵抗[10]。GD和TAs的发病高峰为40岁,TMNG好发于30~60岁。
甲亢的临床症状主要有对称性震颤、怕热、多汗、体质量下降(尽管食欲增加)、多动、精神紧张、注意力不集中、代谢快、心动过速、心律失常(期前收缩、心房颤动)、肠蠕动加快(大便次数增加)、近端肌无力、月经量减少或闭经、情绪不稳定、易怒。甲状腺激素对机体的作用见表1。年轻的甲亢患者常表现出上述典型症状,75岁以上的患者症状通常不典型,如表现为冷漠、乏力、情绪不稳定、气促。心房颤动、充血性心力衰竭、缺血性急性冠状动脉综合征也常见于老年甲亢患者。

儿童和成人甲状腺激素的主要生理作用总结
儿童和成人甲状腺激素的主要生理作用总结
| 作用的组织和器官 | 基本生理作用 | 甲状腺激素分泌过多的效应 |
|---|---|---|
| 所有组织和器官 | 广泛调节机体功能活动和新陈代谢 | 基础代谢率和产热量增加;不耐热和出汗;体质量减轻 |
| 心血管和呼吸系统 | 最佳的心率、每搏输出量和心肌收缩力;血管阻力;最佳的呼吸频率 | 心悸、心律失常、收缩期血压升高、呼吸过快和呼吸短促 |
| 神经系统 | 维持整体功能 | 失眠、情绪不稳、易怒、震颤、突眼、周围神经反射亢进、注意力不集中 |
| 胃肠道 | 维持最佳的肠蠕动 | 胃肠道蠕动增加伴排便次数增多 |
| 皮肤及其附属器官 | 促进角质形成细胞、成纤维细胞、竖毛肌和其他平滑肌细胞、皮脂腺细胞、血管内皮细胞、毛囊细胞和指甲形成细胞的生长 | 浸润性皮肤病和杵状指、脱发、末端甲生长伴剥离 |
| 肌肉骨骼系统 | 维持最佳的骨骼肌生长和骨骼矿物质成分形成 | 近端肌无力;骨矿物质含量减少;脆性骨折 |
| 生殖系统 | 维持男女性腺功能 | 月经稀少;不孕;流产 |
注:靶组织和器官的最佳功能与甲状腺激素的正常水平相关
0.2%的妊娠患者可出现GD导致的甲状腺毒症。但部分出现妊娠一过性甲状腺毒症主要是由于妊娠早期(12~16周)人绒毛膜促性腺激素升高,模拟TSH的作用,刺激TSH受体(TSH receptor, TSHR)。妊娠一过性甲状腺毒症发生率为1%~3%,妊娠中期自然好转。这种情况主要与妊娠呕吐、体质量下降、脱水和电解质紊乱有关,与甲状腺肿和甲状腺相关眼病无关。妊娠期间其他原因导致的甲亢非常少见。
部分GD患者会出现浸润性突眼,少部分会出现浸润性皮肤病和杵状指。甲状腺相关眼病主要表现为双眼刺激症状,结膜和眼睑充血,突眼可导致眼睑闭合不全、角膜干燥、溃疡、感染、复视、不同程度的视神经病变。不到5%的GD患者会出现皮肤改变,如色素沉着、无凹陷性水肿,这些改变通常发生于下肢皮肤。甲状腺相关眼病患者应由眼科专家行进一步评估。骨密度减少通常发生于亚临床甲亢和临床甲亢患者。较大的TMNG患者可能出现气管异位、气管及食管受压,进而引发梗阻症状。
环境因素,如食物碘摄入过多[11]、吸烟[12]、情绪应激可诱发具有多重易感等位基因[特别是主要组织相容性复合体(major histocompatibility complex, MHC)、细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4, CTLA4)和蛋白质酪氨酸磷酸酶非受体22型(protein tyrosine phosphatase non-receptor type 22, PTPN22)基因位点]的遗传易感性患者发生GD[13]。作为器官特异自身免疫性疾病,GD主要由血液循环中的自身抗体[主要是免疫蛋白(immunoglobulin, Ig)G1型]直接作用于TSHR所致。在大多数患者中,TSHR抗体(TSHR antibodies, TRAb)结合TSHR后,通过增加细胞内环磷酸腺苷的浓度刺激甲状腺分泌过量的甲状腺激素。TRAb同时可与甲状腺细胞和眼眶成纤维细胞表面的胰岛素样生长因子(insulin-like growth factor, IGF)1受体相互作用。抗体-受体复合物促进细胞内环状单磷酸腺苷的激活,进而使甲状腺滤泡细胞增生(引起甲状腺肿大)、血供增加、甲状腺激素合成与分泌增加,导致甲亢[14]。另外,眼眶后和胫前软组织也发现有TSHR的表达,导致相应部位的症状与体征。除了遗传易感性,吸烟也是GD环境剂量依赖的危险因素,特别是发生GD眼病的危险因素。吸烟是GD治疗后复发的危险因素,也是131I治疗后突眼等相关症状加重的高危因素,是甲状腺相关眼病激素治疗和球后放疗预后不佳的危险因素。吸烟造成上述改变的病理生理学基础尚不明确,可能机制是吸烟增加免疫反应白细胞介素-1的产生,进而刺激眼眶成纤维细胞生长。除此之外,吸烟还可导致成纤维细胞乏氧,促进透明质酸的合成和脂肪形成[12,15]。参与外源性物质生物转化的酶基因编码多态性也与吸烟相关GD易感性有关[16]。抗甲状腺球蛋白抗体和抗甲状腺过氧化物酶抗体通常存在于GD患者血清中。
当甲状腺功能性结节和无功能性结节同时存在时,TMNG会导致甲亢。随着病程的延长,这些结节表现为自主分泌,不受TSH的调控[17]。TMNG摄碘不均匀,因而碘甲状腺显像既可表现为冷结节,也可为热结节[18]。
TAs是1种单克隆的边界清楚且包膜完整清晰的良性肿瘤,分泌甲状腺激素不受TSH的调控。其特点是碘转运和碘化率增加,甲状腺过氧化物酶和钠碘转运体信使RNA表达增加。大多数情况下,功能获得性TSHR基因突变局限于腺瘤组织(体细胞突变),导致腺苷酸环化酶和细胞内环状单磷酸腺苷的增加,造成甲状腺细胞增殖速率增加[19,20]。与TAs相似,功能获得性TSHR基因突变是TMNG结节形成的原因[17]。同一基因的胚系突变导致其他罕见的家族型非免疫性甲亢[20]。TAs的TSHR体细胞突变率高达82%,TMNG高功能结节的TSHR体细胞突变率达60%[21]。碘缺乏对甲状腺功能自主的发展也有重要作用[22]。
血清游离三碘甲状腺原氨酸(free triiodothyronine, FT3)、游离甲状腺素(free thyroxine, FT4)水平升高,同时TSH水平降低或被抑制可确诊甲亢。亚临床甲亢是指血清TSH水平降低,FT3和FT4正常。GD合成三碘甲状腺原氨酸(triiodothyronine, T3)增加,导致患者T3与甲状腺素(thyroxine, T4)的比值增加。甲亢合并其他严重基础疾病可能会出现FT4升高,FT3正常,TSH检测不到,这主要是因为T4向反T3(reverse T3, rT3) (无功能的激素)转换增加,而外周组织活跃的T3水平未见增加[23]。由于每个T3分子包含3个碘原子,而每个T4分子包括4个碘原子,因此T3是碘缺乏情况下甲状腺合成的主要激素。当碘缺乏时,T3水平增加(T3型甲状腺毒症),T4正常,TSH检测不出。TSHR是GD眼病的主要抗原,严重双眼受累的甲亢患者TRAb水平升高,TRAb升高幅度与疾病严重程度相关。同样,出现胫前黏液性水肿的甲亢患者TRAb水平一般明显升高。
胺碘酮是阵发性和持续性心房颤动患者维持窦性心律的最有效药物,可导致甲亢。胺碘酮导致的甲状腺功能异常发生率为2%~24%。1%~10%的接受胺碘酮治疗的患者会发生甲亢。胺碘酮诱发的甲亢(amiodarone-induced thyrotoxicosis, AIT)包括2种类型。1型AIT发生于甲状腺功能本身异常的患者,原因是过量的碘造成过多的甲状腺激素合成与分泌。维持剂量200 mg/d的胺碘酮包含75 mg的碘(约为平均每日需碘量的500倍)。2型AIT是1种破坏性甲状腺炎,胺碘酮导致甲状腺滤泡细胞破坏,释放已合成的甲状腺激素,通常发生于本身无甲状腺疾病基础的患者。
AIT典型实验室检查结果是血清TSH水平降低,FT4升高,但超过80%的患者FT3正常。AIT的临床表现主要包括不明原因的体质量下降、四肢近端肌无力、心律失常加重、心绞痛、怕热等。然而,AIT通常不出现甲亢的典型临床表现,因为胺碘酮降低了外周组织T4向T3的转换。
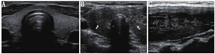
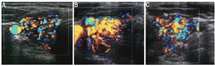
超声检查可以明确甲状腺大小、血供,发现甲状腺结节的位置、大小、数目和特征。大多数GD患者的甲状腺超声表现为弥漫性肿大且呈低回声,这主要是由于甲状腺内血流量增加、细胞密度增加、胶质含量减少及不同程度的淋巴细胞浸润(图1)。彩色多普勒超声中甲状腺血供丰富(与甲亢严重程度相关) (图2),可借此帮助鉴别GD和甲状腺毒症的其他原因,如破坏性甲状腺炎、外源性甲状腺素摄入过多(人为甲状腺毒症),这些改变甲状腺血供一般不增加。彩色多普勒超声也可帮助鉴别1型和2型AIT,后者常表现为血供减少。


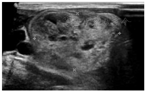
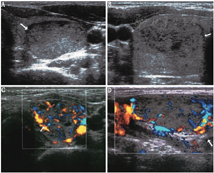
TMNG的甲状腺常比弥漫性甲状腺肿的甲状腺大,通常回声不均匀且合并大小不等及回声不均的结节(图3)。这些结节部分具有功能,部分是无功能的。超声引导下细针穿刺活组织检查(简称活检)一般只考虑穿刺无功能结节,因为甲状腺显像表现为热结节者为肿瘤的概率极低[24]。TAs超声通常表现为实性、等或低回声且边界清楚的结节,结节边缘或结节内、结节周围血供丰富(图4)。


通常甲状腺显像可以观察到以甲亢为特征的碘转换增加。如果患者显像前数周未口服抗甲状腺药物(antithyroid drugs, ATD)或使用碘对比剂(表2),高功能甲状腺组织的甲状腺显像通常表现为明显摄取123I或131I及99TcmO4-。GD表现为弥漫性高摄取(图5A),因为GD患者甲亢的原因是血液循环中的TRAb可以靶向结合于所有表达TSHR的甲状腺细胞。TAs或TMNG通常表现为局灶高摄取的结节,主要是由于这些患者的TSH是被抑制的,结节外的正常甲状腺组织多处于无功能状态,不摄取碘或99TcmO4-(图5B)。TMNG患者的不同结节可表现出不同程度的摄取,甲状腺显像呈斑片状改变(图5C);较大的结节部分区域不摄取并不罕见,提示这些区域功能退变。GD或毒性结节性甲状腺肿明显摄取碘或99TcmO4-,正常唾液腺的生理性摄取会降低。

影响甲状腺131I摄取的因素及131I治疗前推荐的最短停药时间
影响甲状腺131I摄取的因素及131I治疗前推荐的最短停药时间
| 因素 | 停药时间 | |
|---|---|---|
| 甲状腺相关药物 | ||
| 抗甲状腺药物a | 3~7 d至2~3周 | |
| 氯酸盐 | 1周 | |
| 碘化药物或物质 | ||
| 胺碘酮 | 3~6个月 | |
| 静脉对比剂b | 2~4周 | |
| 含碘制剂 | 4周 | |
| 复方碘溶液或过饱和KI溶液 | 4~6周 | |
| 海带或海藻 | 2~4周 | |
| 油基对比剂c | 3~6个月 | |
注:a甲巯咪唑、卡比马唑和丙硫氧嘧啶:甲巯咪唑停药时间较长,丙硫氧嘧啶停药时间较短;b目前使用的非离子对比剂经肾快速清除,因此需要的停药时间可能更短;c目前临床实践很少使用
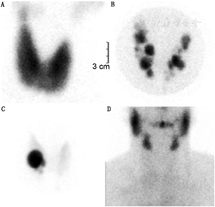

亚急性甲状腺炎甲亢期、破坏性甲状腺炎和人为甲状腺毒症的甲状腺显像通常表现为显像剂摄取降低或缺乏(图5D)。在AIT中,有2种病理生理机制导致甲状腺显像不摄取或低摄取。131I或99TcmO4-甲状腺显像不能将1型AIT(胺碘酮治疗引起的高碘负荷减少了非TMNG背景下碘转运和有机化)与2型AIT(胺碘酮导致的甲状腺炎释放过多的甲状腺激素)区分开来。99Tcm-甲氧基异丁基异腈(methoxyisobutylisonitrile, MIBI)显像可以鉴别1型和2型AIT, 1型AIT表现为MIBI摄取,而2型AIT表现为MIBI摄取减低或缺乏[25]。
RAIU测定对甲状腺功能异常的诊断作用不大[26],但其能提供甲亢131I治疗相关的基本信息[27,28,29]。RAIU可帮助评估甲亢131I治疗前的辐射吸收剂量,以根据个体实际需要剂量调整给予的131I治疗剂量(个体化治疗),遵循原则是以尽可能低的剂量达到治疗目的[30]。
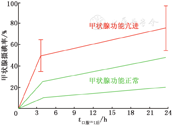
在由GD、TMNG、TAs引起甲亢的患者中,其3~4 h和24 h-RAIU值均高于甲状腺功能正常的人群(图6)。少数患者甲状腺激素排泌过早者可以测定6 h-RAIU,因为24 h-RAIU比6 h-RAIU值低[31]。

部分核医学中心通过99TcmO4-甲状腺显像评估甲状腺功能,方法是测定20 min 99TcmO4-摄取百分比。甲状腺功能正常者该参数为注射活度的0.5%~2%[32]。然而,99TcmO4-甲状腺显像并不能帮助确定131I治疗剂量。
甲亢的治疗方案主要有3种[33,34,35]:ATD治疗(在不同阶段抑制甲状腺激素合成,如碘吸收、碘有机化、甲状腺激素的合成与释放)、手术、131I治疗。
多数国家治疗甲亢首选ATD(丙硫氧嘧啶和卡比马唑或其活性代谢物甲巯咪唑)。虽然ATD起效快(血清甲状腺激素水平恢复正常、症状和体征改善),但ATD减量或停药后易复发,TMNG复发率高达90%[36],GD复发率为40%~50%[37]。为降低复发,ATD疗程须达数月至数年。长期口服ATD可能出现轻微(皮疹)到严重(如粒细胞缺乏或肝炎)的药物不良反应。因此,口服ATD的患者必须定期进行实验室检查和临床随访。不能通过药物控制的复发性GD和TMNG患者可以选择手术,特别是甲状腺肿大压迫邻近结构者首选手术。手术也适用于严重GD眼病患者。
1.131I的作用机制。131I治疗甲亢94%的辐射生物效应源于131I释放的β射线,最大能量为0.61 MeV,平均0.192 MeV,软组织内平均射程0.4 mm,最大3 mm。131I对组织的辐射生物效应包括间接效应(主要通过辐射与水分子相互作用而产生自由基,自由基与细胞内重要大分子相互作用)和直接效应(辐射沉积在细胞核内造成DNA单链和双链损伤,导致细胞死亡)。这种联合的放射生物学效应导致细胞凋亡或坏死,甲状腺滤泡破坏,甲状腺实质被纤维化组织取代。因此,131I治疗效果可与手术直接切除甲状腺组织相媲美。
131I治疗TAs和TMNG的目的是恢复正常甲状腺组织功能,131I治疗GD的目的是实现甲减。TMNG和TAs通过131I治疗甲状腺功能恢复正常是可行的,因为只有体细胞突变的结节引起TSHR的自主激活才能浓聚131I。结节外的甲状腺组织基本不受高功能结节内部的辐射生物损伤。当高功能结节因辐射诱导的细胞凋亡或坏死而退化时,结节外的正常甲状腺组织功能将恢复正常或接近正常[38,39]。
GD所有甲状腺滤泡细胞会受到血液循环中TRAb的刺激作用。在这种情况下,131I治疗后若甲状腺功能恢复正常,提示131I治疗诱导了大部分但不是全部甲状腺细胞的凋亡或坏死,残留了足够的正常甲状腺组织,以确保甲状腺激素的合成与分泌,维持血液循环中正常甲状腺激素水平。然而,血液循环中的TRAb水平未恢复正常(引起GD的病理生理机制仍存在),残存的正常甲状腺滤泡细胞继续受到TRAb的刺激作用,不可避免地会导致甲亢复发。因此,对GD患者行131I治疗的目的是永久性甲减——必须行口服甲状腺激素替代治疗[34,35]。
2.131I治疗的适应证。不能耐受ATD治疗或药物治疗效果不佳、轻中度眼病、拒绝或因并发症不能耐受手术的GD、TMNG、TAs患者可考虑行131I治疗[28,33,34,35,40]。重度GD眼病者131I治疗应仔细权衡可能出现的毒性及不良反应(见下文)。
虽然131I治疗是一线治疗选择,但在美国选择131I治疗甲亢呈下降趋势[41]。2016年美国甲状腺协会指南指出,除了不耐受ATD或ATD疗效不佳适合131I治疗,下述情况也可考虑131I治疗:合并其他基础疾病增加手术风险、颈部既往手术史或颈部接受辐射史、缺乏经验丰富的甲状腺外科医师、低钾性周期性瘫痪、肺动脉高压引起的右心衰竭、充血性心力衰竭。
除了上述适应证,2018年欧洲甲状腺协会甲亢管理指南推荐轻度甲亢(TSH水平0.1~0.39 U/L、只要有可转变成重度甲亢以及增加急性心血管事件和死亡率的风险的因素)也可考虑131I治疗,尤其是大于65岁的老年人。
3.131I治疗的禁忌证。虽然131I治疗甲亢的绝对和相对禁忌证存在差异,但某些绝对禁忌证是明确的。妊娠和哺乳期是131I治疗的绝对禁忌证。其他禁忌证(部分指南认为是绝对禁忌证,但部分指南认为是相对禁忌证)包括不能遵守辐射安全防护原则、合并或怀疑甲状腺癌、131I治疗后6个月内计划妊娠、甲亢未控制。GD眼病患者(尤其是吸烟者)应谨慎考虑131I治疗,因为辐射引起的细胞损伤会导致甲状腺抗原释放到血液循环,增强免疫原性刺激,导致TRAb的合成增加,从而加重GD眼病或131I治疗后出现突眼[42,43,44,45]。
131I治疗前必须详细询问并记录患者病史,主要包括既往甲亢治疗方案,如ATD的疗程和剂量、是否行含碘对比剂的影像学检查、是否服用胺碘酮或其他含碘药物、近期是否服用含碘食物。131I治疗前需完善实验室检查(明确甲亢)、甲状腺显像、RAIU测定、超声评估甲状腺大小(甲状腺肿大向下延伸至胸腔可行MRI检查)、育龄期女性妊娠试验阴性[40]。根据甲状腺结节危险分层系统(美国放射学会甲状腺影像报告和数据系统;https://www.acr.org/Clinical-Resources/Reporting-and-Data-Systems/TIRADS)[46],甲状腺结节(尤其甲状腺显像结果表现为无功能结节者)超声出现以下特征应考虑细针穿刺活检:实性、低回声、纵横比大于1、边界不清楚、腺外侵犯、沙粒状钙化。鉴于此,甲状腺结节超声表现分为5类[TR1(良性)~TR5(高度可疑恶性)]。TR3~TR5类结节可考虑细针穿刺活检。但对于小于1 cm的结节,即便超声怀疑高度恶性结节,应暂避免细针穿刺活检,推荐密切随访。
对于甲状腺明显肿大者(特别是甲状腺体积大于80 cm3并向下延伸至胸腔者),辐射引起的炎性反应可引起甲状腺肿胀,导致气管受压狭窄,特别是甲状腺肿大病程较长者更易出现治疗后气管狭窄,因为长时间的甲状腺肿大会导致气管软骨退化。临床医师必须向患者详细说明131I的治疗方案、可能的并发症和不良反应、其他的治疗方案、治疗结局。必须建议哺乳期妇女停止母乳喂养,131I治疗应推迟到哺乳期结束后进行,以尽量减少对婴儿和乳腺的辐射剂量。
4.131I治疗的准备。131I治疗前准备的目的在于使功能亢进的甲状腺组织(GD:所有甲状腺组织;TMNG和TAs:高功能结节)更好地浓聚131I。131I治疗前卡比马唑和甲巯咪唑应至少停药2~3周,丙硫氧嘧啶至少停药3 d。如果停药期间甲亢症状反复,可给予β受体阻滞剂缓解症状。如果甲亢患者(尤其针对老年患者和合并心脏病和其他严重的系统性疾病者)选择131I作为首选治疗方案,可进行短疗程的ATD治疗,这样可阻断酪氨酸的碘化,而甲状腺滤泡细胞在TRAb作用下继续释放已合成的甲状腺激素,从而消耗甲状腺内储备的甲状腺激素[40,47]。
131I治疗前,患者须停服含碘药物至少2~3周,但胺碘酮需停药数月,并监测尿碘[28]。部分欧洲医疗中心建议患者131I治疗前坚持10~15 d低碘饮食[48],但在美国低碘饮食只适用于甲状腺癌的131I治疗。部分医疗中心131I治疗前7 d给予患者锂剂(250 mg,3次/d)以阻止131I从甲状腺内释放且不影响甲状腺浓聚131I[49,50],但这一方案并未被广泛运用。
5.131I放射性活度的计算。计算方法仍存争议。固定剂量法(185、370、555 MBq)较常用,其经验性根据甲亢的严重程度、甲状腺大小和RAIU值给予单一固定剂量[51];部分国家门诊治疗甲亢能给予的最大131I放射性活度为555 MBq。另外,131I治疗剂量的确定可以基于MIRD计算公式,给予靶组织固定吸收剂量方案,其主要利用甲状腺质量和24 h RAIU[27,28],或甲状腺内131I的有效半衰期决定治疗活度[52]。131I治疗GD推荐吸收剂量为150~300 Gy,治疗自主高功能结节吸收剂量为300~400 Gy[29,40]。部分学者认为每克甲状腺组织给予3.7~5.5 MBq的治疗剂量可使甲状腺组织达100~150 Gy的吸收剂量[24];其他一些研究认为每克甲状腺组织3~8 MBq的治疗剂量能够达到理想的治愈率[28]。
用于计算固定放射性活度或甲状腺吸收剂量[28,29,53,54,55,56]的方法实例见补充材料(http://jnm.snmjournals.org)。
为了使口服131I后在胃肠道达最大吸收,口服131I前必须禁食4 h。嘱患者口服131I后1 h内饮水至少1 L。
6.131I治疗效果。131I治疗甲亢的疗效评估主要通过临床表现和实验室检查,疗效评估时间通常是治疗后3、6和12个月[34,41]。对于GD患者,大多数学者评估131I疗效主要通过观察甲状腺功能是否恢复正常或甲减(左旋甲状腺素替代治疗);对于高功能结节,131I治疗目的是恢复正常甲状腺功能和缩瘤,主要通过超声评估,偶尔可采用甲状腺显像。
7.131I治疗的毒性及不良反应。(1)早期。131I治疗的早期毒性及不良反应主要是由于辐射引起的甲状腺细胞或滤泡的急性损伤。这种损伤导致储存于滤泡胶质的甲状腺激素迅速释放,引起血液循环中FT3和FT4一过性升高,多发生于131I治疗后5~10 d。因此,甲亢相关临床症状和心律失常可能会加重,可给予β受体阻滞剂缓解。若条件允许,131I治疗后3~4 d可继续给予ATD,初次剂量通常与131I治疗前口服ATD剂量一致,并逐渐减量,2~4周内停止。
辐射引起的炎性反应也可引起甲状腺疼痛和肿胀,可根据严重程度给予甾体或非甾体抗炎药。对于甲状腺明显肿大(特别是向下延伸至胸腔者),肿胀可能引起呼吸困难,可予糖皮质激素治疗。与高剂量131I治疗甲状腺癌不同,甲亢131I治疗很少发生由于唾液腺生理性摄131I而引起的涎腺炎。
(2)晚期。固定剂量法能使约80%的甲亢患者达治疗成功(甲减)。6个月后复查未实现甲减的患者可考虑再行131I治疗,约90%在2次131I治疗后可实现甲减。2次131I治疗未实现甲减者可考虑手术。密切随访131I治疗失败者非常重要,因为131I治疗后每年约有5%的患者会发生甲减[57]。
131I治疗单发的高功能结节发生甲减的概率低于10%。一般131I治疗后3~12个月甲状腺功能恢复正常[38,58,59,60]。131I治疗TMNG后8年内甲减的发生率为20%~75%[58]。131I治疗后,甲状腺组织逐渐被纤维瘢痕组织取代[59],超声上表现为乏血供和粗糙的高回声[61]。
131I治疗后,部分GD患者会新发GD眼病或原有眼病加重[38],尤其是吸烟者、严重甲亢合并TRAb升高者、甲亢病程较短者,这主要是由于破坏的甲状腺细胞释放甲状腺抗原,进而刺激眼病相关免疫反应[42,43,44,45,62]。当131I治疗甲亢合并突眼时,应考虑预防性口服糖皮质激素降低甲亢相关眼病加剧的可能性[63]。
高剂量131I治疗甲状腺癌造成男性和女性生育功能的受损已有报道[64,65,66,67],但最近的研究分析不支持这一观点[68]。虽然131I治疗甲亢(剂量相对较低)并不降低患者生育能力,但推荐131I治疗后女性应至少避孕6个月,以确保甲状腺功能恢复正常和稳定的左旋甲状腺素替代治疗。推荐男性131I治疗后至少避育4个月,以恢复精子正常的生成周转。
131I治疗甲状腺癌后担心辐射导致的恶性肿瘤是老生常谈的话题[69,70,71],但这一问题并未被后续的研究所证实[72,73]。最近131I治疗甲亢会增加恶性肿瘤的发生率引起广泛关注[74],但这一观点并不被支持[75,76,77,78,79]。
英国国家健康和保健医学研究所(https://www.nice.org.uk/guidance/ng145)最新发布的指南支持131I治疗甲亢安全有效。在欧洲,约77%的内分泌学家为首诊甲亢且无合并症的患者选择ATD作为一线治疗方案;北美有40%的专家选择ATD治疗,131I治疗甲亢在北美仍然是首选的治疗方案。在欧洲,131I治疗前给予患者ATD治疗以使甲状腺功能恢复正常非常常见;但在北美,131I治疗前给予ATD治疗一般只用于合并心血管疾病的患者[80]。































