
观察小鼠骨髓间充质干细胞(BMSC)经不同途径输注对肾缺血再灌注损伤的治疗效果比较。
体质量为20~25 g的C57BL/6健康雄性小鼠随机分为正常对照组、缺血再灌注组(IRI组)、缺血再灌注+生理盐水注射组(NS组)、缺血再灌注+股静脉细胞输注组(FV组)、缺血再灌注+肾动脉细胞输注组(RA组)、缺血再灌注+眼眶静脉细胞输注组(OV组)。通过切除右侧肾脏并阻断小鼠左侧肾蒂35 min建立肾缺血再灌注损伤模型。各细胞输注组分别相应地经动脉或静脉输注BMSC。取5只正常对照组小鼠全血及肾组织,其余组分别在术后12 h、24 h和48 h各取5只小鼠的全血后处死并收集肾组织,检测血清肌酐水平,HE染色评价组织病理学改变,观察BMSC经不同途径输注后对肾脏缺血再灌注损伤的治疗效果。
与正常对照组相比较,各手术组术后血肌酐明显上升(P<0.05)。输注组(NS组、FV组、RA组、OV组)术后血肌酐上升较IRI组缓慢,术后24 h峰值明显低于IRI组,且恢复较快(P<0.05)。与RA组相比较,FV、OV组术后血肌酐降低,术后24 h峰值降低明显(P<0.01);术后48 h除OV组外,FV组和RA组血肌酐的差异无统计学意义(P>0.05)。FV组和OV组相比较,术后24 h血肌酐的差异无统计学意义(P>0.05),但术后48 h OV组血肌酐改善明显。肾组织病理检查显示各手术组小鼠术后24 h可见肾小管上皮细胞肿胀、变性、坏死甚至脱落等病理变化,肾小球未见明显改变。BMSC输注组(FV、RA、OV组)肾脏病理改变明显减轻,FV和OV组改善更明显。
经动脉或静脉输注的小鼠骨髓间充质干细胞均可改善缺血再灌注损伤导致的肾脏结构和功能改变,但经静脉途径输注的效果更优,且创伤较小。与经股静脉输注途径相比,经眼眶静脉进行细胞输注的修复效果可能更好,可考虑作为以后改善肾缺血再灌注损伤模型的一种技术手段。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肾脏缺血再灌注损伤是导致急性肾损伤和肾功能衰竭的重要原因之一,也是影响移植肾最主要的抗原非依赖性非免疫因素之一[1,2,3]。各种原因导致的肾脏缺血、缺氧可引起肾小管上皮细胞变性、坏死,肾组织结构破坏,从而影响肾功能[4]。对急性缺血再灌注损伤引起的肾脏病理改变采取合理有效的治疗措施,将对机体肾功能的恢复及预后均有重要意义。间充质干细胞是一类具有自我更新和多向分化潜能的细胞,存在于骨髓、脐带血等多个器官组织中,在体内或体外环境中均可在适宜条件下可诱导分化为多种组织细胞,有效修复相应损伤器官的结构和功能[5,6,7,8]。有研究表明,在缺血缺氧环境下,骨髓源性间充质干细胞可被动员进入循环系统,迁移入受损组织器官,参与修复过程[9,10]。外源性的骨髓间充质干细胞可以迁移至受损肾脏中并分化成为各类肾脏固有实质细胞,从而促进损伤肾组织的细胞再生,由于这类细胞免疫功能尚未成熟,输注后不会发生免疫排斥反应,对于肾衰竭及其他肾脏疾病的改善具有重大意义[11,12,13]。但干细胞输注途径多种多样,何种方式治疗效果最佳仍存在争议。本实验旨在观察小鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSC)经不同输注途径对肾缺血再灌注损伤的治疗效果。
1、动物:无特定病原体级C57BL/6健康雄性小鼠,8~10周龄,体质量为20~25 g,由浙江大学医学院附属第一医院实验动物中心购置并饲养。
2、试剂:异氟烷(河北一品制药有限公司),DMEM培养基(美国Gibco公司),生理盐水(杭州民生药业有限公司),FCM Lysing Solution(达文生物有限公司),PBS 1X(吉诺生物医药技术有限公司)。
将小鼠随机分为以下6组,每组5只:(1)正常对照组(N组),不制作模型正常饲养,可作为各手术组术前对照;(2)缺血再灌注组(IRI组),仅制作为急性肾缺血再灌注损伤模型:(3)缺血再灌注+生理盐水注射组(NS组),制作为急性肾缺血再灌注损伤模型后经股静脉输注生理盐水200 μl;(4)缺血再灌注+股静脉细胞输注组(FV组),制作为急性肾缺血再灌注损伤模型后经股静脉缓慢输注BMSC;(5)缺血再灌注+肾动脉细胞输注组(RA组),制作为急性肾缺血再灌注损伤模型后经肾动脉缓慢输注BMSC;(6)缺血再灌注+眼眶静脉细胞输注组(OV组),制作为急性肾缺血再灌注损伤模型后经眼眶静脉缓慢输注BMSC。
用瑞曼吸入式小动物麻醉机对小鼠进行吸入式麻醉,异氟烷体积分数为2%,氧气流速为0.4 L/min。麻醉后将小鼠俯位四肢固定于蛙板上,取腹正中切口,充分暴露右肾,显微镜下大尖镊分离肾筋膜,游离肾蒂,在靠近肾脏处电离器切除肾蒂。同样方法暴露左肾,用无创血管夹夹闭左侧肾蒂35 min,期间置于20~25℃温箱内并维持吸入性麻醉,切口覆以生理盐水浸润的纱布。35 min后,放开动脉夹,单层间断缝合切口。
同系C57BL/6健康雄性小鼠颈椎脱臼处死后浸入体积分数75%乙醇溶液中5 min,无菌分离双侧股骨和胫骨,去掉骨表面肌肉筋膜,用磷酸盐缓冲液(PBS)冲洗2遍,去除两侧骨端部分骨质,暴露骨髓腔,用5 ml注射器抽取DMEM培养基反复冲洗骨髓腔,收集冲洗液于无菌离心管中,400×g离心10 min,红细胞裂解液去除红细胞,生理盐水重悬获得骨髓间充质干细胞悬液,重悬细胞密度为5×105/单位,等待输注。
小鼠再灌注后立即进行细胞输注,经静脉或动脉输注含5×105/单位骨髓间充质干细胞的生理盐水200 μl。
取正常对照组小鼠全血及各手术组小鼠术后12、24和48 h全血。全血2000 r/min离心10 min,收集上层血清,使用干式生化仪检测血清肌酐水平,评价肾脏功能。
取各组小鼠术后24 h肾组织样本,体积分数4%多聚甲醛固定,脱水,石蜡包埋,制成石蜡切片,分别用苏木素和伊红(HE)染色,然后脱水透明,中性树脂封片,显微镜下观察并评价。
数据分析采用SPSS(19.0版)统计软件,组内、组间比较采用方差分析,实验数据以均数±标准差( ±s)表示,P<0.05为差异有统计学意义。
±s)表示,P<0.05为差异有统计学意义。
与正常对照组相比,各手术组术后血肌酐明显上升,在术后24 h血肌酐达到峰值,随后缓慢下降(P<0.05)。输注组(NS组、FV组、RA组、OV组)术后血肌酐上升较IRI组缓慢,术后24 h峰值明显低于IRI组,且恢复较快(P<0.05)。与RA组相比较,FV、OV组术后血肌酐降低,术后24 h峰值降低明显(P<0.01);术后48 h除OV组外,FV组和RA组血肌酐的差异无统计学意义(P>0.05)。FV组和OV组相比较,术后24 h血肌酐的差异无统计学意义(P>0.05),但术后48 h OV组血肌酐改善明显(P<0.05,表1,图1)。
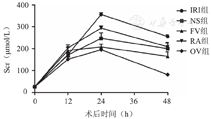

肾缺血再灌注损伤后不同时间各组小鼠的血肌酐水平( ±s)
±s)
肾缺血再灌注损伤后不同时间各组小鼠的血肌酐水平( ±s)
±s)
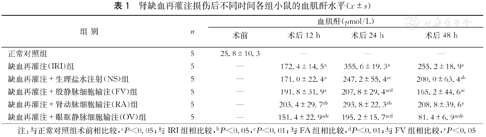
| 组别 | n | 血肌酐(μmol/L) | |||
|---|---|---|---|---|---|
| 术前 | 术后12 h | 术后24 h | 术后48 h | ||
| 正常对照组 | 5 | 25.8±10.3 | — | — | — |
| 缺血再灌注(IRI)组 | 5 | — | 172.4±14.5a | 355.6±19.3a | 255.2±18.9a |
| 缺血再灌注+生理盐水注射(NS)组 | 5 | — | 171.0±22.4a | 247.2±55.4ac | 200.0±63.4ab |
| 缺血再灌注+股静脉细胞输注(FV)组 | 5 | — | 191.8±31.9a | 207.8±29.4acd | 165.2±44.6ac |
| 缺血再灌注+肾动脉细胞输注(RA)组 | 5 | — | 203.4±29.7ab | 293.8±22.3ab | 208.8±39.6a |
| 缺血再灌注+眼眶静脉细胞输注(OV)组 | 5 | — | 151.4±22.9ade | 195.2±15.7acd | 81.4±6.9acde |
注:与正常对照组术前相比较,aP<0.05;与IRI组相比较,bP<0.05,cP<0.01;与FA组相比较,dP<0.01;与FV组相比较,eP<0.05
普通光镜下,正常对照组小鼠肾小球、肾小管、间质结构完整,肾小球数目正常,肾小球及肾间质均未见病变。IRI组小鼠术后24 h可见肾脏组织中肾小管上皮细胞刷状缘脱落,上皮细胞肿胀、空泡样变性、坏死等病理变化,肾小管管腔内充满红色颗粒状的坏死物,可见坏死脱落的细胞管型、蛋白管型或透明管型,肾间质水肿,炎症细胞浸润增多,肾小球未见明显改变。RA组肾小管损伤程度较IRI组轻,管型减少,间质炎症细胞浸润减轻。其余BMSC输注组(FV、RA、OV组)肾脏病理改变明显减轻,FV和OV组改善更明显(图2)。
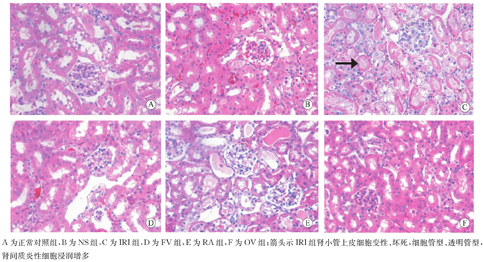

A为正常对照组,B为NS组,C为IRI组,D为FV组,E为RA组,F为OV组;箭头示IRI组肾小管上皮细胞变性、坏死,细胞管型、透明管型,肾间质炎性细胞浸润增多
在肾缺血再灌注损伤过程中,肾小管上皮细胞缺失和功能障碍是最重要的改变。若肾小管损坏严重而不能完全恢复,就会进入慢性肾功能衰竭阶段,需长期或终身肾脏替代治疗或肾移植。本研究也同样发现急性肾缺血再灌注后肾小管上皮细胞的病理改变较肾小球更为显著,且在术后24 h病理改变最为严重,同时测得的血肌酐值在术后24 h达到最高峰,可考虑在此时间点进行各不同干预组的比较。缺血后恢复灌注,肾小管上皮细胞逐步增殖修复上皮的完整性,肾功能可部分逐渐恢复。肾小管新生细胞可来源于肾脏固有成熟的细胞、肾脏固有未分化的干细胞和循环中的细胞[14,15]。骨髓源性间充质干细胞可以迁移至受损肾脏中并分化成为各类肾脏固有实质细胞,如系膜细胞、小管上皮细胞、足细胞等,从而促进损伤肾组织细胞再生,改善肾功能[10,12,13]。Kale等[12]实验证实,骨髓间充质干细胞输注可显著降低血清尿素氮水平,促进肾功能恢复。由于BMSC较脐带血来源的干细胞更容易获得并实现自体细胞来源的输注,且肌酐通过肾小球滤过而很少被肾小管重吸收,可较客观反映肾功能情况,故本研究采用输注同种异体BMSC治疗小鼠肾缺血再灌注损伤,以检测的血肌酐水平作为反映肾功能的指标。本研究通过不同时间点的血肌酐水平测定,发现各组急性肾缺血再灌注损伤术后,血肌酐值均明显升高,且于术后24 h达到最高值,随后缓慢下降,反映了肾功能损害最严重程度是在术后24 h,而由于小鼠机体本身存在自我修复功能,故可在随后时间中逐渐改善。注射生理盐水可以提高全身血容量,增加微循环灌注,使得受损部位加快修复,在本实验中起到阳性对照作用。同时,纵观输注组的血肌酐值变化情况,发现其变化幅度比纯手术组明显较浅,峰值明显较低,恢复也较快,有效反映证实了BMSC可明显改善肾脏功能;并通过术后24 h各组肾脏组织化学观察,发现BMSC对缺血再灌注损伤造成的严重的肾小管病变有良好的修复作用。
骨髓间充质干细胞的分化机制目前还不清楚,有研究认为其分化过程可能包括3个重要的环节:动员、迁移和分化。在迁移环节中,肾缺血再灌注损伤时存在炎症,产生许多细胞因子、趋化因子等,这些因子可能是吸引外周血中的骨髓间充质干细胞定向迁移到损伤局部的始动因素[16]。目前肾脏间充质干细胞输注相关研究多采用外周静脉输注和经肾动脉直接输注两种途径。外周静脉注射创伤小,但目前没有促使干细胞对肾脏组织特异性靶向趋化的有效办法,仅依靠干细胞在损伤区的归巢能力,可有细胞定位差等不足之处[17,18],影响治疗效果;经肾动脉直接注射法定位准确,可以使较多数量的细胞较准确地输注到肾脏,达到最佳治疗效果,但其缺点同样明显,例如创伤性较大,对技术水平及设备要求高。本实验研究表明,经过肾动脉或者外周静脉输注BMSC,均能改善受损肾脏的结构和功能,但是经外周静脉输注途径其治疗效果更为显著,指出BMSC的修复作用可能并不是单纯的依靠其在受损组织中的数目。已有研究表明,间充质干细胞可通过促进肾脏局部自分泌和旁分泌生长因子等,促进肾脏固有的祖细胞向肾小管上皮细胞分化,以促进损伤肾小管上皮细胞的修复[9,19,20,21,22]。本实验发现,与经肾动脉输注相比,经外周静脉循环途径输注的BMSC对肾功能的修复作用更为明显;与股静脉输注途径相比,经远端静脉输注如眼眶静脉,其对肾功能的修复也同样更优,说明BMSC在受损肾组织中的数目在修复过程中可能不起主要作用,同时存在有其他更为重要的修复机制,比如其对肾组织的自分泌和旁分泌的促进作用。本次实验局限性有未进行骨髓间充质干细胞的示踪和定位检测,不能较直观反映其输注进入肾脏的定植情况,且其对促进肾脏的自分泌和旁分泌的机制有待进一步研究。
综上所述,本研究表明,输注外源性的骨髓间充质干细胞可有效治疗改善肾缺血再灌注损伤。外周静脉输注途径比肾动脉输注途径的治疗效果更佳,间充质干细胞定植于受损组织的数目可能并不是参与修复的主要原因,或者受损组织的修复改善并不随干细胞数目增多而增强,且经肾动脉输注造成的创伤不可忽视。在此修复进程中,除了间充质干细胞的数量,同时可能存在其他更为重要的修复机制,比如其对肾组织的自分泌和旁分泌的促进作用。BMSC经眼眶静脉输注途径治疗急性肾缺血再灌注损伤效果最好,可考虑作为以后改善肾缺血再灌注损伤模型的一种技术手段。



























