
观察新型抗风湿病药物艾拉莫德降低肾移植受者群体反应性抗体(PRA)水平的有效性和安全性。
回顾性分析35例因PRA阳性服用艾拉莫德的肾移植受者临床资料,观察治疗前后的PRA水平变化以及用药不良反应情况。
35例中4例因肺部感染停药未达随访时间,2例观察期间自行停药,3例失访,共纳入26例受者。服用艾拉莫德至9个月时复查PRA,207个位点中有71.5 %呈下降趋势,其中107个Ⅰ类位点中有69.9 %、41个Ⅱ类位点中有75.9 %呈下降趋势,治疗前后肾功能及免疫指标变化差异无统计学意义。血常规、肝功能、血脂、空腹血糖等指标变化无统计学意义。无其他不良反应。
艾拉莫德可有效降低肾移植受者PRA水平,不良反应少,安全性高。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肾移植是目前公认治疗终末期肾病(ESRD)的最佳治疗方式,显著提高了ESRD患者的生存质量,但是长期存活率始终没有改善,其重要的原因即抗体介导的排斥反应(ABMR)[1]。部分移植受者在移植后早期即开始出现PRA升高,经移植肾活检证实存在ABMR,可能迅速导致移植肾功能丧失。现有针对PRA升高的治疗手段存在费用昂贵、不良反应明显等缺点[2,3]。艾拉莫德作为新型抗风湿病药物,理论上具有抑制淋巴细胞增殖及抗体生成等作用[4],可能具有降低PRA及抗排斥反应作用。本研究首次将艾拉莫德应用于PRA阳性的肾移植受者,观察其有效性及安全性。
选取2010年1月至2018年12月期间在南京医科大学第一附属医院行肾移植术、随访过程中因出现PRA阳性而服用艾拉莫德并且资料完整的肾移植受者35例,所有受者均签署知情同意书,并经医院伦理委员会同意(伦理号2016-SR-029)。排除标准:①妊娠或哺乳期女性;②联合器官移植受者;③受者伴有以下任何一项疾病:严重心肺肝脏等重要脏器和血液、内分泌系统病变、恶性肿瘤等疾病;未控制的感染及活动性胃肠道疾病(如胃溃疡等)。
使用巴利昔单抗或抗人类胸腺细胞免疫球蛋白(ATG)作为诱导治疗,维持期采用三联[泼尼松+霉酚酸酯+钙调磷酸酶抑制剂(CNIs)]或四联(泼尼松+霉酚酸酯+CNIs+西罗莫司)抗排斥治疗。艾拉莫德片剂(江苏先声药业有限公司,规格:25 mg/片)用法为口服50 mg/d,连续服用9个月。
记录用药前和用药后9个月的PRA变化,比较相应时间点的白细胞计数、血小板计数、血红蛋白、肝功能、血脂、空腹血糖、肾功能、肾小球滤过率(eGFR)、CD19+淋巴细胞计数、IgG、补体C3等变化;eGFR采用JSN-CKDI公式估算[5]。有效性评价包括PRA水平、免疫指标及肾功能变化。安全性评估:观察受者用药后是否出现不良反应,详细记录各器官系统不良反应。
急性排斥反应的诊断标准依据中国肾移植排斥反应临床诊疗指南[2]。病理诊断急性排斥反应由病理医生根据Banff分类标准(2013版)[6]判断。
PRA检测:应用Luminex单一抗原(LSA)方法,采用商品化LABScre试剂(美国ONELAMBDA,INC,CA,USA)检测受者血清PRA-Ⅰ类、Ⅱ类抗体。受者血清直接用相应单抗原包被的免疫微珠检测(LABScreen single antigen beads,美国One Lambda,INC,CA,USA)Ⅰ类、Ⅱ类抗体。实验操作严格按照试剂公司提供的规程进行。实验结束后于Luminex-200仪器上(LABScan 200 FlowAnalyzer,美国Luminex)读取结果,专用分析软件HLA fusion 4.1(美国One Lambda,INC,CA,USA)进行分析,平均荧光强度(MFI)值100以上判为阳性,MFI值下降≥10%定义为有效(下降)。
应用SPSS statistics V20及GraphPad Prism 8进行统计学处理,定量资料以Mean±SD表示,并先采用Kolmogorov-Smirnov进行正态性检验,非正态分布以中位数表示。符合正态分布的资料采用配对t检验,非正态分布采用Wilcoxon配对秩和检验;亚组分析中两组比较采用Mann-Whitney U秩和检验,多组比较及两两比较采用Kruskal-Wallis H检验。P<0.05为差异有统计学意义。
共检索到服用艾拉莫德的PRA阳性肾移植受者35例,其中4例因肺部感染停药未达随访时间,2例观察期间自行停药,3例失访,最终纳入研究的26例。其中男性受者14例,年龄(38.31±9.00)岁,开始服药时间为移植术后(20.77±20.20)个月,血液透析的受者20例,腹膜透析受者6例,平均透析时间(3.27±2.11)年。肾移植手术后多数恢复较为顺利,有5例发生移植肾功能延迟恢复(DGF),术后免疫抑制剂为经典三联抗排斥方案(泼尼松+酶酚酸酯+CNIs),其中8例加用西罗莫司。纳入的26例受者中23例考虑为慢性肾小球肾炎,14例有输血史。
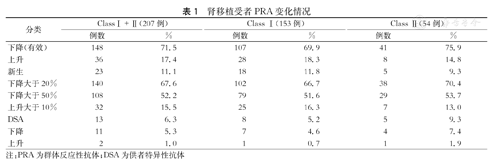
共检测出207个抗体位点,包含13个(6.3 %)DSA。受者治疗后PRA下降的位点有148个(71.5 %),上升的位点有36个(17.4 %),另有23个新生抗体(11.1 %)。其中,下降幅度大于20 %的位点有140个(67.6 %),下降幅度大于50 %的位点有108个(52.2 %),上升幅度大于10 %的位点有32个(15.5 %)。按照每个受者下降位点数占各自总位点数的比例,其中18例有>50 %的抗体位点呈下降趋势。13个DSA位点中,有11个下降,其中10个下降>50 %(含8个下降100 %),1个下降>20 %,2个升高的均为新生DSA,升高的MFI分别为405.54和130.52。Ⅰ类和Ⅱ类抗体的亚组情况详见表1。比较服用艾拉莫德前后的PRA水平,服药9个月后受者的PRA明显下降(P=1.74×10-9),且Ⅰ类抗体和Ⅱ类抗体均表现出明显下降(Ⅰ类:P=3.33×10-6,Ⅱ类:P=1.54×10-4),差异有统计学意义。(P值为渐近显著性双侧值P)
肾移植受者PRA变化情况
肾移植受者PRA变化情况
| 分类 | ClassⅠ+Ⅱ(207例) | Class Ⅰ(153例) | Class Ⅱ(54例) | |||
|---|---|---|---|---|---|---|
| 例数 | % | 例数 | % | 例数 | % | |
| 下降(有效) | 148 | 71.5 | 107 | 69.9 | 41 | 75.9 |
| 上升 | 36 | 17.4 | 28 | 18.3 | 8 | 14.8 |
| 新生 | 23 | 11.1 | 18 | 11.8 | 5 | 9.3 |
| 下降大于20% | 140 | 67.6 | 102 | 66.7 | 38 | 70.4 |
| 下降大于50% | 108 | 52.2 | 79 | 51.6 | 29 | 53.7 |
| 上升大于10% | 32 | 15.5 | 25 | 16.3 | 7 | 13.0 |
| DSA | 13 | 6.3 | 8 | 5.2 | 5 | 9.3 |
| 下降 | 11 | 5.3 | 7 | 4.6 | 4 | 7.4 |
| 上升 | 2 | 1.0 | 1 | 0.7 | 1 | 1.9 |
注:PRA为群体反应性抗体;DSA为供者特异性抗体
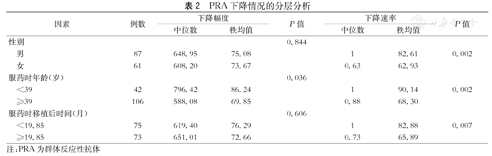
比较不同分组治疗后PRA下降的情况,男性(P=0.002)、服药时年龄小于39岁(P=0.002)和服药时移植术后时间小于19.85个月(P=0.007)的受者较女性、服药时年龄大于等于39岁和服药时移植术后时间≥19.85个月的受者具有更快的PRA下降速度,差异有统计学意义;且服药时年龄小于39岁组PRA下降幅度更大(P=0.036),差异有统计学意义(表2)。
PRA下降情况的分层分析
PRA下降情况的分层分析
| 因素 | 例数 | 下降幅度 | P值 | 下降速率 | P值 | |||
|---|---|---|---|---|---|---|---|---|
| 中位数 | 秩均值 | 中位数 | 秩均值 | |||||
| 性别 | 0.844 | |||||||
| 男 | 87 | 648.95 | 75.08 | 1 | 82.61 | 0.002 | ||
| 女 | 61 | 608.20 | 73.67 | 0.63 | 62.93 | |||
| 服药时年龄(岁) | 0.036 | |||||||
| <39 | 42 | 796.42 | 86.24 | 1 | 90.14 | 0.002 | ||
| ≥39 | 106 | 588.08 | 69.85 | 0.88 | 68.30 | |||
| 服药时移植后时间(月) | 0.606 | |||||||
| <19.85 | 75 | 619.40 | 76.29 | 1 | 82.88 | 0.007 | ||
| ≥19.85 | 73 | 651.01 | 72.66 | 0.73 | 65.89 | |||
注:PRA为群体反应性抗体
比较不同免疫抑制剂方案的受者PRA下降情况发现四组受者的下降速率差异无统计学意义(P=0.057),但下降的幅度四组分布不同,其中Pred+MMF+CsA组下降幅度明显低于Pred+MMF+Tac组(P<0.001)和Pred+MMF+Tac+SRL组(P=0.048),差异有统计学意义。(表3)

不同免疫抑制方案PRA下降情况的分层分析
不同免疫抑制方案PRA下降情况的分层分析
| 免疫抑制剂方案 | 例数 | 下降幅度 | P值 | 下降速率 | P值 |
|---|---|---|---|---|---|
| 中位数 | 中位数 | ||||
| Pred+MMF+Tac | 105 | 718.95a | 1 | 0.057 | |
| Pred+MMF+CsA | 23 | 229.69 | 0.73 | ||
| Pred+MMF+Tac+SRL | 15 | 463.04a | 1 | ||
| Pred+MMF+CsA+SRL | 5 | 260.21 | <0.001 | 0.10 |
注:PRA为群体反应性抗体;Pred为泼尼松;MMF为霉酚酸酯;Tac为他克莫司;CsA为环孢素A;SRL为西罗莫司;a为与Pred+MMF+CsA组进行两两比较,P<0.05
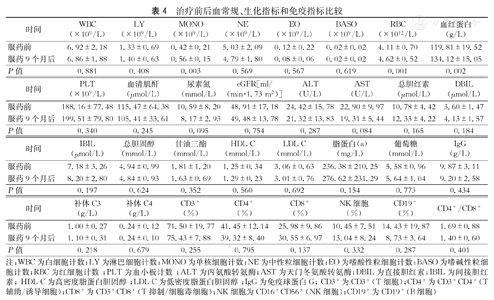
治疗期间共有3例受者出现病理确诊的排斥反应,2例为ABMR,1例为T淋巴细胞介导的排斥反应(TCMR),未发现亚临床排斥反应。治疗前后受者的血清肌酐水平分别为:服药前115.47±64.38 μmol/L,服药后105.41±33.61 μmol/L(P=0.245);血尿素氮水平分别为:服药前10.59±8.20 mmol/L,服药后8.17±2.93 mmol/L(P=0.095);估算的肾小球滤过率(eGFR)水平分别为:服药前48.91±17.18 ml/(min·1.73 m2),服药后49.48±13.78 ml/(min·1.73 m2)(P=0.754),差异无统计学意义(表4)。治疗前后免疫球蛋白G(IgG)、补体C3和T淋巴细胞亚群未发现明显变化(表4)。
治疗前后血常规、生化指标和免疫指标比较
治疗前后血常规、生化指标和免疫指标比较
| 时间 | WBC(×109/L) | LY(×109/L) | MONO(×109/L) | NE(×109/L) | EO(×109/L) | BASO(×109/L) | RBC(×1012/L) | 血红蛋白(g/L) |
|---|---|---|---|---|---|---|---|---|
| 服药前 | 6.92±2.18 | 1.33±0.69 | 0.42±0.21 | 5.03±2.09 | 0.12±0.22 | 0.02±0.02 | 4.11±0.70 | 119.81±19.52 |
| 服药9个月后 | 6.86±1.88 | 1.40±0.63 | 0.56±0.15 | 4.79±1.80 | 0.08±0.06 | 0.02±0.02 | 4.62±0.52 | 134.12±15.05 |
| P值 | 0.881 | 0.408 | 0.003 | 0.569 | 0.567 | 0.619 | 0.001 | 0.002 |
| 时间 | PLT(×109/L) | 血清肌酐(μmol/L) | 尿素氮(mmol/L) | eGFR[ml/(min·1.73 m2)] | ALT(U/L) | AST(U/L) | 总胆红素(μmol/L) | DBIL(μmol/L) |
|---|---|---|---|---|---|---|---|---|
| 服药前 | 188.16±77.48 | 115.47±64.38 | 10.59±8.20 | 48.91±17.18 | 24.42±15.78 | 22.90±9.97 | 10.78±4.42 | 3.60±1.47 |
| 服药9个月后 | 199.51±79.80 | 105.41±33.61 | 8.17±2.93 | 49.48±13.78 | 21.32±13.83 | 19.31±5.44 | 12.33±4.22 | 4.13±1.57 |
| P值 | 0.340 | 0.245 | 0.095 | 0.754 | 0.287 | 0.084 | 0.165 | 0.184 |
| 时间 | IBIL(μmol/L) | 总胆固醇(mmol/L) | 甘油三酯(mmol/L) | HDL-C(mmol/L) | LDL-C(mmol/L) | 脂蛋白(a) (mg/L) | 葡萄糖(mmol/L) | IgG(g/L) |
|---|---|---|---|---|---|---|---|---|
| 服药前 | 7.18±3.26 | 4.94±0.99 | 1.81±1.20 | 1.25±0.34 | 3.06±0.63 | 236.38±210.25 | 5.58±0.96 | 9.87±3.11 |
| 服药9个月后 | 8.20±2.80 | 4.84±0.93 | 1.63±0.69 | 1.29±0.23 | 3.01±0.76 | 276.62±231.29 | 5.64±1.04 | 9.20±2.58 |
| P值 | 0.197 | 0.624 | 0.352 | 0.560 | 0.692 | 0.154 | 0.773 | 0.434 |
| 时间 | 补体C3(g/L) | 补体C4(g/L) | CD3+(%) | CD4+(%) | CD8+(%) | NK细胞(%) | CD19+(%) | CD4+/CD8+ |
|---|---|---|---|---|---|---|---|---|
| 服药前 | 1.00±0.27 | 0.24±0.12 | 71.50±19.77 | 41.45±12.14 | 25.98±9.86 | 10.45±7.51 | 14.43±19.87 | 1.69±0.88 |
| 服药9个月后 | 1.10±0.31 | 0.24±0.10 | 75.43±7.88 | 39.32±8.40 | 30.55±6.97 | 13.04±8.24 | 8.73±3.64 | 1.40±0.60 |
| P值 | 0.218 | 0.679 | 0.255 | 0.795 | 0.137 | 0.332 | 0.287 | 0.401 |
注:WBC为白细胞计数;LY为淋巴细胞计数;MONO为单核细胞计数;NE为中性粒细胞计数;EO为嗜酸性粒细胞计数;BASO为嗜碱性粒细胞计数;RBC为红细胞计数 ;PLT为血小板计数 ;ALT为丙氨酸转氨酶;AST为天门冬氨酸转氨酶;DBIL为直接胆红素;IBIL为间接胆红素; HDL-C为高密度脂蛋白胆固醇 ;LDL-C为低密度脂蛋白胆固醇 ;IgG为免疫球蛋白G; CD3+为CD3+(T细胞);CD4+为CD3+CD4+(T辅助/诱导细胞);CD8+为CD3+CD8+(T抑制/细胞毒细胞);NK细胞为CD16+CD56+(NK细胞);CD19+为CD19+(B细胞)
受者治疗前后血常规及生化指标的结果比较,仅单核细胞、红细胞计数和血红蛋白治疗后有明显上升,其余均未发现明显变化(表4)。
随访期间,共4例出现肺部感染而停药,均为轻症肺部感染,无其他不良反应发生。
ABMR是公认的影响移植肾远期预后的首要因素。目前认为其发生机制是B淋巴细胞和浆细胞活化产生DSA(供者特异性抗体),与内皮细胞上的人类白细胞抗原(HLA)或非HLA分子结合造成内皮细胞的损伤[1]。DSA的出现往往早于组织学损伤[7],因此通过检测DSA可以早期发现ABMR。PRA升高同样与移植肾的长期存活密切相关,既往研究提示,肾移植失败的受者PRA的发生率可达70 %以上[8],而肾移植术前PRA阳性亦影响术后移植肾功能,并导致移植肾长期存活率下降,这是由于PRA高水平的肾移植受者在接受肾移植后,发生排斥反应、DGF的概率均高于PRA低水平的受者,并对移植肾造成慢性损伤,从而影响其长期存活[9]。ABMR的主要治疗策略是清除预存抗体,抑制B淋巴细胞及浆细胞产生新的抗体。现阶段常用的治疗方法包括血浆置换、IVIG、硼替佐米、抗CD20单抗、依库丽单抗等。但这些方法疗效不稳定、不良反应较多、价格昂贵[2,3]。因此需要安全有效、使用方便、价格经济的药物用于治疗ABMR。
艾拉莫德是新型的具有抗炎和免疫调节性质的小分子化合物,已广泛应用于类风湿性关节炎、干燥综合征等风湿免疫疾病的治疗。目前认为其可能的作用机制包括抑制抗原特异性T淋巴细胞增殖、抑制B淋巴细胞分化为浆细胞、抑制抗体的生成。一项关于狼疮肾病小鼠模型的研究[10]发现,艾拉莫德可以下调IL-6等炎症因子的表达,显著降低小鼠体内自身抗体及免疫球蛋白水平,改善肾小球炎症及小血管炎症的病理表现,减少肾组织中B淋巴细胞浸润。基于上述机制,我们首次提出将艾拉莫德用于高致敏的尿毒症患者及肾移植受者[11],观察其降低PRA水平及不良反应发生情况。
本研究中单独选取肾移植受者,可以观察到受者服用艾拉莫德以后无论是Ⅰ类还是Ⅱ类PRA水平均明显下降,证实艾拉莫德有明显降低PRA的作用。进一步分析发现,在PRA下降的受者中,男性受者、术后时间较短的受者其PRA下降的速率更快。随着时间的推移,肾移植受者的依从性逐渐下降,因此PRA下降快可能与术后早期受者依从性较好有关。
针对使用不同免疫抑制剂方案的受者PRA变化对比发现,Pred+MMF+CsA组下降幅度较Pred+MMF+Tac和Pred+MMF+Tac+SRL组明显,既往研究亦显示,与使用他克莫司的受者比较,使用环孢素A的受者更容易产生DSA[12],可能与他克莫司抗排斥作用强度强于环孢素A有关,并且四联组在三联基础上联用了西罗莫司,进一步提高了免疫抑制强度。
本组研究中有3例受者发生病理证实的排斥反应,但由于未进行移植肾再次活检,尚无法通过病理检验艾拉莫德对排斥反应组织学改变是否有干预作用。考虑到艾拉莫德的作用机制,同时检测了受者的IgG和B淋巴细胞水平,并未观察到两者的变化,可能与样本量较小有关。后续的前瞻性研究中,我们将扩大样本量,并对使用艾拉莫德的受者行移植肾重复活检,从病理角度明确艾拉莫德的抗排斥作用。
回顾性分析治疗以后PRA升高的人群发现,共有36个位点的PRA上升,涉及到10例受者。其中有27个位点升高集中分布于4例受者,这4例受者均为女性,均有妊娠史,其中1例有输血史,手术后开始服药时间5年以上,可能与妊娠和输血导致的高致敏有关[13]。此外该4例受者术后至开始服药时间均较长,而对比了PRA上升位点数占各自总位点数的比例>50 %的受者和≤50 %的受者,其肾移植术后平均时间分别为12.7个月和39.0个月,差异有统计学意义,提示艾拉莫德对于术后较长时间受者可能效果欠佳。
艾拉莫德既往的安全性研究均来自于类风湿性关节炎、干燥综合征等自身免疫性疾病患者,尚无针对肾功能异常人群的安全性研究,结合既往研究及本中心经验,该药物对肾功能并无影响。本研究中受者治疗前后血清肌酐、eGFR等肾功能指标差异无统计学意义,其余肝功能、血脂、血常规等指标差异亦无统计学意义,在服药过程中无消化系统、血液系统、心血管系统、内分泌代谢系统、精神神经系统、骨关节系统、皮肤等各器官及系统不良反应。其中4例受者发生轻症肺部感染,予撤减MMF、CNIs、艾拉莫德及抗感染治疗后好转,无一例重症感染发生。因此我们认为服用艾拉莫德是安全的,但其长期的安全性仍有待进一步观察。
本研究证实艾拉莫德可显著降低肾移植受者PRA水平,并具有良好的安全性,可作为治疗PRA升高的新方法,但仍需大样本前瞻性随机对照研究证实。但是对于艾拉莫德降低PRA的机制尚不明确,结合既往研究考虑可能与其抑制B淋巴细胞分化为浆细胞、抑制T淋巴细胞增殖有关,仍需要进一步的基础研究。
所有作者均声明不存在利益冲突



























