
移植物功能是移植术后受者存活率主要决定因素之一,受缺血再灌注、蛋白尿、高血压、排斥等影响。大量研究表明盐皮质激素受体拮抗剂(MRA)可有效预防减轻钙调神经磷酸酶抑制剂肾病及缺血再灌注损伤(IRI),减少慢性肾病者蛋白尿及心血管并发症高风险者心血管事件发生率,因此,MRA可能有助于改善移植物功能进而提高肾移植受者移植术后存活率。本综述介绍了MRAs新近相关研究进展,旨在将其应用于肾移植受者以期改善预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肾移植及透析是治疗终末期肾病的两大方法。肾移植受者在术前及术后早期常合并严重心血管疾病,术后免疫抑制剂相关肾毒性及缺血再灌注损伤(IRI)等会严重威胁移植物功能,进而影响远期存活[1]。目前供器官短缺明显,较多供器官来自扩大标准供者,此外,较多合并症的老年受者获得移植机会,致使移植物对IRI及免疫抑制剂肾毒性更敏感[2,3,4]。研究证实盐皮质激素受体拮抗剂(MRA)可有效预防或减轻钙调神经磷酸酶抑制剂(CNI)肾病及IRI,减少受者蛋白尿及心血管事件发生率[1]。
但MRA尚未在肾移植受者中广泛使用。本综述将提供支持MRA在未来肾移植中使用的现有证据,以改善移植物功能及受者预后。
盐皮质激素受体(MR)分布广泛,主要表达在远曲肾小管及集合管,肾血管内皮、叶间动脉的血管平滑肌细胞及远端结肠和汗腺中;此外,在无矢量钠转运的组织和细胞中及Ⅰ型糖尿病、难治性高血压等疾病状态下的肾小球细胞中也可表达[5]。MRA可分为甾体类及非甾体类。甾体类主要包括螺内酯及依普利酮。非甾体类主要为非奈利酮。当前,甾体类已广泛用于心衰等心血管疾病的治疗,而非甾体类非奈利酮仍处于临床试验阶段[5]。临床上,MRA副作用与其对雄激素和孕酮受体的抑制作用有关,可致阳痿、男性乳房女性化、女性多毛等。此外,高钾血症也是MRA潜在副作用。
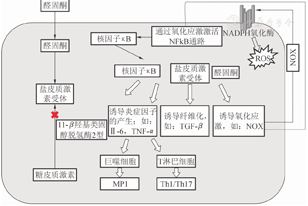
首先,醛固酮(ALD)与MR结合形成复合物,然后,该复合物与ALD诱导或抑制基因的启动子区域内糖皮质激素反应元件结合调节其转录[5]。经典靶细胞中,在ALD存在下,顶端Na+通道以及基底外侧Na+泵和K+通道被上调,致跨上皮钠重吸收持续增加。离子通道重塑是盐皮质激素信号传导的普遍特征。MRA通过离子通道表达或活性调节、限制氧化应激发生、减少炎症反应等减少动脉僵硬、肾小球硬化等发生,从而保护肾功能[5]。ALD和MR激活有害作用的核心机制是氧化应激,ALD/MR复合物上调烟酰胺腺嘌呤二核苷酸磷酸氧化酶亚基表达,从而影响该酶活性。一氧化氮合酶解偶联降低了一氧化氮对血管舒张能力,且增加了过氧化氢的产生及核因子κB(NF-κB)途径活化,致炎症和纤维化。此外,MR激活可使靶细胞中IL-6、TNF-α表达和NF-κB活化,促进巨噬细胞活化为促炎性M1型、促进T淋巴细胞分化为促炎性Th1和Th17亚型,同时,还导致抗炎T调节淋巴细胞数量减少[1](图1)。

尽管"无缺血"肾移植技术已应用于临床,但对大多数移植中心而言IRI仍难避免。IRI可诱发急性肾损伤(AKI),进而导致慢性肾脏病(CKD)进展和肾功能衰竭风险增加[6,7]。在一项研究肾移植受者较高剂量螺内酯对肾功能,IRI期间氧化应激等影响的实验中,从移植前3 d到移植后5 d受者随机口服安慰剂,螺内酯50 mg或螺内酯100 mg处理。在100 mg螺内酯处理组中,尿热休克蛋白72水平的升高趋于减弱。在安慰剂组中,移植后第3天和第5天尿中的8-羟基化鸟苷水平升高。然而,在螺内酯治疗组中,该作用则被阻止。表明螺内酯可防止IRI期间尿中氧化应激的急剧增加[8]。另一项活体肾移植研究显示,受者于术前1 d和术后连续3 d服用螺内酯(25 mg/d),对减轻肾脏氧化应激有益。移植5 d后,安慰剂组的尿过氧化氢含量较高,螺内酯治疗组则显著降低[9]。且服用MRA的受者中尿氧化应激标记物8-异前列烷水平降低,这与之前报道过的MRA对啮齿动物和猪的氧化应激的益处一致,使用MRA可有效防止其肾功能下降和肾小管-间质纤维化[10]。然而,另一项随机对照试验显示,80例肾移植受者(螺内酯组39例,安慰剂组41例)分别口服螺内酯(25~50 mg)及安慰剂1年,结果提示螺内酯会增加血浆ALD和钾水平,两组在内皮功能障碍或炎症方面的测量指标差异无统计学意义[11]。表明MRA意义拮抗作用并不能改善肾移植受者内皮功能障碍或血管炎症。然而本试验研究对象是由移植后任意时间段筛选出的肾移植受者[12],螺内酯组受者移植后的时间差异很大,故不能完全据此否定MRA类药物可改善移植物血管内皮功能障碍及炎症反应。综合现有研究可发现发生IRI后早期使用MRA类药物可能有助减轻IRI、保护肾功能[13],进而避免AKI向CKD过渡。
CNI可通过对血管内皮、平滑肌细胞和肾小管上皮造成直接毒性,诱导血管收缩剂释放,引起缺血,致肾功能降低[12,14,15]。Bobadilla和Gamba[16]研究发现MRA可限制环孢素A的肾毒性。该研究将28只雄性Wistar大鼠随机分两组,对照组接受安慰剂,试验组接受环孢素A(15 mg/kg口服)处理,18 d后,每组的一半在随后的18 d中接受螺内酯(20 mg/kg,口服)。发现环孢素A-螺内酯治疗组在治疗36 d后存活的动物百分比为90%,而环孢素A组为67%。在第18天时环孢素A和环孢素A-螺内酯组的肌酐清除率分别为(0.7±0.1)ml/min和(0.8±0.1)ml/min。实验结束时,环孢素A处理动物的肌酐清除率进一步降低至(0.4±0.1)ml/min(P=0.006)。相反,在第36天,环孢素A-螺内酯组中的肌酐清除率保持在(0.9±0.1)ml/min不变。可见,尽管延迟对环孢素A处理小鼠使用螺内酯,但仍改善了大鼠的存活及肾功能。Amador等[17]还发现环孢素A处理2 d后,Ctl小鼠和Endo-MR-KO小鼠的血浆尿素和肌酐有相似程度的增加。但是,平滑肌(SMC)中MR的特异性缺失则阻止了这种增加[Ctl +环孢素A和SMC-MR-KO+环孢素A:尿毒症(21.2±5)mmol/L和(8.1±0.8)mmol/L,肌酐(33.7±9.5)mmol/L和(10.4±0.6)mmol/L;P<0.05]。证实在遗传性血管平滑肌细胞MR失活的小鼠中钙调磷酸酶抑制剂(CNI)肾病得到了预防,但在血管内皮缺失时则没有。MRA可以预防或减缓CNI肾病的进展。
持续、不当的MR激活会导致肾损害[5]。蛋白尿在移植后早期仍常存在,通常是移植物损伤的标志物。与移植物存活率降低和死亡风险增加等有关[18,19,20]。此外,大量证据表明,ALD是肾损伤的危险因素之一,而CKD可被视为相对醛固酮增多症的一种状态[21]。de Sousa等[22]一项回顾性研究纳入了持续性蛋白尿>0.5 g/d,时间超过6个月以及螺内酯口服治疗的140例肾移植受者。据尿蛋白水平分为3组:低(<1 g/24 h)、中度(1~3 g/24 h)和肾病(>3 g/24 h)。在尿蛋白≥1 g/d的受者中,观察到经6个月的治疗后蛋白尿显著减少,在治疗12个月后,中度组的一半受者和肾病组的三分之一受者尿蛋白≤1 g/d。充分证实螺内酯可有效减少移植后蛋白尿,尤其适用于轻至中度移植物功能障碍且尿蛋白≥1 g/d的受者。
肾移植受者常有心血管疾病高危因素,如高血压等,对其生命构成严重威胁[5,23]。大量证据表明MRA可有效降低终末期肾病患者难治性高血压、心力衰竭等发生率,改善受者预后[24,25,26,27]。一项研究螺内酯与安慰剂,比索洛尔和多沙唑嗪联合用于确定耐药性高血压最佳疗法的随机对照试验[28]显示螺内酯降低平均收缩压疗效优于安慰剂组,优于其他两种有效疗法的平均值,以及其他每种单独的疗法。证实螺内酯是治疗顽固性高血压最有效的附加药物。肾移植受者术后早期仍常有高血压,少数为难治性高血压,因此,MRA的使用可能很好降低这类人群心血管疾病及移植肾高灌注损伤发生率,改善受者及移植物存活。
CNI可使胰岛B细胞的胰岛素分泌减少[29],因此,移植后CNI的使用则有严重的致糖尿病副作用[30]。大量研究证实ALD是糖尿病和代谢综合征的潜在危险因素[5,31]。ALD或糖皮质激素对MR的激活与脂肪细胞胰岛素敏感性受损有关。血浆游离脂肪酸升高会降低多种动物模型的胰岛素敏感性[5]。脂肪组织炎症是导致胰岛素抵抗和脂肪细胞功能异常的重要因素。MR阻断可通过减少脂肪组织炎症来影响脂肪代谢功能[30,32]。Hosoya等[33]一项验证螺内酯能否改善胰岛素抵抗的临床研究共纳入24例CKD 2~3期患者,均分两组,实验组予口服螺内酯25 mg/d处理,对照组予安慰剂处理,随访6个月后发现,实验组空腹胰岛素浓度显著降低[胰岛素变化百分比比较:(25.7±11.7)%和(51.2±7.1)%,P<0.01]。表明螺内酯可改善葡萄糖耐量并降低胰岛素抵抗,对预防2型糖尿病的发生有潜在作用。然而,当前尚缺乏MRA类药物在肾移植受者中使用的大样本临床随机对照试验,故其对预防肾移植受者新发糖尿病的有效性还有待进一步验证。
高钾血症是MRA潜在的副作用[5,34]。Bertocchio等[35]对31例接受环孢素A治疗肾功能受损的肾移植受者[估计肾小球滤过率(eGFR)=30~50 ml/(min·1.73m2)]进行研究,均口服依普利酮25 mg/d治疗8周。结果显示8例出现轻度高钾血症(>5 mmol/L),1例出现中度高钾血症(>5.5 mmol/L)并需行钾交换树脂治疗,但无严重高钾血症(>6 mmol/L)出现。由此证实在eGFR降至30 ml/(min·1.73 m2)之前,如密切监测血钾,给接受环孢素A治疗的肾移植受者使用依普利酮是安全的。此外,一项关于肾移植受者于移植术前1 d和术后连续3 d使用螺内酯的临床随机试验[9]显示,实验期间实验组(口服螺内酯25 mg/d,10例)及对照组(口服安慰剂,10例)均无血清钾>6.0 mmol/L的严重高钾病例出现,实验组也没有受者因严重高钾而停用螺内酯。研究期间,实验组的平均血清钾水平与对照组无差异。然而,因前述临床实验纳入样本量有限,MRA在肾移植受者中使用的安全性尚待进一步临床验证。
MRA类药物有潴钾而致高钾血症的风险,低剂量应用于CKD受者仍可能导致严重的高钾血症[5,35]。高钾血症的风险与eGFR降低呈反相关,当eGFR<30 ml/(min·1.73m2)时,高钾血症风险增加[35]。所以,在CKD受者及肾移植术后早期受者这类特殊人群中使用MRA时,应密切电解质监测、给予系统的饮食、药物使用建议。同时,在MRA选用上,应更倾向依普利酮,因为其半衰期短,且本身具直接药物活性[3]。
综上所述,MRA可有效预防或减轻CNI肾病及IRI,减少CKD受者蛋白尿等,所以,在肾移植受者中使用该类药物是值得进一步探索尝试的,尽管其存在高钾血症等副作用。目前,移植物的IRI尚难避免,所以,移植术前或术后短期内使用MRA可能预防或减轻近期IRI及改善远期移植物功能。而移植术后长期使用则可能有助于预防或减轻CNI肾病、保护肾功能。尚需于移植受者中行进一步大样本临床试验,在验证MRA上述"临床保护作用"的同时,进一步探究使用该类药物的肾功能安全阈值,以期在安全前提下获得最佳临床疗效。
所有作者均声明不存在利益冲突



























