
报告4例Castleman病(CD)继发肾损害病例。CD经淋巴结活检证实,肾损害经肾组织活检确诊。知网、万方、Pubmed及Medline网站上检索相关病例报道,复习119例CD继发肾损害患者的临床资料及预后。CD最常见类型为浆细胞型,最常见肾脏病理改变依次为血栓微血管病变(TMA)、淀粉样变(AA)及间质性肾炎。肾脏临床表现多为急性肾损害(AKI)、慢性肾脏病(CKD)及肾病综合征(NS)。局限型CD(UCD)治疗以手术切除为主,预后较好。多中心型CD(MCD)目前尚无统一治疗方法,最常单独用激素治疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
Castleman病(CD)又被称为巨大淋巴结病或血管滤泡性淋巴结增生症,是一种少见的慢性淋巴组织增生性疾病。目前没有其发病率的具体数值,美国多中心流行病学资料显示10年发病率为每百万人口中2.4人[1]。我们报告4例CD继发肾损害患者的临床资料及预后,并回顾性复习了119例CD继发肾损害的文献,旨在分析总结CD的临床、病理特点及预后,为其临床诊疗提供依据。
病例1 患者女,52岁,因"左侧腹股沟包块切除术后6年,再发包块1年"于2016年1月入院。6年前因左侧腹股沟肿物于当地医院全麻下行左侧腹股沟包块切除术,自诉当时病理结果为淋巴结炎。2015年1月再次发现左侧腹股沟包块,入院前9 d彩色超声检查示:双侧腹股沟淋巴结肿大,腹腔内有稍低回声团,考虑为肿大淋巴结。腹股沟淋巴结病理检查结果示:符合CD(混合型)改变。患者拒绝接受治疗,遂给予对症治疗,病情稳定后出院。2017年11月因"双下肢水肿、蛋白尿2周"入院。入院2周前劳作后出现双下肢水肿,伴双下肢、腹部瘀点,余未诉不适。当地医院检查尿蛋白(2+)。入院查体:全身散在多处皮肤瘀斑,双下肢指凹性水肿。尿蛋白量1.54 g/24 h,血尿素氮5.1 mmol/L,血肌酐78 μmol/L。肾脏穿刺活检病理结果示:毛细血管内增生性IgA肾病(IgAN)伴血栓微血管病变(TMA)。由于患者既往存在CD,考虑CD继发肾损害。明确诊断后,行CHOP方案化疗4周期,随访至6个月后,患者淋巴结缩小,尿蛋白转阴,血肌酐100 μmol/L。
病例2 患者女,32岁,因"乏力伴纳差,间断发热1个月"于2018年5月入院,当地医院查血尿素氮3.6 mmol/L,血肌酐120 μmol/L,胸部CT提示纵隔淋巴结肿大。查体:浅表淋巴结无肿大。因尿蛋白量1.41 g/24 h逐行肾脏穿刺活检术,病理结果示:TMA伴急性肾小管坏死(ATN)及基底膜节段均质增厚,伴代谢综合征肾损害改变。根据其临床表现考虑CD,但因肿大淋巴结消失,建议淋巴结复现后行淋巴结穿刺以明确诊断,给予对症治疗后出院。出院半月后患者因"发热2 d"再次入院,双侧腋窝可触及肿大淋巴结,血尿素氮8.2 mmol/L,血肌酐166.9 μmol/L,于2018年7月行淋巴结穿刺活检,病理结果示:CD(浆细胞型)。明确诊断后,行CHOP方案化疗4周期,随访至今,患者肿大淋巴结消失,肾功能恢复正常,血肌酐89 μmol/L。
病例3 患者男,39岁,因"眼睑水肿5年余,加重1年余,发现血肌酐升高10 d"于2018年11月入院。查体:眼睑水肿。血尿素氮9.40 mmol/L,血肌酐121 μmol/L。超声检查示:双侧腹股沟区淋巴结肿大;胸部CT示:两肺少许炎性反应改变。纵隔内及腋窝下淋巴结肿大。肾脏穿刺活检病理结果示:(1)伴有显著浆细胞及嗜酸性粒细胞浸润的急性肾小管间质性肾病;(2)免疫复合物介导的肾小球肾炎。淋巴结穿刺病理结果示:CD(浆细胞型)。明确诊断后,建议患者行化疗,患者拒绝治疗后出院,现已失访。
病例4 患者女,46岁,因"发现泡沫尿及双下肢指凹性水肿3个月余,左侧上肢、肩背部痛半月余"于2019年2月入院。3个月前因颈部多发淋巴结肿大于当地医院行"右颈部淋巴结清扫术",病理结果示"CD(透明血管型)"。2个月前于本院消化科诊断为"肝硬化;多浆膜腔积液;全身多处淋巴结肿大查因;肾功能不全"。查血尿素氮9.80 mmol/L,血肌酐131 μmol/L,给予对症治疗,症状好转后出院。本次入院查体:双下肢指凹性水肿。血尿素氮9.40 mmol/L,血肌酐128 μmol/L,尿蛋白量1.54 g/24 h。肾脏穿刺活检病理结果示:(1)TMA;(2)IgAN。因患者既往有CD病史,考虑为CD继发肾损害。明确诊断后给予"COP+干扰素+沙利度胺"方案化疗,已进行3周期,患者淋巴结较前缩小,尿蛋白量减少,血肌酐67 μmol/L。现仍在治疗中,有待进一步随访。
CD发病率低,其中CD继发肾损害更为罕见,约为8.5%~25.0%[2]。检索郑州大学第一附属医院2011年10月至2019年2月数据库,诊断为CD的病例共218例,其中继发肾损害仅4例。根据病理改变,CD可分为透明血管型(HV)、浆细胞型(PC)及混合型(MIX)。根据临床表现,CD可分为局限型(UCD)和多中心型(MCD)[3]。我们报告的4例均为MCD。4例淋巴结活检2例为PC,1例HV,1例MIX。肾脏穿刺活检3例为TMA(其中2例伴IgAN),1例为肾小管间质性肾炎。4例诊断为CD继发肾损害时的临床病理改变见表1,表2。

4例Castleman病继发肾损害患者临床病理改变及Castleman病分型
4例Castleman病继发肾损害患者临床病理改变及Castleman病分型
| 序号 | 肾损害表现 | CD分型 | ||
|---|---|---|---|---|
| 临床表现 | 病理改变 | 临床分型 | 病理分型 | |
| 例1 | 肾病综合征 | 毛细血管内增生性IgA肾病伴血栓微血管病变 | 多中心型 | 混合型 |
| 例2 | 急性肾损伤 | 血栓微血管病变伴急性肾小管坏死,基底膜节段均质增厚,伴代谢综合征肾损害 | 多中心型 | 浆细胞型 |
| 例3 | 慢性肾脏病 | 急性肾小管间质性肾病伴浆细胞及嗜酸性粒细胞浸润;免疫复合物介导的肾小球肾炎 | 多中心型 | 浆细胞型 |
| 例4 | 慢性肾脏病 | 血栓微血管病变;IgA肾病 | 多中心型 | 透明血管型 |
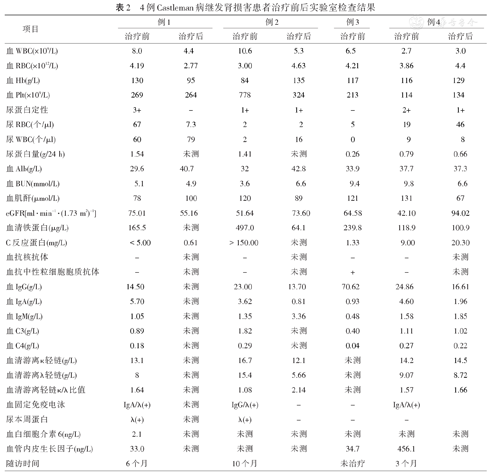
4例Castleman病继发肾损害患者治疗前后实验室检查结果
4例Castleman病继发肾损害患者治疗前后实验室检查结果
| 项目 | 例1 | 例2 | 例3 | 例4 | |||
|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗前 | 治疗后 | |
| 血WBC(×109/L) | 8.0 | 4.4 | 10.6 | 5.3 | 6.5 | 2.7 | 3.0 |
| 血RBC(×1012/L) | 4.19 | 2.77 | 3.00 | 4.63 | 4.21 | 3.86 | 4.4 |
| 血Hb(g/L) | 130 | 95 | 84 | 135 | 117 | 116 | 129 |
| 血Plt(×109/L) | 269 | 264 | 778 | 324 | 213 | 114 | 134 |
| 尿蛋白定性 | 3+ | - | 1+ | 1+ | - | 2+ | 1+ |
| 尿RBC(个/μl) | 67 | 7.3 | 2 | 2 | 5 | 19 | 46 |
| 尿WBC(个/μl) | 60 | 79 | 2 | 16 | 0 | 9 | 8 |
| 尿蛋白量(g/24 h) | 1.54 | 未测 | 1.41 | 未测 | 0.26 | 0.79 | 0.66 |
| 血Alb(g/L) | 29.6 | 40.7 | 32 | 42.8 | 33.9 | 37.7 | 37.3 |
| 血BUN(mmol/L) | 5.1 | 4.9 | 3.6 | 6.6 | 9.4 | 9.8 | 6.6 |
| 血肌酐(μmol/L) | 78 | 100 | 120 | 89 | 121 | 131 | 67 |
| eGFR[ml·min-1·(1.73 m2)-1] | 75.01 | 55.16 | 51.64 | 73.60 | 64.58 | 42.10 | 94.02 |
| 血清铁蛋白(μg/L) | 165.5 | 未测 | 497.0 | 64.1 | 239.8 | 118.9 | 100.9 |
| C反应蛋白(mg/L) | <5.00 | 0.61 | >150.00 | 未测 | 1.33 | 9.00 | 20.30 |
| 血抗核抗体 | - | 未测 | - | 未测 | - | - | 未测 |
| 血抗中性粒细胞胞质抗体 | - | 未测 | - | 未测 | + | - | 未测 |
| 血IgG(g/L) | 14.50 | 未测 | 23.00 | 13.70 | 70.62 | 24.86 | 16.61 |
| 血IgA(g/L) | 5.70 | 未测 | 3.62 | 0.81 | 0.93 | 4.60 | 1.96 |
| 血IgM(g/L) | 1.05 | 未测 | 1.35 | 3.36 | 0.48 | 1.58 | 1.85 |
| 血C3(g/L) | 0.89 | 未测 | 1.82 | 未测 | 0.40 | 1.11 | 1.02 |
| 血C4(g/L) | 0.18 | 未测 | 0.29 | 未测 | 0.04 | 0.27 | 0.22 |
| 血清游离κ轻链(g/L) | 13.1 | 未测 | 16.7 | 12.1 | 未测 | 14.2 | 14.5 |
| 血清游离λ轻链(g/L) | 8 | 未测 | 15.4 | 5.66 | 未测 | 9.07 | 8.72 |
| 血清游离轻链κ/λ比值 | 1.64 | 未测 | 1.08 | 2.14 | 未测 | 1.57 | 1.66 |
| 血固定免疫电泳 | IgA/λ(+) | 未测 | IgG/λ(+) | - | - | IgA/λ(+) | |
| 尿本周蛋白 | λ(+) | 未测 | λ(+) | - | - | - | |
| 血白细胞介素6(ng/L) | 2.1 | 未测 | 未测 | 未测 | 未测 | 未测 | 未测 |
| 血管内皮生长因子(ng/L) | 33.0 | 未测 | 未测 | 未测 | 34.7 | 456.1 | 未测 |
| 随访时间 | 6个月 | 10个月 | 未治疗 | 3个月 | |||
CD累及肾损害发病率低,现有文献多为病例报道。检索知网、万方、Pubmed及Medline数据库,排除评论性文章及综述,排除肾原发性CD病,或原有肾脏病基础上合并CD的病例。共检索病例119例,对检索病例及本文报道病例,共123例进行临床病理分析。结果显示CD发病年龄为(45.97±14.25)岁,男84例(68.29%),女39例(31.71%)。114例(92.68%)为MCD,9例(7.32%)为UCD。病理类型中59例(47.97%)为PC,34例(27.64%)HV,23例(18.70%)MIX,7例未分型。肾脏病理常见的表现依次为TMA(32例,26.02%)、淀粉样变(AA)(17例,13.82%)及间质性肾炎(13例,10.57%),与王素霞等[4]的研究结果一致。肾损害临床表现多为急性肾损伤(AKI)(30例,24.39%)、慢性肾脏病(CKD)(29例,23.58%)及肾病综合征(23例,18.70%)。
CD发病机制尚未完全清楚,目前的观点认为由于浆细胞增生使得体内炎性反应介质分泌增加,其中血管内皮生长因子(VEGF)及白细胞介素(IL)6增高分别导致TMA和肾淀粉样变[5]。VEGF通过调节血管通透性、内皮细胞迁移、细胞增殖等在血管生成发育和疾病发展中起作用。已有研究发现,CD患者淋巴结浆细胞及血清中VEGF均升高,而肾小球局部VEGF表达下降[6]。敲除大鼠足细胞VEGF基因后,肾脏VEGF表达下降,可导致TMA的发生。IL-6的增高可刺激肝脏合成AA蛋白的前体淀粉样蛋白A。淀粉样蛋白A在单核巨噬细胞作用下形成无法被降解的淀粉样蛋白,持续沉积形成淀粉样物质,导致肾淀粉样变。123例病例中,7例有血清VEGF数据,其中6例数值升高;9例有血清IL-6数据,其中8例数值升高。近年来,也有研究者提出感染人类免疫缺陷病(HIV)、人类疱疹病毒(HHV-8)及免疫系统紊乱等也可成为CD发病机制之一[7]。本文报道的4例患者中有2例继发IgAN。IgAN是国人最常见的肾小球肾炎之一,IgAN发病机制复杂,本文报告病例继发IgAN发病可能有以下几种原因:(1)例4患者既往患有"肝硬化"病史,IgAN可能继发于肝硬化。(2)CD病理改变特征为明显的淋巴滤泡、血管及浆细胞呈不同程度增生,浆细胞具有合成及贮存免疫球蛋白的功能。浆细胞增生,合成IgA增多,沉积于肾脏导致IgAN的发生。2例继发IgAN患者血清IgA均高于正常值。分析123例病例,排除未接受肾穿刺活检术及未报道肾脏免疫荧光结果的病例,34%(16/47)肾小球伴有IgA沉积,34%(16/47)伴有IgG沉积,34%(16/47)伴有C3沉积。
CD继发肾损害的治疗主要以治疗原发病为主。UCD治疗以手术切除为主,预后较好。Saghafi等[8]提出,头面部等无法全部切除的UCD可采用部分切除+激素的治疗方法。我们复习了9例UCD,4例手术切除+激素或秋水仙碱或IL-6抑制剂治疗,2例单纯手术切除,2例单纯激素治疗,1例单纯秋水仙碱治疗,全部患者均在随访期内部分或完全缓解。MCD目前尚无统一治疗方法,包括激素、抗肿瘤药物、化疗等。分析114例MCD患者治疗与预后,除10例未报道治疗方法,4例未接受治疗外,其余100例中有31例(31%)单独使用激素治疗,26例(26%)使用化疗,10例(10%)使用激素+免疫抑制剂治疗。中位随访时间为21(0.5,180)个月,87例(70.73%)病情好转,尿蛋白部分或完全缓解,19例(15.45%)病情恶化,14例疗效不明,3例仍在治疗中。5年生存率为91.06%(112/123)。值得注意的是,仅5例为CD继发新月体性肾炎,其中除1例好转外,其余4例中有3例进展至终末期肾病,1例死亡。Zhang等[9]研究表明,估算肾小球滤过率< 60 ml·min-1·(1.73 m2)-1是MCD患者死亡的独立预测因素。
综上所述,CD继发肾损害男性发病率大于女性,发病年龄跨度大,多见于浆细胞型CD,肾脏临床表现及病理类型各异。因此,确诊CD后需关注患者肾功能指标,若有异常应及时行肾脏穿刺活检术以明确诊断。同时,该病还需与单克隆免疫球蛋白病鉴别[10]。目前治疗尚无统一标准,仍需大型临床试验以确定最佳治疗方案。
所有作者均声明不存在利益冲突



























