
《多学科合作下糖尿病足防治专家共识(2020版)》是通过分析临床糖尿病足的实践过程,查询理论依据及其等级,给出的推荐意见。本共识主要阐述了糖尿病足的评估和诊断、治疗,以及高危足的保护与溃疡预防,内容涵盖内外科、护理和康复等学科,总共50条推荐意见,旨在为临床医师处理糖尿病足提供步骤和方案参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。


糖尿病足是糖尿病严重的并发症之一,患者具有较高的截肢和死亡风险,临床对其进行规范化诊治很重要,而糖尿病足指南/共识的制订和践行能有力地提高这种规范化水平。2019年,在中华医学会糖尿病学分会主任委员的指导下,由江苏省医学会主持,组织内分泌科、烧伤科、血管外科、骨科、足踝外科和心脏科等专业学者参与的《多学科合作下糖尿病足防治专家共识(2020版)》编写组成立,并邀请国内著名的创伤科专家付小兵院士,内分泌科专家冉兴无教授、许樟荣教授、刘超教授、薛耀明教授、汤正义教授,以及血管外科专家包俊敏教授作主审。本共识以国内外糖尿病足防治指南为参考,结合我国医师的临床经验和研究结果,并以实用性和可操作性为原则撰写而成。我们期待,这份由临床一线医学工作者们制订的专家共识,能给全国从事糖尿病足相关工作的医护人员带来帮助。本共识遵循推荐分级的评价、制订和评估系统分别给出推荐意见和相应理论依据(表1)。推荐程度分级考虑了利益平衡、证据质量、价值观和选择意愿以及资源配置4个关键因素。

推荐分级的评价、制订和评估系统证据等级和推荐程度
推荐分级的评价、制订和评估系统证据等级和推荐程度
| 项目与分类 | 内容 | |
|---|---|---|
| 证据等级 | ||
| 高 | 非常确信真实的效应值,接近效应估计值 | |
| 中等 | 对效应估计值有中等程度的信心,真实值有可能接近估计值,但仍存在两者大不相同的可能性 | |
| 低 | 对效应估计值确信程度有限,真实值可能与估计值大不相同 | |
| 极低 | 对效应估计值几乎没有信心,真实值很可能与估计值大不相同 | |
| 推荐程度 | ||
| 强 | 指做法好处明显大于风险,临床医师实施和人群接受可信度都高 | |
| 弱 | 指做法好处和风险相当,更依赖于特定临床情况,一般情况下,医师和患者的偏好在决策过程中起了一个更重要的作用 | |
糖尿病足是糖尿病患者由于神经病变及不同程度血管病变而导致的下肢感染、溃疡形成和/或深部组织损伤。糖尿病足溃疡(diabetic foot ulcer,DFU)病因分为神经性(约占55%)、神经缺血性(约占35%)、单纯缺血性(仅占10%)。全球糖尿病足流行病学研究显示,DFU患病率为5%~10%、发病率为6.3%(95%置信区间=5.4%~7.3%)、年发病率为1%~4%;其中,中国的DFU发病率为4.1%(95%置信区间=3.1%~5.2%),是糖尿病患者最常见的住院原因[1]。糖尿病足危害众多,不仅会导致患者生活质量下降、病死率增加,更是截肢的最主要原因,同时给社会带来沉重的经济负担[2,3]。
糖尿病足患者不仅存在感染、神经和血管问题,也可能存在软组织和骨愈合困难问题,尤其是足病病程长和糖化血红蛋白>7%的患者问题更大。评估时应尽可能全面,尤其应以感染、下肢血管病变情况、术前风险分层和治疗风险评估等为重点。
推荐1:针对所有糖尿病足患者,进行全面医学评估,尤其是心、脑、肾等重要脏器功能及其危险因素,以及下肢病变情况的评估(推荐程度为强,证据等级为低)。
理论依据:全面评估和早期干预有助于发现糖尿病足的高危患者并减少其住院和截肢的可能性,也有助于糖尿病足患者的诊疗过程和获得良好预后,并降低治疗过程中的各种风险。虽然证据等级较低,本共识强烈建议从病史(表2)、下肢体格检查(表3)以及检验和检查3个方面对患者进行全面医学评估。

糖尿病足患者病史采集内容
糖尿病足患者病史采集内容
| 项目 | 内容 |
|---|---|
| 全身病史 | 职业需求,糖尿病家族史,既往住院史,手术史,药物过敏史,麻醉药不良反应史,营养情况,生活质量,吸烟、酒精和抑郁,糖尿病病程,目前正在使用的药物,血糖情况,糖尿病并发症,糖尿病合并症,其他系统性疾病情况,患者依从性,处理医师 |
| 足部总体病史 | 既往足病史,足部疾病诊治史,穿鞋习惯,足部保暖情况,机械或化学物品接触史,下肢针刺感或疼痛史,腿近端肌肉萎缩、无力史,足部畸形史,足部异常压力、胼胝史,关节活动度缺失史,跛行或静息痛史,双侧或单侧水肿史 |
| 足溃疡病史 | 诱因-刺激性时间、外伤,病程,复发情况,部位,溃疡处理情况,溃疡范围(长、宽、深)变化情况,对溃疡愈合的干扰(家庭和社会),足底减压技术使用情况 |
注:足部总体病史和足溃疡病史均属足踝专科病史

糖尿病足患者下肢体格检查内容
糖尿病足患者下肢体格检查内容
| 项目 | 内容 |
|---|---|
| 皮肤检查 | 颜色、弹性和湿润程度、毛发生长情况、皲裂 |
| 趾甲萎缩或增生 | |
| 胼胝及胼胝下出血 | |
| 溃疡(位置、大小、深度、程度等)、坏疽 | |
| 其他糖尿病相关皮肤改变:足癣(真菌感染)、甲沟炎(细菌感染)、瘙痒挠痕(酵母菌感染);小血管变化,浅棕色、鳞片斑块(糖尿病性皮肤病);糖尿病性脂肪变性、大疱病;发疹性黄瘤病、远端硬化病、播散性环状肉芽肿;过敏反应 | |
| 血管检查 | 无毛发生长、趾甲营养不良,皮肤变薄(羊皮纸样外观)、发绀/红斑以及体位性色泽改变(肢体抬高及下垂试验) |
| 温度梯度(同侧上下、两侧对比) | |
| 腹部动脉到足背动脉听诊、股动脉到足背动脉触诊 | |
| 手提式多普勒超声检查 | |
| 神经肌肉及骨骼系统检查 | 振动觉测定:128 Hz音叉检查和振动觉阈值测定(使用生物振感阈值测量器) |
| 浅压力觉测定:10 g单丝检查 | |
| 浅触觉测定:棉絮和羊毛测试、两点辨别觉测定 | |
| 痛觉测定:钝针头(无菌针头)测试 | |
| 温度觉测定:冷和热测定 | |
| 深肌腱反射测定:负重与不负重,髌反射和跟腱反射,踝阵挛和髌阵挛,巴宾斯基征,Romberg征(闭目难立征) | |
| 生物力学检查:结构畸形,指自发性肌肉萎缩,足下垂、跟腱挛缩/马蹄足,锤状趾、滑囊炎、小趾滑囊炎,拇趾关节骨性关节炎/僵拇,平足或足弓弯曲度过高,夏科关节病,手术造成畸形;下肢关节活动受限;足底高压力区形成评估,指胼胝、鸡眼、皮肤压红等表现 |
检验和检查。(1)检验情况。①根据血糖、血红蛋白、血浆白蛋白和前白蛋白、血脂等指数判断营养状态。②根据肝肾功能、电解质、乳酸、血气分析、心房利钠尿多肽、心肌酶谱等情况判断脏器功能和内环境稳态。③根据血小板、凝血酶原时间、国际标准化比值(INR,口服抗凝剂时,为正常对照1~2倍最佳)、活化部分凝血活酶时间(APTT)等判断凝血功能。④根据血常规、红细胞沉降率(ESR)、C反应蛋白、降钙素原、血微生物培养和组织病原学检查判断感染情况。临床医师在对这些实验室结果进行解读时,需要小心谨慎,比如足病感染极其严重时,血白细胞计数可能并不升高。(2)辅助检查。静息时心电图检查对心脏功能的评估价值有限,高危患者群体需要行24 h动态心电图、超声心动图检查,必要时需行冠脉血管造影[4]、下肢血管和神经检查、足部影像学检查、足底压力测定[5]、创面组织病理学检查。
推荐2:DFI是基于局部或全身炎症症状和体征的临床诊断(推荐程度为强,证据等级为中等)。
推荐2.1:若临床检查无法界定或解释,考虑将炎症血清生物标志物,如C反应蛋白、ESR、降钙素原等作为辅助诊断用于DFI诊断(推荐程度为强,证据等级为低)。
推荐2.2:几乎所有临床感染的溃疡,都要收集其组织标本进行微生物培养以确定致病菌(推荐程度为强,证据等级为中等)。
理论依据:糖尿病足患者出现发热、畏寒、精神错乱、意识不清、呕吐、出汗、厌食、血流动力学不稳定(如心动过速、低血压)和代谢紊乱(如酸中毒、糖脂代谢障碍、电解质紊乱、氮质血症加剧)以及白细胞增多、白细胞分类左移、炎症标志物(如ESR、C反应蛋白)升高、降钙素原升高等临床表现,不仅提示急性感染存在,还有助于深部组织感染的判断,同时也可用作疗效的动态判断依据[6]。最新国际糖尿病足工作组(IWGDF)指南论述了炎症血清生物标志物在DFI诊断中的作用,认为白细胞与感染严重程度的相关性很小,大约一半被诊断为DFI患者白细胞计数正常;ESR的感染诊断价值较高,尤其是当ESR≥70 mm/h时,骨感染存在可能性大;而C反应蛋白和降钙素原的感染诊断准确率更高,与ESR相比,C反应蛋白水平在感染时上升更快,并随着感染的控制而快速下降[7]。细菌培养时注意以下几点:(1)在抗生素使用之前留取标本。(2)首选深部组织标本,而不是拭子标本。(3)需进行厌氧菌和需氧菌培养及药物敏感试验。(4)无论有无发热症状,每例患者都要做2次血微生物培养和尿微生物培养。老年人或严重衰竭患者群常无发热反应。(5)不推荐将分子微生物学技术、电子测量足底温度和微生物定量分析作为一线鉴定病原体的方法。(6)培养结果的准确性有赖于临床和检验医师在处理样本过程(包括收集、转运以及培养)中提供的信息质量,2019年IWGDF指南对此进行了强调。因此,本共识建议,DFI是基于局部或全身炎症症状和体征的临床诊断,炎症指标作为辅助诊断,组织微生物培养确定致病菌。
推荐3:存在深或大溃疡、骨突出部位溃疡或慢性不愈合溃疡等征象时,应高度怀疑骨髓炎可能,需要进一步做骨探针、X线和磁共振成像(MRI)等检查(推荐程度为强,证据等级为中等)。
理论依据:糖尿病足骨髓炎(diabetic foot osteomyelitis,DFO)通常是由软组织溃疡直接感染引起的,细菌穿透皮质骨进入骨髓腔,增加了截肢风险。临床医师在面对伴任何感染、深或大溃疡,尤其是局部红肿热、皮下硬结、溃疡在骨突出部位、骨探针检查阳性等情况的糖尿病足时,应该考虑其合并DFO的可能性[8]。DFO诊断标准如下:(1)骨暴露,敏感度38%~87%、特异度85%~91%。(2)溃疡面积>2 cm2,敏感度56%、特异度92%。(3)溃疡深度>3 mm,敏感度74%、特异度77%。(4)ESR>70 mm/h,敏感度90%、特异度100%。(5)碱性磷酸酶>135 U/L,特异度100%。(6)"香肠趾"即红肿趾外观溃疡。
推荐3.1:在所有DFI患者中,建议进行足部X线检查,以确定骨异常(畸形、破坏)、软组织气体和异物(推荐程度为强,证据等级为中等)。
理论依据:X线用于检查DFO时,表现为渗透性放射性反应、骨膜反应和骨矿物质丢失等;但其敏感度和特异度均较低(分别约54%和68%),常不能有效鉴别DFO和有骨破坏的神经骨关节病变(夏科关节病);单次X线检查很难得出DFO诊断,建议至少间隔2周就复查[9]。
推荐3.2:对怀疑有软组织脓肿者或DFO诊断尚不确定时,推荐使用MRI作为评估手段(推荐程度为强,证据等级为低);对怀疑DFO而又不能行MRI检查者,建议行骨扫描结合白细胞闪烁成像或抗粒细胞扫描(推荐程度为弱,证据等级为低)。
理论依据:MRI是DFO诊断时首选的、也是最好的高级成像方式。MRI有典型的水肿信号,即T1加权相低信号和T2加权相高信号,提示DFO活跃期;T1加权相和T2加权相信号强度均降低,提示DFO静止期。MRI诊断DFO的敏感度为90%,优于X线、锝(99Tc)骨扫描和白细胞闪烁成像[10],但必须考虑相关疾病鉴别诊断。
核医学扫描(nuclear medicine scan,NMS)用于DFO诊断具有一定价值,尤其是在MRI检查禁忌的情况下,直接闪烁成像与二维结果图像可以同各种放射性核素组合使用,可增加DFO诊断的准确性[8]。NMS提示DFO征象为延迟图像中的高灌注、充血和骨吸收等[11]。NMS用于DFO诊断,敏感度较高、特异度相对较低。使用锝(99Tc)或铟(111I)进行传统的三相骨扫描,敏感度可达94%,但特异度仅为33%。将锝(99Tc)标记抗菌肽泛素(29-41)扫描与三相骨扫描结合起来,对急性感染诊断的特异度可以提高到80%~90%[12]。
推荐3.3:骨活检及骨组织细菌培养是DFO诊断金标准(推荐程度为强,证据等级为高)。
理论依据:DFO的诊断是基于细菌的分离、骨坏死的发现和炎性细胞浸润的组织病理学分析。骨活检在无菌条件下进行,可在手术清创时,也可在荧光透视下或CT引导下经皮穿刺完成,是诊断DFO的金标准[8],但下肢缺血患者应避免行骨活检[13]。
推荐4:DFI严重程度判断,建议用IWGDF/美国感染病学会(IDSA)的相关标准(推荐程度为强,证据等级为中等);脓毒症诊断标准,建议采用中华危重症医学分会的相关指南(推荐程度为强,证据等级为中等)。
理论依据:在过去10年内,大多数使用2004年首次出版的IWGDF/IDSA的相关标准判断DFI的严重程度。2014年IWGDF/IDSA DFI分级标准更新如下:(1)无感染。缺乏化脓或炎症。(2)轻度感染。局限皮肤/皮下,周围红斑直径<2 cm,少于2个炎症征象。(3)中度感染。肌肉关节骨骼受累或淋巴管炎、蜂窝织炎直径>2 cm或坏疽。(4)重度感染。全身性脓毒症或代谢不稳定,低血压、心动过速、严重不可解释的高血糖,威胁肢体的感染超过50%无系统症状或体征。
脓毒症诊断标准采用2014年中华危重症医学会发表的中国严重脓毒症/脓毒性休克治疗指南,明确或可疑感染具备以下临床特点:(1)一般临床特征。①发热,体温>38.3 ℃。②低体温,体温<36 ℃。③心率>90次/min或大于不同年龄正常值的2个标准差。④气促。⑤精神状态的改变。⑥明显水肿或液体正平衡(24 h超过20 mL/kg)。⑦高血糖症,血糖>7.7 mmol/L且无糖尿病史。(2)炎症反应指标。①白细胞增多,白细胞计数>12×109/L。②白细胞减少,白细胞计数<4×109/L。③白细胞计数正常但幼稚白细胞总数超过10%。④血浆C反应蛋白大于正常值的2个标准差。⑤血浆降钙素原大于正常值的2个标准差。(3)血流动力学改变。低血压、收缩压<90 mmHg(1 mmHg=0.133 kPa)、平均动脉压<70 mmHg或成人收缩压下降超过40 mmHg或低于年龄段正常值的2个标准差。(4)器官功能障碍指标。①动脉低氧血症,PaO2/吸氧浓度分数<300 mmHg。②急性少尿,即使给予足够液体复苏,尿量仍然<0.5 mL·kg-1·h-1且至少持续2 h。③血肌酐上升>44.2 μmol/L。④凝血功能异常,INR>1.5或APTT>60 s。⑤肠梗阻(肠鸣音消失)。⑥血小板减少,血小板计数<100×109/L。⑦高胆红素血症,血浆总胆红素>70 μmol/L。(5)组织灌注指标。①高乳酸血症,血乳酸水平>1 mmol/L。②毛细血管再灌注能力降低或淤斑形成。
推荐5:所有糖尿病患者(即使无DFU存在),至少每年通过病史采集和足脉搏触诊检查1次外周动脉;年龄>50岁或既往有DFU史、心脑血管粥样硬化史、下肢血管检查异常史、血管介入或搭桥手术史等任何一种情况,至少每1~3个月检查1次(推荐程度为强,证据等级为低)。
理论依据:PAD是发生糖尿病足病的独立危险因素,可导致下肢溃疡愈合延迟,也可直接导致患者下肢缺血、坏死[14]。糖尿病患者PAD患病率随着年龄、糖尿病病程增加而升高,踝肱指数<0.9是PAD的诊断标准。间歇性跛行、足部凉且皮肤苍白或暗红、触诊足背动脉/胫后动脉消失、Buerger试验阳性,听诊器或超声提示动脉搏动低弱甚至消失、伴杂音、静脉充盈时间减慢等是PAD的典型临床表现。外周动脉检查频率中,PAD存在时至少每6~12个月检查1次;合并肢体保护性感觉缺失或足畸形时,每3~6个月检查1次;合并有足溃疡史、下肢截肢/截趾史、终末期肾病等足溃疡高危情况时,每1~3个月检查1次;年龄>50岁,既往有DFU史、心脑血管粥样硬化史、下肢血管检查异常史、血管介入或搭桥手术史等任何一种情况,至少每1~3个月检查1次,甚至更频繁。
推荐6:踝肱指数是目前评价PAD的首选检查项目,结合趾肱指数、足背或胫后动脉的多普勒波形、经皮氧分压(transcutaneous oxygen partial pressure,TcPO2)等能提高下肢缺血诊断的准确率(推荐程度为强,证据等级为中等)。
理论依据:踝肱指数是一种可重复开展的无创功能性检查,诊断糖尿病PAD的敏感度和特异度可分别达68%~84%和84%~99%[15]。踝肱指数正常参考值为0.90~1.30,踝肱指数>1.30提示动脉壁钙化[16],尤其是在糖尿病和慢性肾衰群体中,踝肱指数≥0.5且<0.9提示动脉狭窄;踝肱指数≥0.3且<0.5表明严重动脉狭窄;踝肱指数<0.3则提示严重下肢缺血,有发生坏疽风险。若踝肱指数检查提示血管异常病变,有条件的单位可进一步行下肢CT血管造影(CTA)、磁共振血管造影(magnetic resonance angiography,MRA)或动脉内数字减影血管造影(digital subtraction angiography,DSA)检查以指导下一步血运重建治疗。
趾肱指数目前被看作评估真实动脉灌注的首选指标,与足趾远端动脉不易钙化有关。通常认为趾肱指数≥0.7表示正常,趾肱指数≥0.2且<0.7表示动脉闭塞有间歇性跛行可能,趾肱指数<0.2表示可能出现静息痛;趾压<55 mmHg提示伤口愈合不良[17]。在踝肱指数<1.3的情况下,与踝肱指数比较,趾肱指数优势不明显;但在踝肱指数≥1.3的情况下(提示钙化),趾肱指数明显优于踝肱指数[18]。
TcPO2是反映皮肤灌注的一种测量指标,不受内侧动脉钙化的影响。TcPO2不同于踝肱指数,前者能有效预测糖尿病足预后[19],且评估PAD的敏感度和特异度也优于后者[20]。
目前无单项PAD检查方法被证明是最佳的,尤其是无明确阈值能说明下肢血管正常,通常认为踝肱指数0.90~1.30、趾肱指数≥0.75和足背动脉三相多普勒波形时,PAD可能性较小。DFU合并PAD患者以下任何一项指标存在都预示溃疡愈合率上升至少25%[7]:皮肤灌注压力≥40 mmHg、趾压≥30 mmHg或TcPO2≥25 mmHg。因此,本共识建议,以踝肱指数为评价PAD的首选检查,结合趾肱指数、足背或胫后动脉的多普勒波形、TcPO2等提高下肢缺血诊断的准确率。
推荐7:在无创检查提示存在缺血且临床考虑行下肢血管重建术治疗的情况下,需要根据病情适当选择进一步的检查(推荐程度为强,证据等级为中等)。
理论依据:彩色双相超声(CDU),也被称为诊断性超声或诊断性医学超声,是一种成像方法,使用手持传感器将1~30 MHz高频声波导入血管去评估其结构和功能。B型、连续波、脉冲波多普勒和二维超声用于评估血管系统。CDU的优点是低功率声波对人体无害;不足是因声音不能很好地通过空气或骨骼传播,对含有气体或被骨骼隐藏部位(如肺部或头部)的成像效果不佳。
CTA是借助多探测器的CT,在高速下能覆盖大面积解剖范围同时保持高分辨率,可提供下肢动脉病变数量、长度、狭窄直径和形态、相邻正常动脉口径、钙化程度和远端径流血管的状态,允许在手术路径、球囊选择和介入后预期的长期通畅方面进行精确的术前规划;同时能对侧支血管的状态进行很好评估,也能很好显示动脉闭塞情况。双能CTA可以提高糖尿病患者PAD的诊断准确性。CTA的优点是可显示从肾动脉到足部的血管网,不足是严重钙化可能妨碍较小动脉评估、潜在过敏反应和造影剂性肾病。
MRA不需要动脉穿刺,被认为是一种侵入性较低、可接受度更高的检查。数据表明,MRA对腹股沟下狭窄闭塞具有极好的敏感度和特异度(总体分别可达94.7%和95.6%),对膝下血管的敏感度和特异度也能达92.2%和93.3%,且比DSA更容易识别远端血管[21],但MRA对糖尿病患者血管疾病(尤其是膝下血管疾病)诊断的准确性尚不清楚。目前MRA多是用钆作造影剂,可获得从腹主动脉到足部的图像。值得注意的是,为规避造影剂的不良作用又取得高质量的图像,包括静态间隔单次激发MRA在内的许多非增强MRA方案正日益被用于判断PAD并取得良好效果。
DSA是一种侵入性技术,常在股动脉穿刺后注射造影剂,获得最高空间分辨率和图像质量,也是唯一能同时用于诊断和治疗动脉疾病的方法,是检测和评价PAD的金标准[22]。DSA是动脉成像的金标准,允许在同一过程中进行血管内治疗;不足是使用碘造影剂、为侵入性手术、潜在动脉穿刺并发症,有时会引起过敏反应。
总之,应获得下肢动脉的解剖信息以评估动脉狭窄或闭塞的存在、严重程度和分布,在糖尿病足患者中,获得详细的膝关节以下和足部动脉成像(特别是对足部循环进行专门评估)至关重要。
神经病变是糖尿病最常见的慢性并发症之一,其最常见的类型是糖尿病周围神经病变(DPN),主要临床表现分为阳性症状和阴性症状,阳性症状包括主观感觉异常,如刺痛、痛觉过敏、烧灼痛、蚁走感;阴性症状则通常需要临床客观检查才能被发现,包括感觉功能减退、麻木、下肢肌萎缩等。DPN导致保护性感觉丧失(loss of protective sensation,LOPS)是引起DFU的重要原因。
推荐8:使用包括10 g单丝压力觉和其他测试(振动觉、针刺痛觉和温度觉、跟腱反射测试)评估DPN(推荐程度为强,证据等级为中等)。
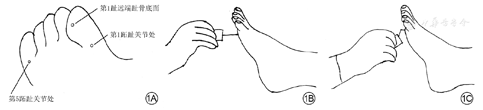
理论依据:周围感觉神经评估,应包括10 g单丝压力觉和其他测试(振动觉、跟腱反射、针刺痛觉和温度觉测试)。首先,推荐行压力觉Semmes-Weinstein测试,即10 g尼龙丝测定,常用质量为5.07 g的单丝。具体步骤如下。(1)于安静轻松环境中,患者仰卧位、闭目。(2)运用单丝触及患者手或臂肘或额头,使患者感受什么是压力。(3)测试至少双足底第1和第5跖趾关节处、第1趾远端趾骨底面这3个部位(图1A),避开溃疡部位、胼胝、瘢痕或坏死组织处。(4)单丝垂直于皮肤表面(图1B),运用足够力量使纤维弯曲成"C"形(图1C),接触皮肤持续1 s(接近、皮肤接触、单丝移除总时间不超过2 s),同一部位测试3次(至少有1次无尼龙丝放置,即假应用),询问患者是否感觉到压力、压力的位置。结果判断中,糖尿病患者足底某一部位3次测试中2次及以上能正确回答,说明保护性感觉正常;3次测试中2次及以上不能正确回答,说明保护性感觉异常,患者处于足溃疡危险中。

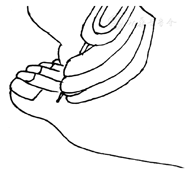
振动觉,常用128 Hz音叉来评估。具体步骤:(1)于安静轻松环境中,患者仰卧位、闭目。(2)把音叉放在患者的手腕或肘部、锁骨,让患者知道振动感觉。(3)音叉垂直于皮肤,放置在第1趾远端趾骨的背面(图2),测试3次(至少有1次放置的是无振动音叉,即假应用),询问患者是否感觉到振动、振动的位置。结果判断:3次测试中至少2次正确,说明患者振动觉正常;2次或以上不正确,说明患者振动觉异常,存在足溃疡风险。如果患者无法感受到大拇趾振动,还需要在踝、胫骨粗隆处重复检查。

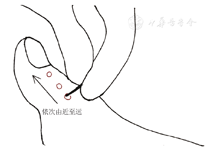
痛觉,常用一次性40 g压力针头或大头针来评估。具体步骤:(1)于安静轻松环境中,患者仰卧位、闭目。(2)用压力针头或大头针轻压患者颈部、手腕内侧或膝盖内侧,使患者感受什么是痛觉。(3)将压力针头或大头针置于患者拇趾背侧表面,由近端向趾甲移动;压力是正好让皮肤变形时的力度;询问有无疼痛及疼痛程度,以评判对疼痛的感觉(图3)。结果判断:根据患者对不同部位疼痛的描述来判断患者是否痛觉异常,主要包括痛觉过敏、正常、减弱、消失。

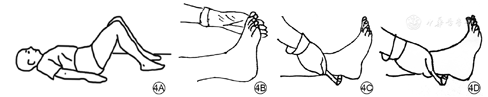
跟腱反射,常用叩诊锤来评估。具体步骤:患者仰卧位,膝关节屈曲并外展,检查者把持患者足尖并使稍背屈,叩击跟腱;或者患者跪于椅子上,两足悬空,检查者用左手把持使足轻度背屈而叩击跟腱;或患者坐位,两足悬垂,使患者足轻度背屈而叩击跟腱。结果判断:正常反应为腓肠肌收缩、足向跖面屈曲(图4),在静息或加强力度的情况下跟腱反射均缺失被认为跟腱反射异常。

温度觉,常用Tip-Therm凉温觉检查器来评估。具体步骤:(1)于安静轻松环境中,患者仰卧位、闭目。(2)将Tip-Therm凉温觉检查器置于患者手背,让患者知道什么是凉温觉。(3)分别将凉(5~10 ℃)、温(35~45 ℃)感觉检查器尖端置于患者足背皮肤,询问患者感觉。结果判断:根据患者足背部皮肤对温度的感受来判断患者温度觉是否异常,主要包括正常、减弱、消失。
还有一种更简单的评估压力觉的方法,叫作伊普斯威奇触摸测试(Ipswich Touch Test),由雷曼团队在伊普斯威奇医院设计。具体步骤:解释过程并确保患者理解,指导受试者闭上眼睛,感到触摸时说"是";检查者用示指指尖轻抚患者双足第1、3和5趾趾尖,持续1~2 s。这种新型筛查方法与10 g单丝法检查压力觉的结果几乎完全一致(k=0.88,P<0.001)[23],由非医疗从业者评估时,敏感度达78.3%、特异度达93.9%[24]。
总之,本共识建议通过压力觉、振动觉、痛觉、跟腱反射、温度觉测试来评估DPN。
推荐9:DPN的诊断标准大致参照《中国2型糖尿病防治指南》和美国糖尿病学会(ADA)立场声明[25,26](推荐程度为弱,证据等级为中等),具体如下。(1)明确的糖尿病病史。(2)绝大多数均为诊断糖尿病时或之后出现的神经病变,然而在糖尿病前期,也可以出现早期DPN[27]。(3)临床症状和体征与DPN的表现相符,部分患者可没有DPN症状。(4)有疼痛、麻木、感觉异常等临床症状者,跟腱反射、痛觉、振动觉、压力觉、温度觉5项检查中任意一项异常;无临床症状者,前述5项检查中任意2项异常。(5)排除其他病因引起的神经病变,当具有症状不对称、非长度依赖性表现、以运动神经功能受累为主、急性或亚急性起病、明显的自主神经受累[28]等临床表现时,尤其需要注意鉴别诊断,必要时请神经科医师协助诊断。
推荐10:对全面评估后的糖尿病足人群,按照一定的诊断依据和诊断流程进行诊断和鉴别诊断(推荐程度为强,证据等级为低)。
本编写组根据指南性文献和各成员的临床经验,制订了相应的糖尿病足诊断流程(图5)。


推荐11:当糖尿病患者的足溃疡出现在不常分布部位、不典型外观或对常规治疗反应不佳时,需要进行鉴别诊断(推荐程度为强,证据等级为中等)。
理论依据:下肢溃疡发生的病因有很多,不同类型溃疡的病因和临床表现见表4。

不同类型下肢溃疡的病因和临床表现
不同类型下肢溃疡的病因和临床表现
| 溃疡类型 | 高危因素 | 下肢改变 | 溃疡部位 |
|---|---|---|---|
| 静脉性溃疡 | 静脉瓣功能不全、深部静脉血栓病史、长时间站立、怀孕、运动量少、肥胖、家族史 | 水肿、色素沉着、表浅静脉曲张、皮肤鳞状干性脱皮或湿疹皮炎(淤积性皮炎),淋巴水肿 | 内踝区(足靴区):内踝、胫前骨、下肢下1/3部位 |
| 动脉性溃疡 | 胆固醇高、动脉硬化、高血压、糖尿病、老龄、吸烟、血栓闭塞性脉管炎、动静脉瘘 | 腿毛少,趾甲变厚,皮肤颜色苍白,皮肤干燥、薄、发亮,断断续续的跛行,外周动脉搏动减弱/消失,毛细血管再灌注时间延长(>4 s),腿部抬高45°维持1 min后皮肤变苍白 | 受压部位或肢端(趾):趾尖部位、趾骨头部位、外踝或跖骨 |
| 神经性溃疡 | 糖尿病、周围神经损伤等 | 感觉功能障碍、足部畸形 | 受压部位 |
| 溃疡类型 | 溃疡特点 | 溃疡周围皮肤 | 疼痛 | 脉搏 |
|---|---|---|---|---|
| 静脉性溃疡 | 范围大、边缘不整齐,溃疡较浅,创面常见红色肉芽组织,坏死组织少、渗液多 | 由含铁血黄素所致的色素沉着(重),脂肪皮肤硬化症 | 不明显或中度疼痛,抬高下肢时疼痛减轻 | 正常脉搏,皮温缓和 |
| 动脉性溃疡 | 范围小、边界清楚,溃疡深,基底部苍白,黑色坏死组织、渗液少 | 皮肤光亮、萎缩,其上毛发脱失;色素沉着轻 | 疼痛感非常明显,常在休息时或放低下肢时疼痛减轻 | 下肢脉搏减弱或消失,皮肤冰凉 |
| 神经性溃疡 | "钻孔样" | 厚的胼胝 | 无 | 动脉搏动检查不可靠 |
DFU出现在不常分布部位、具有不典型外观或对常规治疗反应不佳(超过6周)时,需要进行鉴别诊断。除常见疾病原因外,特别要注意以下几类。(1)动脉高压性溃疡,即缺血性皮下动脉粥样硬化,这种缺血也会导致溃疡坏死发生,包括远端Martorell溃疡、近端非尿毒症钙化性溃疡、肾功能不全的远端和近端钙化性溃疡[29];DFU合并动脉高压临床也常见,容易被误诊为坏疽性脓皮病。(2)动静脉混合性溃疡,临床是典型静脉性溃疡表现,但周围组织和基底部组织变黑,需要动脉血管重建术联合浅静脉回流手术治疗。(3)非过度角化溃疡,不是糖尿病足常见的神经性病变所致,要引起重视,诊断时应行病理检查。(4)脂质渐进性坏死性溃疡,是一种罕见的非感染性肉芽肿性皮肤病,能影响胰岛素抵抗型糖尿病患者的皮肤,也可见于类风湿性关节炎等非糖尿病患者,最常见部位在小腿胫前[30]。(5)癌性溃疡,最常见的为鳞状细胞癌或基底细胞癌,可以是原发性或转移性,也可以是慢性良性溃疡恶变而来的Marjolin溃疡。
推荐12:糖尿病足的分类和分级方法很多,各有利弊;TEXAS创面分类系统兼顾病因和病变程度并已得到验证,建议用于临床(推荐程度为强,证据等级为中等)。
理论依据:目前存在的分级和分类系统有很多,其实用性和科学性各不相同,无法判断谁更好,临床应根据需要进行相应选择。最新出版的IWGDF指南,推荐卫生专业人员之间交流用SINBAD(site-ischemia-neuropathy-bacterial infection-area-depth,部位-缺血-神经病变-细菌感染-面积-深度)分类系统、感染评估用IWGDF/IDSA分类、灌注和血运重建评估用WIFI(wound-ischemia-foot infection,创面-缺血-足部感染)分级法。
TEXAS创面分类系统是根据深度、感染、血管状态提出的一种糖尿病足分类方法,查询表见表5。研究显示,当创面的TEXAS创面分类系统分级(深度)和分期(病因)高时,截肢率有上升趋势[31],且TEXAS创面分类系统似乎较Wagner分级系统更适用[32]。因此,本共识建议根据需要选择不同的分类及分级方法,其中TEXAS创面分类系统兼顾病因和病变程度并已得到验证,建议用于临床。
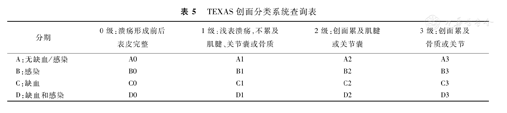
TEXAS创面分类系统查询表
TEXAS创面分类系统查询表
| 分期 | 0级:溃疡形成前后表皮完整 | 1级:浅表溃疡,不累及肌腱、关节囊或骨质 | 2级:创面累及肌腱或关节囊 | 3级:创面累及骨质或关节 |
|---|---|---|---|---|
| A:无缺血/感染 | A0 | A1 | A2 | A3 |
| B:感染 | B0 | B1 | B2 | B3 |
| C:缺血 | C0 | C1 | C2 | C3 |
| D:缺血和感染 | D0 | D1 | D2 | D3 |
推荐13:建议手术前评估糖尿病足患者的深静脉血栓(DVT)、出血、压疮和麻醉风险,以提高其手术安全性(推荐程度为强,证据等级为中等)。
理论依据:糖尿病足患者出血风险增加,迄今未有专门针对糖尿病足患者出血风险的评估方法,需要综合病史、临床症状、体征、血常规、出凝血功能、血栓弹力图等综合判断。
医院获得性压疮(hospital-acquired pressure ulcers,HAPU)预防仍然是一项重要的临床挑战。糖尿病足患者在被迫卧床期间,要注意防止对侧足出现HAPU。受到围手术期手术/麻醉影响,HAPU患病率与手术类型和手术时间有关。目前无专门针对糖尿病足患者HAPU风险的评估方法,可借鉴1987年制订的Braden量表(总分23分,≤9分提示极度高危,10~12分提示高度风险,13~14分提示中度风险,15~18分提示低度风险),其敏感度和特异度在70%~80%。
糖尿病足患者术前需进行麻醉风险评估,并结合手术方式、大小和时长来选择合适的麻醉方法。(1)首选周围神经阻滞(peripheral nerve block,PNB)麻醉,已有研究验证了PNB麻醉的安全性和操作流程[33],该方法是糖尿病患者下肢手术麻醉的首选[34],见图6。(2)不推荐硬膜外麻醉,虽然其对血糖影响很小,但会抑制儿茶酚胺释放,阻碍手术应激性高血糖的发生;因韧带钙化、骨质增生以及椎间隙变窄等问题存在,又使得椎管内麻醉穿刺成功率降低、出血和神经损伤风险增加;也易出现低血压,甚至可诱发心脑血管意外[35]。(3)目前未有专门针对糖尿病足患者的麻醉风险表单,自1941年定义后,经过多次修订趋向合理的、根据患者术前状态进行分类的美国麻醉医师学会的身体状况分类系统值得借鉴,可将其作为围手术期麻醉意外发病率和病死率的独立预测因子[36]。

注:麻醉针指示麻醉剂注射部位
(未完待续)
顾问:付小兵(解放军总医院第四医学中心)、冉兴无(四川大学华西医院)、许樟荣(战略支援部队特色医学中心)、刘超(江苏省中西医结合医院)、薛耀明(南方医科大学南方医院)、汤正义(上海交通大学医学院附属瑞金医院)、包俊敏(海军军医大学附属长海医院)
组长:胡寅(江苏省医学会)
专家组成员(单位名称以拼音排序、姓名以姓氏笔画排序):东部战区空军医院王爱萍、李一卉、陆萌、陈约东、陈金安,江南大学附属医院(无锡市第三人民医院)吕国忠、储国平,江苏省人民医院马向华、张浩、蒋琳,江苏省医学会冯玮,江苏省中西医结合医院郑仁东,南京鼓楼医院朱大龙、王炜,南京市第一医院杨蓊勃、桂鉴超、蒋逸秋,苏州大学第二附属医院胡吉,苏州大学附属第一医院成兴波,新加坡国立大学Johnson Boey,徐州市中心医院耿厚法,中国疾病预防控制中心王文绢
执笔:王爱萍(东部战区空军医院)、吕国忠[江南大学附属医院(无锡市第三人民医院)]、成兴波(苏州大学附属第一医院)、马向华(江苏省人民医院)、冯玮(江苏省医学会)
所有编写组成员均声明不存在利益冲突,无商业组织向本共识编写组支付费用



























