
《多学科合作下糖尿病足防治专家共识(2020版)》是通过分析临床糖尿病足的实践过程,查询理论依据及其等级,给出的推荐意见。本共识主要阐述了糖尿病足的评估和诊断、治疗,以及高危足的保护与溃疡预防,内容涵盖内外科、护理和康复等学科,总共50条推荐意见,旨在为临床医师处理糖尿病足提供步骤和方案参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
糖尿病足是糖尿病严重的并发症之一,患者具有较高的截肢和死亡风险,临床对其进行规范化诊治很重要,而糖尿病足指南/共识的制订和践行能有力地提高这种规范化。2019年国际糖尿病足工作组(International Working Group on the Diabetic Foot,IWGDF)历时多年组织多个国家多个学科的专家反复讨论,出版了糖尿病足诊疗规范《IWGDF 2019年糖尿病足病防治指南》[1];中华医学会糖尿病学分会(Chinese Diabetes Society, CDS)也首次发布了《中国糖尿病足防治指南(2019版)》[2]。两者各有侧重,前者围绕临床问题以患者-干预-比较-结果(Patient-Interference-Comparison-Outcome, PICO)格式、系统搜索和评估现有证据、然后制定建议及说明理由,后者以详细阐述为主、全面且实用,但未进行推荐强度划分。同时,这两份指南均未按照临床医师诊治糖尿病足患者的实际操作步骤和方法进行论述,例如,糖尿病足患者围手术期风险是什么?不同部位溃疡如何选择不同的手术方式等。
2019年,在CDS主任委员的指导下,由江苏省医学会主持,组织内分泌科、烧伤科、血管外科、骨科、足踝外科和心脏科等专业学者参与的《多学科合作下糖尿病足防治专家共识(2020版)》编写组成立;并邀请了国内著名的创伤科专家付小兵院士,内分泌专家冉兴无教授、许樟荣教授、刘超教授、薛耀明教授、汤正义教授,以及血管外科专家包俊敏教授作为主审。本共识以国内外指南为参考,结合我国医师的临床经验和研究结果,并以实用性和可操作性为原则撰写而成。在围绕糖尿病足建立的多学科模式下,及时评估和诊断伤口,并采取适当内外科预防和治疗方法,是本共识推荐的防治糖尿病足临床实践关键所在。我们期待,这份由临床一线医学工作者们制订的共识,能给全国从事糖尿病足相关工作的医护人员带来帮助。本共识每一条推荐都代表了编委会的一致意见,方法、背景和证据摘要的详细说明均可在线找到。但由于国内还缺乏足够的大样本的随机对照试验(randomized controlled trial,RCT)证据,编委会的认识也不全面,本共识推荐的许多观点只是初步建议,需要进一步证据支持,我们欢迎更多学者对此进行批评和指正。本共识遵循了评价、制订和评估(grades of recommendation assessment, development, and evaluation, GRADE)系统分别给出推荐意见和相应理论依据(见表1)。推荐强度分级,考虑了利益平衡、证据质量、价值观和选择意愿以及资源配置4个关键因素。重要提醒,1级推荐是通过对患者预后的作用,可以基于劣质证据。

推荐分级的评价、制订和评估系统证据等级和推荐程度
推荐分级的评价、制订和评估系统证据等级和推荐程度
| 项目与分类 | 内容 | |
|---|---|---|
| 证据等级 | ||
| 高 | 非常确信真实的效应值,接近效应估计值 | |
| 中等 | 对效应估计值有中等程度的信心,真实值有可能接近估计值,但仍存在两者大不相同的可能性 | |
| 低 | 对效应估计值确信程度有限,真实值可能与估计值大不相同 | |
| 极低 | 对效应估计值几乎没有信心,真实值很可能与估计值大不相同 | |
| 推荐程度 | ||
| 强 | 指做法好处明显大于风险,临床医师实施和人群接受可信度都高 | |
| 弱 | 指做法好处和风险相当,更依赖于特定临床情况,一般情况下,医师和患者的偏好在决策过程中起了一个更重要的作用 | |
糖尿病足是糖尿病患者由于神经病变及不同程度血管病变而导致的下肢感染、溃疡形成和/或深部组织损伤。糖尿病足溃疡(diabetic foot ulcer,DFU)病因有神经性(约占55%)、神经缺血性(约占35%)、单纯缺血性(仅占10%)。全球糖尿病足流行病学显示,DFU患病率5%~10%、发病率为6.3%(95%I置信区间=5.4%~7.3%)、年发病率为1%~4%;其中,中国的发病率为4.1%(95%置信区间=3.1%~5.2%),是糖尿病最常见的住院原因[3]。糖尿病足带来众多危害,研究表明DFU治疗12周后愈合率为24%~82%[4],且复发率高达60%[5],不仅会导致患者群生活质量下降、病死率增加,更是截肢的最主要原因。中国糖尿病学会糖尿病截肢研究组进行的一项研究显示,与无糖尿病患者组(分别为22.0 d、4 101美元)相比,糖尿病患者组住院时间明显更长(33.5 d)、花费更高(5 932美元)[6]。预计2030年中国糖尿病治疗的医疗费用将从目前的49亿美元迅速增加并超过74亿美元,根据DFU治疗费用占糖尿病总医疗费用的20%计算,这将会给社会带来沉重的经济负担[7]。
糖尿病足,不仅存在感染、神经和血管问题,也可能存在软组织和骨愈合困难问题,尤其是足病病程长和糖化血红蛋白(HbA1c)>7%的患者群问题更大。评估时应尽可能全面,尤其应以感染、下肢血管病变情况、术前风险分层和治疗风险评估等作为重点。
推荐1:针对所有糖尿病足患者群,进行全面医学评估,尤其是心脑肾等重要脏器功能及其危险因素,以及下肢病变情况的评估(推荐程度为强,证据等级为低)
理论依据:研究显示,全面评估和早期干预,有助于发现糖尿病足的高危患者群并减少其住院和截肢的可能性,也有助于糖尿病足患者群的诊疗过程和获得良好预后,并降低治疗过程中的各种风险。虽然证据等级较低,本共识强烈建议从病史、体格检查以及检验和检查3大方面对患者进行全面医学评估。
病史:(1)全身病史。①年龄、性别、职业、业余活动、职业需求和穿鞋习惯等,这些一般情况调查是病史的基础。②生活方式调查,包括饮食、运动和营养状况,尤其是吸烟、酒精、毒品或特殊药物使用(如皮质类固醇和二甲双胍可能影响血糖、麻醉和造影剂的使用,非甾体类药物可能增加消化道出血或心衰风险)情况;还包括文化、心理、社会和经济因素,其中行为能力和精神因素评估更重要,例如是否能准确理解治疗风险和预后,对治疗的期望值不能过高,以免达不到治疗目标而给其带来失望甚至是愤怒;但也不能过低,甚至合并抑郁症[8]等。③糖尿病及其并发症或合并症情况,包括心脑肾等血管事件和事件危险因素[9],其中最差并发症是慢性肾衰("双重免疫损伤",导致伤口愈合困难,截肢愈合率为50%~60%,且血液透析导致术后出血、血肿形成的危险性也大[10]);另外,糖尿病本身就是心脑血管疾病的独立危险因素(风险增加2~4倍),心衰在DFU中的发病率可达39%,且与足病严重性相关[11]。④其他系统疾病情况,许多系统性疾病可致使足踝部病变,特别要询问患者的自身免疫疾病史、炎性关节炎疾病史、中枢系统或周神经性疾病史;外伤和手术史,尤其是既往足踝部手术史也有价值。(2)足踝专科病史,既往足溃疡、足感染或足外科病史;既往周围神经病变、周围动脉病变史;鞋具使用情况和化学暴露史;本次足病发生情况(诱因、疼痛、肿胀、关节活动受限、畸形、溃疡/坏疽和病情进展情况)。见表2。

糖尿病足患者病史采集内容
糖尿病足患者病史采集内容
| 项目 | 内容 |
|---|---|
| 全身病史 | 职业需求,糖尿病家族史,既往住院史,手术史,药物过敏史,麻醉药不良反应史,营养情况,生活质量,吸烟、酒精和抑郁,糖尿病病程,目前正在使用的药物,血糖情况,糖尿病并发症,糖尿病合并症,其他系统性疾病情况,患者依从性,处理医师 |
| 足部总体病史 | 既往足病史,足部疾病诊治史,穿鞋习惯,足部保暖情况,机械或化学物品接触史,下肢针刺感或疼痛史,腿近端肌肉萎缩、无力史,足部畸形史,足部异常压力、胼胝史,关节活动度缺失史,跛行或静息痛史,双侧或单侧水肿史 |
| 足溃疡病史 | 诱因-刺激性时间、外伤,病程,复发情况,部位,溃疡处理情况,溃疡范围(长、宽、深)变化情况,对溃疡愈合的干扰(家庭和社会),足底减压技术使用情况 |
注:足部总体病史和足溃疡病史均属足踝专科病史
体格检查:(1)全身体格检查,患者平卧,记录生命体征和尿量,身高和体质量(用于计算药物剂量和给药速度)。(2)各系统检查,全身皮肤颜色、温度和湿度,气道有无使用面罩通气或插管困难的解剖特征,颈静脉扩张(提示充血性心衰)、颈动脉杂音(脑血管病)、颈静脉插管的标志等检查,心肺和腹部检查,静脉和动脉通路部位、脉搏情况,有无肌力改变、运动或感觉异常等。(3)下肢体格检查,有无下肢水肿(提示心功能不全、静脉淤积等可能),皮肤纹理、饱满程度、质量、温度、干燥(自主神经病变)、毛发生长异常、不正常皱纹、裂纹(尤其是足后跟部位)和皮肤病变(圆形或卵圆形皮肤色素沉着,多见于胫前),趾甲、足形状、关节活动度,周围血管和神经体格检查,见表3。

糖尿病足患者下肢体格检查内容
糖尿病足患者下肢体格检查内容
| 项目 | 内容 |
|---|---|
| 皮肤检查 | 颜色、弹性和湿润程度、毛发生长情况、皲裂 |
| 趾甲萎缩或增生 | |
| 胼胝及胼胝下出血 | |
| 溃疡(位置、大小、深度、程度等)、坏疽 | |
| 其他糖尿病相关皮肤改变:足癣(真菌感染)、甲沟炎(细菌感染)、瘙痒挠痕(酵母菌感染);小血管变化,浅棕色、鳞片斑块(糖尿病性皮肤病);糖尿病性脂肪变性、大疱病;发疹性黄瘤病、远端硬化病、播散性环状肉芽肿;过敏反应 | |
| 血管检查 | 无毛发生长、趾甲营养不良,皮肤变薄(羊皮纸样外观)、发绀/红斑以及体位性色泽改变(肢体抬高及下垂试验) |
| 温度梯度(同侧上下、两侧对比) | |
| 腹部动脉到足背动脉听诊、股动脉到足背动脉触诊 | |
| 手提式多普勒超声检查 | |
| 神经肌肉及骨骼系统检查 | 振动觉测定:128 Hz音叉检查和振动觉阈值测定(使用生物振感阈值测量器) |
| 浅压力觉测定:10 g单丝检查 | |
| 浅触觉测定:棉絮和羊毛测试、两点辨别觉测定 | |
| 痛觉测定:钝针头(无菌针头)测试 | |
| 温度觉测定:冷和热测定 | |
| 深肌腱反射测定:负重与不负重,髌反射和跟腱反射,踝阵挛和髌阵挛,巴宾斯基征,Romberg征(闭目难立征) | |
| 生物力学检查:结构畸形,指自发性肌肉萎缩,足下垂、跟腱挛缩/马蹄足,锤状趾、滑囊炎、小趾滑囊炎,拇趾关节骨性关节炎/僵拇,平足或足弓弯曲度过高,夏科关节病,手术造成畸形;下肢关节活动受限;足底高压力区形成评估,指胼胝、鸡眼、皮肤压红等表现 |
检验和检查:(1)检验情况。①根据血糖、血红蛋白、血浆白蛋白和前白蛋白、血脂等指数判断营养状态。②根据肝肾功能、电解质、乳酸、血气分析、心钠素、心肌酶谱等情况判断脏器功能和内环境稳态。③根据血小板、凝血酶原时间、国际标准化比值(INR,口服抗凝剂时,为正常对照1~2倍最佳)、活化部分凝血活酶时间(APTT)等判断凝血功能。④根据血常规、红细胞沉降率(ESR)、C反应蛋白(CRP)、降钙素原(PCT)、血培养和组织病原学检查判断感染情况;临床医师在对这些实验室结果进行解读时,需要小心谨慎,比如足病感染极其严重时,血白细胞计数可能并不升高。(2)辅助检查,静息时心电图检查对心脏功能评估价值有限,高危患者群体需要24 h动态心电图、超声心动图,必要时冠脉血管造影等检查[9];下肢血管和神经检查;足部影像学检查;足底压力测定[12];创面组织病理学检查。
推荐2: DFI是基于局部或全身炎症症状和体征的临床诊断(推荐程度为强,证据等级为中等)。推荐2.1:若临床检查模棱两可或无法解释,考虑将炎症血清生物标志物,如CRP、ESR、PCT等作为辅助诊断,用于DFI诊断(推荐程度为强,证据等级为低)。推荐2.2:几乎所有临床感染的溃疡,都要收集其组织标本进行培养以确定致病菌(推荐程度为强,证据等级为中等)。
理论依据:2004年美国感染病学会(Infectious Diseases Society of America, IDSA)以证据为基础的临床实践指南,就已经详细地阐述了糖尿病足合并感染的诊断和疗效评价标准;其中,DFI是基于局部肿胀或硬结、皮温升高、局部压痛或疼痛、周围红斑延伸>0.5 cm和脓性分泌物形成的临床诊断。糖尿病足患者出现发热、畏寒、精神错乱、意识不清、呕吐、出汗、厌食、血流动力学不稳定(例如,心动过速、低血压)和代谢紊乱(如酸中毒、糖脂代谢障碍、电解质紊乱、氮质血症加剧);白细胞增多、白细胞分类左移、炎症标志物(如ESR、CRP)升高、PCT升高等临床表现,不仅提示急性感染存在,还有助于深部组织感染的判断,同时也可用作疗效的动态判段[13]。最新IWGDF指南论述了炎症血清生物标志物在DFI诊断中的作用,认为白细胞与感染严重程度的相关性很小,大约一半被诊断为DFI患者有正常的白细胞;ESR对感染诊断价值较高,尤其当ESR≥ 70 mm/h时骨感染存在可能性大;而CRP和PCT的诊断准确率更高,与ESR相比,CRP水平在感染时上升更快,并随着感染的控制而快速下降[1]。细菌培养时注意以下几点:(1)在抗生素使用之前留取标本。(2)首选深部组织标本,而不是拭子标本。(3)需进行厌氧菌和需氧菌培养及药物敏感试验。(4)无论有无发热症状,每例患者都要做2次血培养和尿培养(老年人或严重衰竭患者群常无发热反应)。(5)不推荐将分子微生物学技术、电子测量足底温度和微生物定量分析作为一线鉴定病原体的方法。(6)培养结果的准确性有赖于临床和检验医师在处理样本过程(包括收集、转运以及培养)中提供的信息质量(2019年IWGDF糖尿病足指南警告!)。因此,本共识建议,DFI是基于局部或全身炎症症状和体征的临床诊断,炎症指标作为辅助诊断,组织培养确定病原学。
推荐3:存在深或大溃疡、骨突出部位溃疡或慢性不愈合溃疡等征象时,应高度怀疑骨髓炎可能,需要进一步做骨探针、X线片和核磁共振等检查(推荐程度为强,证据等级为中等)。
理论依据:糖尿病足骨髓炎(diabetic foot osteomyelitis,DFO)通常是由软组织溃疡直接感染引起的,细菌穿透皮质骨进入骨髓腔,增加了截肢风险。在良好血供和充分减压的情况下,糖尿病足伤口持续不能愈合,应考虑DFO。临床医师在面对糖尿病足,任何感染、深或大溃疡,尤其是局部红肿热、皮下硬结、溃疡在骨突出部位、骨探针检查(a probe to bone,PTB)阳性等情况,应该考虑其合并DFO的可能性[14]。其中,PTB检查相关研究较多,诊断DFO的敏感性在38%~87%、特异性85%左右;其后研究认为,PTB的阴性预测值高达96%~98%、但阳性预测值只有57%~62%[15],说明对于PTB结果阴性时,需要其他额外检查排除DFO诊断。糖尿病DFO诊断:(1)骨暴露,敏感性38%~87%、特异性85%~91%。(2)溃疡面积>2 cm2,敏感性56%、特异性92%。(3)溃疡深度>3 mm,敏感度74%、特异性77%。(4)ESR> 70 mm/h,敏感性90%、特异性100%。(5)碱性磷酸酶(alkaline phosphatase, ALP)> 135 U/L,特异性100%。(6)"香肠趾"外观(即红肿趾)溃疡。
推荐3.1:在所有DFI患者群中,建议进行足部X线平片(plain film radiography,PFR)检查,以确定骨异常(畸形,破坏)、软组织气体和异物(推荐程度为强,证据等级为中等)。
理论依据:PFR检查的优点在于价格便宜、方便和快速,不仅能显示软组织和骨的异常,还能动态评估其进展;也可通过记录手术后变化、骨折、异物、气体、足畸形和骨性变异体的存在,为其他影像学检查画出"路线图";在评估血管钙化、神经骨关节病和骨畸形、异物和软组织气体(这些病变常与坏死性感染有关)时具有重要意义[16]。PFR用于软组织时,气肿代表紧急状态,需要快速治疗。PFR用于DFO时,表现为渗透性放射性反应、骨膜反应和骨矿物质丢失等;但其敏感性和特异性均较低(分别约54%和68%),常不能有效鉴别DFO和有骨破坏的神经骨关节病变(Charcot′s病);单次PFR检查很难得出DFO诊断,建议至少间隔2周就需要复查,原因是PFR在疾病早期常表现为阴性、后进一步骨矿物质丢失30%~50%或炎症反应范围延伸1 cm以上时才会有显著改变,也说明PFR的敏感性低[17]。
推荐3.2:对怀疑有软组织脓肿或DFO诊断尚不确定时,推荐使用磁共振成像(MRI)作为评估手段(推荐程度为强,证据等级为低);对怀疑DFO而又不能行MRI检查者,建议骨扫描结合白细胞闪烁成像或抗粒细胞扫描(推荐程度为弱,证据等级为低)。
理论依据:MRI是DFO诊断时首选的、也是最好的高级成像方式。MRI有典型的水肿信号,即T1加权相低信号和T2加权相高信号,提示DFO活跃期;T1加权相和T2加权相信号强度均降低,提示DFO静止期。MRI的敏感性为90%(范围77%~100%),优于平片、锝(99Tc)骨扫描和白细胞闪烁成像[18];但一些疾病如骨折、肿瘤、炎症性关节炎、骨梗死以及神经性骨关节病等亦有骨髓信号改变,所以必须考虑相关疾病鉴别诊断。MRI的优点在于无电离辐射、软组织结构最佳可视化(包括窦道、深部组织坏死、脓肿和其他炎性变化探查)、早期阶段的高敏感度(骨水肿征象有利于早期发现感染);不足在于特异性不高(仅为79%~82.5%)、受金属制品影响(主要是MRI信号会衰减影响结果)、不适用于装有心脏起搏器者(因心脏起搏器受主磁场和射频脉冲干扰,其导线诱发电流可引起心律失常和组织损伤)、性价比低。
核医学扫描(nuclear medicine scans,NMS),用于DFO诊断具有一定的价值,尤其是在MRI检查禁忌的情况下,直接闪烁成像与二维结果图像可以同各种放射性核素组合使用,可增加DFO诊断的准确性[14]。NMS提示DFO征象为延迟图像中的高灌注、充血和骨吸收等[19]。NMS用于DFO诊断,敏感性较高、特异性相对较低。单光子发射计算机断层扫描(single photon emission computed tomography, SPECT)和正电子发射断层扫描(positron emission tornography, PET),可以通过产生三维的切片成像来改善解剖局部化,具有骨和白细胞扫描的作用,但该方法的实用性和成本效益需要进一步研究,目前各个指南都未作常规推荐[20]。使用锝(99Tc)或铟(111I)进行传统的三相骨扫描,灵敏度可达94%,但特异性仅为33%。将锝(99Tc)标记抗菌肽泛素(29-41)扫描与三相骨扫描结合起来,对急性感染诊断的特异性可以提高到80%~90%[21]。
推荐3.3:骨活检及骨组织细菌培养是DFO诊断金指标(推荐程度为强,证据等级为高)。
理论依据:DFO的诊断是基于细菌的分离、骨坏死的发现和炎性细胞浸润的组织病理学分析。骨活检是在无菌条件下进行,可在手术清创时,也可在荧光镜下或CT引导下经皮穿刺完成,是诊断DFO的金标准[14]。研究发现骨活检的敏感性和特异性分别达95%和90%,不仅在DFO诊断中起作用,对致病性病原体的分离及其抗生素敏感性进行指导治疗也有作用[22]。骨活检不仅需要成本、设备和专业知识,同时培养结果中抗生素的干扰、取样误差(假阴性)、污染(假阳性)、侵袭性和患者群异常反应等对其结果均有影响,此外,下肢缺血患者避免做骨活检[23]。
总之,本共识建议,在有开放性伤口的DFI患者群中,建议进行PTB协助诊断;在所有出现新发的DFI的患者群中,建议拍摄足PFR,以识别骨的异常(畸形、破坏)以及软组织气体和不透射线的异物;于怀疑软组织脓肿或诊断为DFO的患者群,建议MRI检查。于怀疑有DFO且不能进行MRI检查的人群,建议进行铟(111I)标记的白细胞扫描并结合骨扫描;DFO高危或诊断不明确的患者,建议骨组织活检,标本送细菌培养和组织学联合检查确定诊断。
推荐4:DFI严重程度,建议使用IWGDF/IDSA的相关标准(推荐程度为强,证据等级为中等);脓毒症诊断标准,建议采用中华危重症医学分会的相关指南(推荐程度为强,证据等级为中等)。
理论依据:在过去10年内,大多数都使用2004年首次出版的IWGDF/IDSA的相关标准判断DFI的严重程度。IWGDF/IDSA分类优点在于临床使用方便,只需要临床检查和血液检查及影像学检查,有助于直接诊断及对感染治疗决策,并已被学术界和执业医师广泛接受。此外,其他现有的分类办法也没有专门为DFI进行制定或验证。2014年IWGDF/IDSA DFI分级标准更新为:(1)无感染,缺乏化脓或炎症。(2)轻度,局限皮肤/皮下,周围红斑直径<2 cm,少于2个炎症征象。(3)中度,肌肉关节骨骼受累或淋巴管炎、蜂窝织炎>2 cm或坏疽。(4)重度,全身性毒血症或代谢不稳定(低血压、心动过速、严重不可解释的高血糖;但超过50%肢体威胁的感染没有系统症状或体征)。最新研究对IDSA DFI分级标准进行再评估,显示了294例患者按照IDSA的严重性标准进行分类[24]。(1)DFO比软组织感染预后差,包括抗生素持续时间[分别为(63.8±55.1)、(32.5±46.8)d,P<0.01]、手术需要量(分别为99.4%、55.5%,P<0.01)、手术次数[分别为(3.3±2.3)次、(2.1±1.3)次,P<0.01]、截肢(分别为83.4%、26.3%,P<0.01)、再感染(分别为56.7%、38.0%,P<0.01)、急性肾损伤(AKI)(分别为49.7%、37.2%,P<0.01)和住院时间[(22.6±19.0)d、(14.5±14.9)d,P<0.01]均有差异。(2)中度软组织感染和重度软组织感染患者预后,除手术次数[分别为(2.8±2.1)、(4.1±2.5)次,P<0.01]和住院时间[分别为(18.6±17.5)d、(28.2±17.7)d,P<0.01]外无差异,结果说明IDSA DFI分类能很好地反映患者预后。
脓毒症诊断标准采用2014年中华危重症医学会发表的中国严重脓毒症/脓毒性休克治疗指南,明确或可疑感染具备以下临床特点。(1)一般临床特征:①发热,体温>38.3 ℃。②低体温,体温<36 ℃。③心率>90次/min或大于不同年龄正常值的2个标准差。④气促。⑤精神状态的改变。⑥明显水肿或液体正平衡(24 h超过20 mL/kg)。⑦高血糖症,血糖>7.7 mmol/L且无糖尿病史。(2)炎症反应指标:①白细胞增多,白细胞计数(WBC)>12×109/L。②白细胞减少,WBC<4×109/L。③WBC计数正常但幼稚白细胞总数超过10%。④血浆CRP大于正常值的2个标准差。⑤血浆PCT大于正常值的2个标准差。(3)血流动力学变量,低血压,收缩血压<90 mmHg(1 mmHg=0.133 kPa)、平均动脉压<70 mmHg或成人收缩血压下降超过40 mmHg或低于年龄段正常值的2个标准差。(4)器官功能障碍指标:①动脉低氧血症,PaO2/吸氧浓度分数<300 mmHg。②急性少尿,即使给予足够液体复苏,尿量仍然<0.5 mL·kg-1·h-1且至少持续2 h以上。③血肌酐上升>44.2 μmol/L。④凝血功能异常,INR>1.5或APTT>60 s。⑤肠梗阻(肠鸣音消失)。⑥血小板减少,血小板计数<100×109/L。⑦高胆红素血症,血浆总胆红素>70 μmol/L。(5)组织灌注指标:①高乳酸血症,血乳酸水平>1 mmol/L。②毛细血管再灌注能力降低或瘀斑形成。
推荐5:所有糖尿病患者(即使无足溃疡存在),至少每年通过病史采集和足脉搏触诊检查外周动脉;年龄>50岁、既往有DFU史、心脑血管粥样硬化史、下肢血管检查异常、血管介入或搭桥手术史等任何一种情况时,至少每1~3个月检查1次(推荐程度为强,证据等级为低)。
理论依据:PAD是发生糖尿病足病的独立危险因素,可导致下肢溃疡愈合延迟,也可直接导致患者群下肢缺血、坏死[25]。糖尿病患者群PAD患病率,随着患者群年龄、糖尿病病程增加而升高,根据踝肱指数<0.9作为PAD的诊断标准。研究显示,我国50岁及以上住院糖尿病患者PAD发病率高达19.47%[26]。中高收入国家50%DFU患者有潜在PAD,低收入国家神经性溃疡可能更为普遍;DFU合并PAD,预后比许多常见癌症更差,5年病死率高达50%[27]。间歇性跛行、足部凉且皮肤苍白或暗红、触诊足背动脉/胫后动脉消失、Buerger试验阳性,听诊器或超声提示动脉搏动低弱甚至消失、伴杂音、静脉充盈时间减慢等是PAD的典型临床表现。需要注意的是,皮温是动脉收缩或舒张维持平衡的温度,可判断真皮血管血流率,检查时需要上下对比和左右对比;如果一侧肢体上下或左右两侧温差对比明显,提示该侧肢体缺血且温度分界线能初步判断堵塞平面;当双侧都病变时,温度评估容易被混淆。与IWGDF指南一样,本共识建议所有糖尿病患者即使无足溃疡存在,至少每年通过病史采集和足脉搏触诊检查外周动脉[28]。PAD存在时(1)至少每6~12个月检查1次。(2)合并肢体保护性感觉缺失或足畸形时,每3~6个月检查1次。(3)合并有足溃疡史、下肢截肢/截趾史、终末期肾病等足溃疡高危患者,每1~3个月检查1次。(4)年龄>50岁,既往有DFU史、心脑血管粥样硬化史、下肢血管检查异常史、血管介入或搭桥手术史等任何一种情况,至少每1~3个月检查1次,甚至更频繁。
推荐6:踝肱指数是目前评价PAD的首选检查项目,结合趾肱指数、足背或胫后动脉的多普勒波形、经皮氧分压(transcutaneous oxygen partial pressure,TcPO2)等能提高下肢缺血诊断的准确率(推荐程度为强,证据等级为中等)。理论依据:周围动脉评估,从详细的个人史和家族史开始,再到间歇性跛行、静息痛、下肢不适和行走速度降低等症状。诊断糖尿病PAD是比较困难的,因为糖尿病患者群缺乏典型的下肢缺血的间歇性跛行、静息痛等症状,常常首诊就是严重的组织坏死或缺失;此外,血管严重钙化,局部的感染、水肿、周围神经病变等也会干扰客观检查的结果。下肢动脉的触诊和听诊,可为糖尿病PAD提供有价值的信息,研究显示足部动脉搏动触诊以及股动脉杂音听诊对于诊断或排除糖尿病下肢动脉病变的准确性高达93.8%、特异性和阴性预测值分别高达98.3%和94.9%,但临床仍有误诊及漏诊[29]。
踝肱指数是一种可重复开展的无创功能性检查。20世纪50年代由Winsor首次描述,具有简单、便宜、可重复性高和特异性强的优点,诊断糖尿病PAD的敏感性和特异性可分别达68%~84%和84%~99%[30];踝肱指数正常参考值为0.90~1.30,踝肱指数>1.30提示动脉壁钙化[31](尤其是在糖尿病和慢性肾衰群体中,踝肱指数≥0.5且<0.9提示动脉狭窄;踝肱指数≥0.3且<0.5提示严重动脉狭窄;踝肱指数<0.3则提示严重下肢肢体缺血,有坏疽风险)。若踝肱指数检查提示血管异常病变,有条件的单位可进一步行下肢CT血管造影检查(CTA)、核磁共振血管造影(magnetic resonance angiography,MRA)或动脉内数字减影血管造影(digital subtrac-tion angiography, DSA)检查以指导下一步血运重建治疗。值得注意的是,即使踝肱指数介于0.91~0.99之间是可以接受的,但此时包括中风、冠心病或心血管死亡等心血管风险可能已经增加[32]。
趾肱指数目前被看作评估真实动脉灌注的首选指标,与足趾远端动脉不易钙化有关。趾肱指数是1965年首次被引入用于评估PAD,确切阈值仍有争议,通常认为趾肱指数≥0.7正常、趾肱指数≥0.2且<0.7动脉闭塞有间歇性跛行可能、趾肱指数<0.2可能出现静息痛,趾压<55 mmHg提示伤口愈合不良[33]。一项对照研究对比了174例糖尿病患者和53例非糖尿病患者,结果显示,为判断下肢血供情况,在踝肱指数<1.3的情况下,与踝肱指数比较趾肱指数优势不明显;但在踝肱指数≥1.3的情况下(提示钙化),趾肱指数明显要优于踝肱指数[34]。
TcPO2是反映皮肤灌注的一种测量指标,不受内侧动脉钙化的影响。研究发现,TcPO2与糖尿病显著相关(相关系数=0.258;P=0.004),其平均值为(50.02±8.92) mmHg[35]。TcPO2不同于踝肱指数,前者能有效预测糖尿病足预后(即使血管再通失败情况下也有价值)(P=0.015)[36];且评估周围血管病变的敏感性和特异性也优于后者[分别为0.72(95%置信区间=0.61~0.81)、0.48(95%置信区间=0.36~0.61), 0.86(95%置信区间=0.68~0.95)、0.52(95%置信区间=0.42~0.63)][37]。TcPO2测定的影响因素包括:(1)患者准备不充分、情绪不稳定、吸烟史、服用降压药、体型肥胖以及体位不当。(2)操作者操作不当如电极接入不稳定造成漏气、测试者缺乏对TcPO2曲线正确判断能力。(3)仪器设备使用时间过长、测试前未预热至45℃以及电极片加热时间过长。(4)其他因素:环境温度、未使用75%乙醇消毒或消毒后未干等。
目前无一单项检查方法被证明是最佳的,尤其是无一个明确阈值能说明下肢血管正常,通常认为踝肱指数0.90 ~1.30、趾肱指数≥0.75和足背动脉三相多普勒波形时,PAD可能性较小。DFU合并PAD患者以下任何一项指标存在都预示溃疡愈合率上升至少25%[1]:皮肤灌注压力≥40 mmHg、趾肱指数≥30 mmHg或TcPO2≥25 mmHg。因此,本共识建议,以踝肱指数作为评价PAD的首选检查;结合趾肱指数、足背或胫后动脉的多普勒波形、TcPO2等提高下肢缺血诊断的准确率。
推荐7:在无创检查提示存在缺血且临床考虑行下肢血管重建术治疗的情况下,需要根据病情适当选择进一步的检查(推荐程度为强,证据等级为中等)。
理论依据:下肢动脉无创检查提示缺血存在且临床考虑行下肢血管重建术治疗的情况下,可使用彩色双相超声(color duplex ultrasound,CDU)、CTA、MRA或DSA等获得解剖信息,评估整个下肢动脉循环,尤其是膝下动脉和足部动脉情况。
CDU,也被称为诊断性超声或诊断性医学超声,是一种成像方法,使用手持传感器将1~30 MHz高频声波导入血管去评估其结构和功能。B型、连续波、脉冲波多普勒和二维超声用于评估血管系统。一项前瞻性盲法比较研究显示,对比下肢血管成像结果,CDU评估下肢动脉敏感性88%、特异性79%和准确性更达95%[38]。其他有研究认为CDU诊断PAD的敏感性和特异性更高。大多数CDU都是在体外使用设备完成的,体内的较少。CDU优点是低功率声波对人体无害;不足是因声音不能很好地通过空气或骨骼传播,对含有气体或被骨骼(如肺部或头部)隐藏部位的成像效果不佳。
CTA,是借助多探测器的计算机断层扫描技术,在高速下能覆盖大面积,同时仍然保持高分辨率,可提供下肢动脉病变数量、长度、狭窄直径和形态、相邻正常动脉口径、钙化程度和远端径流血管的状态,允许在手术路径、球囊选择和介入后预期的长期通畅方面进行精确的术前规划;同时能对侧支血管的状态进行很好评估,动脉段与长段的闭塞情况也能得到很好显示。研究表明,CTA用于下肢动脉闭塞性疾病评估的敏感性、特异性和准确性达90%以上[39]。当然也有研究持反对意见,认为CTA在诊断下肢动脉狭窄方面敏感性不高(仅70%~80%),但该研究同时也发现约7.3%动脉闭塞平面下节段DSA造影看不见、而CTA可见[40]。双能CTA(DE-CTA)可以提高糖尿病患者PAD的诊断准确性,多层面重建后分别达100%和93.1%,最大密度投影时分别为99.0%和91.8%[41]。有单中心非随机观察性前瞻研究显示,CTA能有效判断下肢缺血,并提示左心功能不全(相关系数=-0.54, P<0.0001)[42]。一项回顾性研究还认为,CTA在治疗指导方面与DSA相近,如血管内和开放手术率(CTA为1.8、DSA为1.4,P=0.305)、再干预率(CTA为21%和DSA为16%,P=0.517)等[43]。CTA的优点是可显示从肾动脉到足部的血管网;不足是严重钙化可能妨碍较小动脉评估、潜在过敏反应和造影剂性肾病(先前存在肾脏疾病或心力衰竭)。
MRA,不需要动脉穿刺,被认为是一种侵入性较低、更可接受的检查。数据表明,MRA对腹股沟下狭窄闭塞具有极好的敏感性和特异性(总体分别可达94.7%和95.6%),膝下血管的敏感性和特异性也能达92.2%和93.3%,且比DSA更容易识别远端血管[44],但MRA对糖尿病患者(尤其是膝下疾病)诊断的准确性尚不清楚。检索发现1998年1月-2012年6月只有3项研究(83例患者)有膝下血管数据,CE-MRA的敏感性仅为86%(95%置信区间=0.86-0.91)、特异性是93%(95%置信区间=0.90-0.95),说明MRA作为引导血运重建的工具会导致相当大的误判,只更适合做筛查而不是诊断[45]。目前MRA多是用钆作造影剂,可从腹主动脉到足部获得图像。但其存在如下问题:(1)先前置入支架和人工制品会限制分辨率。(2)起搏器和幽闭恐惧症。(3)严重肾功能不全(肌酐清除率<30 mL/min)的患者禁止用含钆造影剂(有发生肾源性系统性纤维化的风险;用非钆类药物,如超小超顺磁性氧化铁粒子替代)。值得注意的是,为规避造影剂的副作用又取得高质量的图像,包括静态间隔单次激发MRA在内的许多非增强MRA方案正日益用于判断PAD并取得良好效果。
DSA,是一种侵入性技术,最常在股动脉穿刺后注射造影剂,获得最高空间分辨率和图像质量,也是唯一能同时用于诊断和治疗动脉疾病的方法,是检测和评价外周动脉疾病的"金标准"[46]。相比于CTA,DSA判断下肢缺血严重性和血管密度方面有优势,跨大西洋组织多学会专家共识(TASC)分级C或D远端节段病变(DSA组25%、CTA组0,P=0.001)和下肢血管缺乏(DSA组72%、CTA组26%,P=0.001)[47]。DSA的优点是动脉成像的金标准,允许在同一过程中进行血管内治疗;不足是使用碘造影剂、侵入性手术、潜在动脉穿刺并发症,有时会引起过敏反应。
总之,应获得下肢动脉的解剖信息以评估动脉狭窄或闭塞的存在、严重程度和分布,在糖尿病患者中,获得详细的膝关节以下和足部动脉成像(特别是对足部循环进行专门评估)至关重要。因此,本共识建议,在无创检查提示缺血存在、且临床考虑行下肢血管重建术治疗的情况下,需要根据病情适当选择进一步的检查。
糖尿病神经病变是糖尿病最常见的慢性并发症之一,其最常见的类型是糖尿病周围神经病变(DPN),主要临床表现分为阳性症状和阴性症状,阳性症状包括主观感觉异常(如刺痛、痛觉过敏、烧灼痛、蚁走感);阴性症状则通常需要临床客观检查才能被发现,包括感觉功能减退、麻木、下肢肌萎缩等。DPN导致保护性感觉丧失(loss of protective sensation,LOPS)是引起DFU的重要原因。研究显示,45%~60%的足溃疡是单纯由于神经病变所导致,合并DPN群体足溃疡风险增加15%、年发病率达5%~7.5%,其中DPN伴LOPS的群体足溃疡风险增加达7倍;且与感觉正常人群相比,DPN人群足溃疡再发概率超过3.5倍[48]。
推荐8:使用包括10 g单丝压力觉和其他测试(振动觉、针刺痛觉和冷/热温度感觉、腱反射)评估DPN(推荐程度为强,证据等级为中等)。
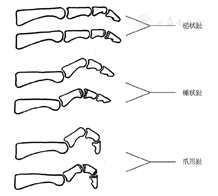
理论依据:根据神经纤维的粗细,可将周围神经分为大纤维,直径在6~12 μm,介导踝反射、触觉、压力觉、振动觉、本体感觉;小纤维,直径多在5 μm以下,传递痛觉、温度觉和自主神经功能。临床最常见的是LOPS,其中振动觉减退或丧失最早,多由大纤维神经病变所导致,是DFU发生及截肢的重要原因,神经功能检查的主要目的正是提早发现LOPS。糖尿病自主神经病变(diabetic autonomic neuropathy,DAN),在足部的表现很容易被忽视,对血管的调节功能受损、导致皮肤质地改变、弹性下降、干燥和皲裂,使得神经营养血管短路和微循环障碍,这是发生和加重DPN的重要病理过程,此外,心血管自主神经病变(cardiovascular autonomic neuropathy, CAN)、胃肠道自主神经病变、泌尿生殖系统自主神经病变等均对人群生活质量造成巨大影响、甚至明显增加死亡风险,在进行糖尿病足筛防过程中,应同时对自主神经病变进行适当的评估和防治。糖尿病也可导致运动神经受累,表现为爪形足趾,足弓加深,足部小肌肉萎缩,进而引起足底跖趾关节部位及足背趾间关节部位皮肤受压增加和胼胝形成,足部畸形和溃疡发生;体检过程中若发现上述体征,提示存在高危足病可能[49]。
周围感觉神经评估,应包括10 g单丝压力觉和其他测试(振动觉、跟腱反射、针刺和冷/热感觉测试)。这些检查简便且价廉,适用于基层医疗单位或人群筛查,但检查时间较长、检查者需要掌握一定的操作技能、受检者需要具备一定的听力、认知能力和理解能力来配合检查,所以结果往往可重复性较差。为了规避结果误差,检查过程要保证标准化,我们建议采用IWGDF的方法,同时要多种工具结合来综合评估。
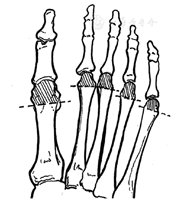
首先,推荐行压力觉Semmes-Weinstein测试,即10 g尼龙丝测定,常用质量为5.07 g的单丝。具体步骤:(1)于安静轻松环境中,患者仰卧位、闭目。(2)运用单丝触及患者手或臂肘或额头,使患者感受什么是压力。(3)测试至少双足底第1和第5跖趾关节处、第1趾远端趾骨底面这3个部位(图1A),避开溃疡部位、胼胝、瘢痕或坏死组织处。(4)单丝垂直于皮肤表面(图1B),运用足够力量使纤维弯曲成"C"形(图1C),接触皮肤持续1 s(接近、皮肤接触、单丝移除总时间不超过2 s),同一部位测试3次(至少有1次无尼龙丝放置,即假应用),询问患者是否感觉到压力、压力的位置(左/右足)。结果判断:糖尿病患者足底某一部位3次测试,2次及以上能正确回答,说明保护性感觉正常;3次测试,2次及以上不能正确回答,说明保护性感觉异常、患者处于足溃疡危险中。注意事项:测试期间需要积极反馈和鼓励患者;不允许长丝滑过皮肤或重复接触检查部位;单丝在一段时间内使用太久,屈曲动力会丧失,此时需及时更换。压力觉测试是评估晚期神经病变的一种有效的检查方法,诊断DPN的敏感度为41%~93%、特异度为68%~100%,其中拇趾和跖骨头表面测试的敏感度为80%~93%、特异度为86%~100%[50]。


振动觉,常用128 Hz音叉来评估。具体步骤:(1)于安静轻松环境中,患者仰卧位、闭目。(2)把音叉放在患者的手腕或肘部、锁骨,让患者知道振动感觉。(3)音叉垂直于皮肤,放置在第1趾远端趾骨的背面(图2),测试3次(至少有1次放置的是无振动音叉,即假应用),询问患者是否感觉到振动、振动的位置(左/右足)。结果判断:3次测试,至少2次正确,说明患者振动觉正常;2次或以上不正确,说明患者振动觉异常,存在足溃疡风险。如果患者无法感受到大拇趾振动,还需要在踝、胫骨粗隆处重复检查。注意事项:测试期间需要积极反馈和鼓励患者。单丝压力觉加上音叉振动觉,诊断DPN的敏感度和特异度均可达到90%左右[51]。
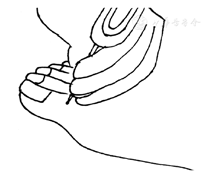

痛觉,常用一次性40 g压力针头或大头针来评估。具体步骤:(1)于安静轻松环境中,患者仰卧位、闭目。(2)用压力针头或大头针轻压患者颈部、手腕内侧或膝盖内侧,使患者感受什么是痛觉。(3)将压力针头或大头针置于患者拇趾背侧表面,从近端到趾甲移动;压力是正好让皮肤变形时的力度;询问有无疼痛及疼痛程度,以评判对疼痛的感觉(图3)。结果判断:根据患者对不同部位疼痛的描述来判断患者是否痛觉异常,主要包括痛觉过敏、正常、减弱、消失。注意事项:压力不能太大,以免穿破皮肤。


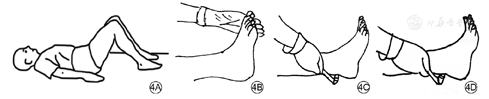
跟腱反射,常用叩诊锤来评估。具体步骤:患者仰卧位,膝关节屈曲并外展,检查者把持患者足尖并使稍背屈,叩击跟腱;或者患者跪于椅子上,两足悬空,检查者用左手把持使足轻度背屈而叩击跟腱;或患者坐位,两足悬垂,使患者足轻度背屈而叩击跟腱。结果判断:正常反应为腓肠肌收缩、足向跖面屈曲(图4),在静息或加强力度的情况下跟腱反射均缺失被认为跟腱反射异常。跟腱反射诊断DPN的准确性和特异度不如压力觉或振动觉试验。

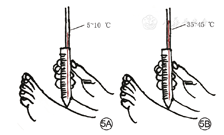
温度觉,常用Tip-Therm凉温觉检查器来评估。具体步骤:(1)于安静轻松环境中,患者仰卧位、闭目。(2)将Tip-Therm凉温觉检查器置于患者手背,让患者知道什么是凉温觉。(3)分别将凉(5~10 ℃)、温(35~45 ℃)感觉检查器尖端置于患者足背皮肤,询问患者感觉(图5)。结果判断:根据患者足背部皮肤对温度的感受来判断患者温度觉是否异常,主要包括正常、减弱、消失。

还有一种更简单的评估压力觉的方法,叫作伊普斯威奇触摸测试(Ipswich Touch Test),由雷曼团队在伊普斯威奇医院设计。具体步骤:解释过程并确保患者理解,指导受试者闭上眼睛,感到触摸时说"是";检查者用示指指尖轻抚患者双足第1、3和5趾趾尖,持续1~2 s。这种新型筛查方法与10 g单丝法检查压力觉的结果几乎完全一致(k=0.88,P<0.0001)[52],由非医疗从业者评估时,敏感度达78.3%、特异度达93.9%[53]。
总之,本共识建议通过压力觉、振动觉、痛觉、跟腱反射、温度觉测试来评估DPN。当然有条件的单位,可根据人群的经济情况,用以下检查代替上述部分体格检查:(1)振动觉阈值(Vibration Perception Threshold,VPT)测定,可代替音叉测定振动觉,诊断DPN的敏感度和特异度分别为77.3%~100.0%和72.8%~81.0%;VPT高于25 V时足溃疡风险较高[54]。一项为期4年的前瞻性随访研究显示,VPT异常的患者足溃疡风险增加,且VPT每增加1 V足溃疡风险增加约5.6%,VPT低于15 V时足溃疡风险较低[55]。VPT增高已成为DFU的独立危险因素(优势比=12.05),对DFU的影响高于存在外周动脉疾病或失去保护感觉[5];与10 g单丝相比,VPT具有较高的DPN阳性预测值。(2)SudoScan检查或角膜共聚焦显微镜检查,可代替痛觉、温度觉检查。
值得注意的是,神经肌电图及神经电生理检查,测定神经传导速度被广泛认为是DPN诊断的金标准,但因其受到专业操作人员、可用性(机器较贵,很多基层单位没有)和检查时间等方面的限制,故不作为常规推荐,仅在症状不典型而需要进行鉴别诊断时采用。DPNCheck神经传导速度测量仪,操作相对简单方便和快捷,且能提供可重复性更好的检测结果,操作者仅需经过简单培训即可掌握使用,可代替神经肌电图来检测神经传导速度。
推荐9:DPN的诊断标准大致参照《中国2型糖尿病防治指南》和美国糖尿病学会(ADA)立场声明(推荐程度为弱,证据等级为中等)
理论依据:DPN临床表现多样、检查方法也多样。目前关于DPN诊断的金标准尚有争议,神经电生理检查在诊断大纤维神经病变中具有客观、可靠的特点;大量病例对照研究采用神经传导速度(nerve conduction velocity,NCV)等神经电生理指标作为参照指标;但是也有学者认为诊断的金标准是皮肤活检及神经纤维密度测定,因为其对于诊断早期DPN更加敏感。本共识建议,DPN诊断标准大致参照《中国2型糖尿病防治指南》和ADA立场声明[56,57],具体如下。(1)明确的糖尿病病史。(2)绝大多数均为诊断糖尿病时或之后出现的神经病变,然而在糖尿病前期,也可以出现早期DPN[58]。(3)临床症状和体征与DPN的表现相符,部分患者可没有DPN症状。(4)有疼痛、麻木、感觉异常等临床症状者,跟腱反射、痛觉、振动觉、压力觉、温度觉5项检查中任意一项异常;无临床症状者,前述5项检查中任意2项异常。(5)排除其他病因引起的神经病变,当具有症状不对称、非长度依赖性表现、以运动神经功能受累为主、急性或亚急性起病、明显的自主神经受累[59]等临床表现时,尤其需要注意鉴别诊断,必要时请神经科医师协助诊断。
推荐10:对全面评估后的糖尿病足人群,按照一定的诊断依据和诊断流程进行诊断和鉴别诊断(推荐程度为强,证据等级为低)
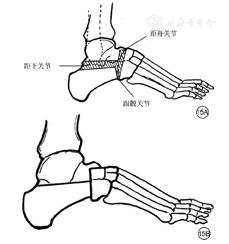
理论依据:糖尿病足的诊断依据,是在排除其他疾病的基础上,按照下列要点进行诊断。(1)达到糖尿病的诊断标准。(2)具备糖尿病足特点。①既往溃疡、截肢和持续治疗(包括血管重建史)病史。②下肢远端神经异常。③不同程度周围血管病变相关。④足部感染、溃疡和/或深层组织破坏。其中,感染诊断,应根据临床表现而非细菌培养结果;感染严重程度,应在胼胝和坏死组织去除后,根据创面范围和深度以及全身情况来评价。部分发达国家及其相关组织有诸多的糖尿病足诊断流程、临床路径及指南,如美国血管外科学会联合美国足踝医学会和血管医学科学会的《糖尿病足:临床实践指南》[28],英国国家卫生与临床优化研究所的《糖尿病足诊治流程》[60],澳大利亚的《糖尿病足防治网络》[61]等。因此,本共识建议,对全面评估后的糖尿病足人群,按照一定的诊断依据和诊断流程,进行诊断和鉴别诊断。本编写组根据这些指南性文献和各成员的临床经验,制订了相应的糖尿病足诊断流程(图6)。


推荐11:当糖尿病患者的足溃疡出现在不常分布部位、不典型外观或对常规治疗反应不佳时,需要进行鉴别诊断(推荐程度为强,证据等级为中等)
理论依据:下肢溃疡发生的病因有很多(表4),包括血管性(静脉性、动脉性和混合性)、神经性(糖尿病、脊髓痨、脊髓空洞症)、代谢性(糖尿病、痛风、脯氨酸肽酶缺乏症)、血液学的(镰状细胞病、冷球蛋白血症)、外伤(压力性损伤、烧伤)、肿瘤性的(基底细胞癌、鳞状细胞癌)、感染(细菌、真菌、原虫)、脂膜炎(脂性渐进性坏死、脂肪坏死)、脓皮病(坏疽性脓皮病)、特殊性(高压性溃疡)病因等。研究显示,引发下肢溃疡的病因中约70%为静脉功能不全,约4%为动脉疾病,约15%为混合动脉和静脉疾病,13.5%是血管炎症和其他少见病因[62]。急性创伤伤口不适当治疗也是慢性溃疡的常见病因,甚至有时被认为是慢性溃疡的主因。

不同类型下肢溃疡的病因和临床表现
不同类型下肢溃疡的病因和临床表现
| 溃疡类型 | 高危因素 | 下肢改变 | 溃疡部位 |
|---|---|---|---|
| 静脉性溃疡 | 静脉瓣功能不全、深部静脉血栓病史、长时间站立、怀孕、运动量少、肥胖、家族史 | 水肿、色素沉着、表浅静脉曲张、皮肤鳞状干性脱皮或湿疹皮炎(淤积性皮炎),淋巴水肿 | 内踝区(足靴区):内踝、胫前骨、下肢下1/3部位 |
| 动脉性溃疡 | 胆固醇高、动脉硬化、高血压、糖尿病、老龄、吸烟、血栓闭塞性脉管炎、动静脉瘘 | 腿毛少,趾甲变厚,皮肤颜色苍白,皮肤干燥、薄、发亮,断断续续的跛行,外周动脉搏动减弱/消失,毛细血管再灌注时间延长(>4 s),腿部抬高45°维持1 min后皮肤变苍白 | 受压部位或肢端(趾):趾尖部位、趾骨头部位、外踝或跖骨 |
| 神经性溃疡 | 糖尿病、周围神经损伤等 | 感觉功能障碍、足部畸形 | 受压部位 |
| 溃疡类型 | 溃疡特点 | 溃疡周围皮肤 | 疼痛 | 脉搏 |
|---|---|---|---|---|
| 静脉性溃疡 | 范围大、边缘不整齐,溃疡较浅,创面常见红色肉芽组织,坏死组织少、渗液多 | 由含铁血黄素所致的色素沉着(重),脂肪皮肤硬化症 | 不明显或中度疼痛,抬高下肢时疼痛减轻 | 正常脉搏,皮温缓和 |
| 动脉性溃疡 | 范围小、边界清楚,溃疡深,基底部苍白,黑色坏死组织、渗液少 | 皮肤光亮、萎缩,其上毛发脱失;色素沉着轻 | 疼痛感非常明显,常在休息时或放低下肢时疼痛减轻 | 下肢脉搏减弱或消失,皮肤冰凉 |
| 神经性溃疡 | "钻孔样" | 厚的胼胝 | 无 | 动脉搏动检查不可靠 |
DFU出现在不常分布部位、具有不典型外观或对常规治疗反应不佳(超过6周)时,需要进行鉴别诊断。除常见疾病原因外,特别要注意以下几类。(1)动脉高压性溃疡,即缺血性皮下动脉粥样硬化,这种缺血也会导致溃疡坏死发生,包括远端Martorell溃疡、近端非尿毒症钙化性溃疡、肾功能不全的远端和近端钙化性溃疡[63];DFU合并动脉高压临床也常见,容易被误诊为坏疽性脓皮病。(2)动静脉混合性溃疡,临床是典型静脉性溃疡表现,但周围组织和基底部组织变黑,需要动脉血管重建术联合浅静脉回流手术治疗。(3)非过度角化溃疡,不是糖尿病足常见的神经性病变所致,要引起重视,诊断时应做病理检查。(4)脂质渐进性坏死性溃疡,1932年由Urbach医师首次描述,是一种罕见的非感染性肉芽肿性皮肤病,能影响胰岛素抵抗型糖尿病患者的皮肤,也可见于类风湿性关节炎等非糖尿病患者;约0.3%的糖尿病患者会发生脂质渐进性坏死性溃疡,女男比约3∶1,与血糖控制好坏无关,与患者皮肤血管闭塞或狭窄有关,最常见部位在小腿胫前[64]。(5)癌性溃疡,最常见的为鳞状细胞癌或基底细胞癌,可以是原发性或转移性,也可以是慢性良性溃疡恶变而来的Marjolin溃疡。Marjolin溃疡由法国医师Jean-Nicolas Marjolin在1827年首先进行了描述,演变的时间中位数是25年,最常见病理学改变是基底细胞癌、鳞状细胞癌和黑色素瘤,发病率分别为每年10万分之75~100、10万分之23~33、10万分之5~20。Marjolin溃疡发病机制复杂,包括:①参与细胞增殖和转化的原癌基因表达增加所致。②p53和p21WAF/CIP1过表达所致。③与紫外线照射等外部因素有关。④慢性炎症和感染,包括营养不良的大疱性表皮松解症,也会因反复组织压力而癌变等。总之,本共识建议,当糖尿病患者的足溃疡出现在不常分布部位、不典型外观或对常规治疗反应不佳时,需要进行鉴别诊断。
推荐12:糖尿病足的分类和分级方法很多,各有利弊;TEXAS创面分类系统兼顾病因和病变程度并已得到验证,建议用于临床(推荐程度为强,证据等级为中等)
理论依据:目前存在许多分级和分类系统,如Meggitt-Wagner分级系统、中国空军总医院分级法、S(AD)SAD [size( area and depth) -sepsis-arteriopathy-denervation,大小(面积与深度)-脓毒症-动脉病-去神经]评分系统、TEXAS创面分类系统、PEDIS(perfusion-extent-depth-infection-sensation,灌注-范围-深度-感染-感觉)溃疡分类系统、糖尿病溃疡严重程度评分(Diabetic Ulcer Severity Score,DUSS)系统、Kobe分类法、SINBAD(site-ischemia-neuropathy-bacterial infection-area-depth,部位-缺血-神经病变-细菌感染-面积-深度)分类系统和WIFI(wound-ischemia-foot infection,创面-缺血-足部感染)分级法等近20种,解放军东部战区空军医院糖尿病足治疗中心还自主研发了SIANM(system of infection,arterial disease,neuropathy and missed causes,感染-动脉疾病-神经病变和忽视病因系统)评估法[65]。这些系统的实用性和科学性各不相同,无法判断谁更好,临床应根据需要进行相应选择。最新出版的IWGDF指南,推荐卫生专业人员之间交流用SINBAD系统、感染评估用IWGDF/IDSA分类、灌注和血运重建评估用WIFi分级法。
TEXAS创面分类系统是圣安东尼奥的得克萨斯州大学健康科学中心在1996年根据深度、感染、血管状态提出的一种糖尿病足分类方法,查询表见表5。例如,糖尿病足TEXAS创面分类系统分类C3、左侧,表示左足有缺血深及骨质的DFU。研究显示,当创面的TEXAS创面分类系统分级(深度)和分期(病因)高时,截肢率有上升趋势,如感染和缺血足的高位截肢率是低分级和分期足的90倍,探及骨头创面的大截肢率是其他创面的11倍[66];另一项多中心前瞻性病例研究方法比较了TEXAS创面分类系统与Wagner分级系统,认为2种系统与临床预后有相同的相关性,分级和分期越高肢体截肢率越高,且TEXAS创面分类系统似乎更适用[67]。因此,本共识建议,根据需要选择不同的分类及分级方法,其中TEXAS创面分类系统兼顾病因和病变程度并已得到验证,建议用于临床。

TEXAS创面分类系统查询表
TEXAS创面分类系统查询表
| 分期 | 0级:溃疡形成前后表皮完整 | 1级:浅表溃疡,不累及肌腱、关节囊或骨质 | 2级:创面累及肌腱或关节囊 | 3级:创面累及骨质或关节 |
|---|---|---|---|---|
| A:无缺血/感染 | A0 | A1 | A2 | A3 |
| B:感染 | B0 | B1 | B2 | B3 |
| C:缺血 | C0 | C1 | C2 | C3 |
| D:缺血和感染 | D0 | D1 | D2 | D3 |
推荐13:建议手术前评估糖尿病足患者的深静脉血栓(DVT)、出血、压疮和麻醉风险,以提高其手术安全性(推荐程度为强,证据等级为中等)
理论依据:糖尿病足患者好发DVT,其原因可能包括如下几点。(1)研究表明糖尿病患者较健康志愿者DVT风险增加约1.4倍(95%置信区间=1.27~1.63),可能与高血糖和高纤维蛋白原有关[68]。(2)合并下肢静脉扩张、内皮细胞完整性被破坏。(3)手术损伤静脉。(4)手术时用的止血带,会使平面以下的动脉供血减少、静脉扩张,继发性静脉内皮微撕裂。(5)聚甲基丙烯酸甲酯聚合过程中产生的热量会破坏内皮的完整性。(6)下肢血管重建术导致的血管损失(1年内DVT发病率达8.73%[69])。(7)麻醉药物会导致下肢静脉扩张。(8)合并其他危险因素,例如高龄、合并症和住院延误。迄今为止未有专门针对糖尿病足患者DVT风险评估和分层的方法,可借鉴2005年起被整形外科和血管外科正式应用的Caprini评分,该评分将糖尿病足患者分为DVT低危、中危、高危和极高危4种,当患者Caprini评分≥7分时用化学药物干预,能使得DVT相对降低50%、绝对风险降低1.2%~4.5%。
糖尿病足患者出血风险增加,可能与下列因素有关:(1)长期口服非甾体消炎药、抗血小板和抗凝药物以及应激性消化道溃疡,其中,华法林导致患者出血风险增加约2倍,临床胃肠道等颅外出血更常见,但颅内事件通常更具破坏性(华法林相关性颅内出血患者病死率接近50%);部分患者冠状动脉介入术(percutaneous coronary intervention,PCI)后出血事件较前升高[70]。针对DFU的局部手术,考虑大多数患者处在高凝状态以及该局部手术出血可直视、可止住、可控制,仍建议继续维持原有抗凝扩血管治疗,但要注意麻醉方式的选择。(2)除高血糖外,年龄、高血压、充血性心力衰竭、脑血管疾病和肝肾疾病等复杂糖尿病并发症和合并症的存在,增加了出血,尤其是颅内出血的风险。(3)血管介入时穿刺部位或非穿刺部位都可能出血,主要与操作本身和抗凝抗栓治疗相关,一项心脏PCI术后研究显示,穿刺及操作相关的出血占42.1%、非穿刺部位出血占57.9%(消化道出血占16.6%、腹膜后出血占13.3%、泌尿生殖道出血占5.0%、其他出血占23.0%)[71];糖尿病足患者介入术后出血的研究不多,但临床会有发生,解放军东部战区空军医院2018年收治的150例糖尿病足患者行下肢介入术后6例发生较为严重的出血,其中1例为穿刺侧髂外动脉出血、3例为穿刺点出血、2例为腹壁动脉自发性出血(另文发表)。迄今未有专门针对糖尿病足患者出血风险的评估方法,需要综合病史、临床症状、体征、血常规、出凝血功能、血栓弹力图等综合判断。其中,用华法林等抗凝药者有多种评分方法,例如,2016年被中国PCI指南引用的欧洲CRUSADE出血风险评分表,35分或以上预示患者出血的敏感度为70%(95%置信区间=55.57~82.43)、特异度为77.41%(95%置信区间=72.23~82.58)、阳性预测值为40.78%(95%置信区间=30.80~50.75)、阴性预测值为92.07%(95%置信区间=88.34~5.81)等[72]。
医院获得性压疮(hospital-acquired pressure ulcers,HAPU)预防仍然是一项重要的临床挑战。糖尿病足患者在被迫卧床期间,要注意防止对侧足出现HAPU。受到围手术期手术/麻醉影响,HAPU患病率与手术类型和手术时间有关。目前无专门针对糖尿病足患者HAPU风险的评估方法,可借鉴1987年制订的Braden量表(总分23分,≤9分提示极度高危,10~12分提示高度风险,13~14分提示中度风险,15~18分提示低度风险),敏感度和特异度在70%~80%,国内不少护理学研究已经证实或应用了该量表。注意,由于Braden量表未包括年龄、体质量指数和某些合并症等,应用其评估糖尿病足HAPU风险时要结合实际情况而定。
糖尿病足患者术前需进行麻醉风险评估,并结合手术方式、大小和时长来选择合适的麻醉方法。(1)首选周围神经阻滞(peripheral nerve block,PNB)麻醉,已有研究验证了PNB麻醉的安全性和操作流程[73],还有前瞻性RCT研究观察到PNB麻醉能更好地稳定血流动力学和控制术后疼痛,是糖尿病患者下肢手术麻醉的首选[74],见图7。(2)不推荐硬膜外麻醉,虽然其对血糖影响很小,但会抑制儿茶酚胺释放,阻碍手术应激性高血糖的发生;因韧带钙化、骨质增生以及椎间隙变窄等问题存在,又使得椎管内麻醉穿刺成功率降低、出血和神经损伤风险增加;也易出现低血压,甚至可诱发心脑血管意外[75]。因此,硬膜外麻醉并不安全,在维持稳定的血流动力学的同时,确保足够的麻醉和镇痛效果可能是一个挑战。(3)目前未有专门针对糖尿病足患者的麻醉风险表单,自1941年定义后,经过多次修订趋向合理的、根据患者术前状态进行分类的美国麻醉医师学会的身体状况分类系统[The American Society of Anesthesiologists Physical Status (ASA PS) classification system]值得借鉴,可将其作为围手术期麻醉意外发病率和病死率的独立预测因子。一项回顾观察性研究表明,ASA PS分类系统及其修订后均能预测麻醉死亡,后者作用更强,30 d内死亡预测的相关曲线下面积提高4.7%后,达0.848±0.008,P<0.00001,但缺乏前瞻性研究结果支持[76]。

注:麻醉针指示麻醉剂注射部位
因此,本共识在证据等级中等的情况下,强烈建议手术前评估糖尿病足患者的DVT、出血、压疮和麻醉风险,以提高其手术安全性。
推荐14:成立多学科的保肢团队,成员包括内分泌科医师、足踝外科医师、血管外科医师、感染科医师等;必要时,及时向上级糖尿病足治疗中心请求会诊和/或转诊,有助于降低糖尿病足患者的截肢率和病死率(推荐程度为强,证据等级为低)
理论依据:研究显示,大约有25%的糖尿病患者会发生足溃疡,50%会感染需要住院,其中20%需要截肢,病死率比大多数恶性肿瘤要高[77]。因此,由不同医学专业人员组成专门协作团队是解决这一复杂病症的有效办法;其中,足踝外科医师和血管外科医师在肢体修复团队中发挥着主导作用。国外设立的足病医师,通常被称为糖尿病足病专家团队的"看门人",他们在该团队中负责确定预防溃疡的易感风险因素、对足部和踝关节进行生物力学分析以防止此类病变的复发等。研究显示,在4年随访期间,足病医师的存在能使得糖尿病足患者的大截肢率降低82%[78]。另一项研究表明,根据国家医疗保险计划,每年去看足科医师可节省4 271.30美元;而根据私人保险计划,每年去看足科医师可节省19 686美元[79]。
有回顾性研究分析了多学科团队在DFU病因(神经性、缺血性或混合性)判断、预后(感染控制、伤口愈合)2个方面的作用,结果显示,95%转诊的患者需要重新进行病因分类(P<0.001),多学科团队的病因诊断准确率、愈合能力分级准确率、血管病变判断准确率、细菌鉴定准确率、疼痛评估准确率、鞋具减压评估准确率、伤口关闭率、辅料更换频率分别为85.71%、100%、14.28%、71.4%、100%、100%、30.0%、1.90%,显著高于单一学科治疗的6.12%(P<0.001)、44.90%(P<0.001)、2.04%(P=0.03)、42.86%(P=0.04)、8.16%(P=0.001)、30.60%(P<0.001)、4.08%(P<0.001)、1.69%(P=0.035)[80]。在全球范围内,有许多医疗中心采用了保肢和截肢预防的方法治疗糖尿病足。一项前瞻性研究显示,在糖尿病足部护理服务建立后的11年随访中,重大截肢患者减少62%,所有截肢患者总体减少40%[81]。另一项研究表明,在多学科护理小组成立5年后,重大截肢率从每10万人中10.7人下降到每10万人中6.24人[82]。一项亚洲的研究评估了多学科团队的临床影响,结果显示在治疗糖尿病足中,多学科团队治疗较单一学科治疗使得大截肢率降低了1/3、住院时间从20.36 d缩短到12.20 d(P<0.05)[83]。一项中国的研究显示,采用基于团队的方法后,糖尿病足主要截肢率从之前单一学科治疗的9.5%下降到不足5%,特别是Wagner3级和4级的创面大截肢率从2004年单一学科治疗的35.7%下降到2007年以后团队治疗的4.4%[84]。
按照IWGDF要求,糖尿病足中心必须具备各专科专家诊疗、快速获取诊断和治疗的设备、能开展血管重建术和搭桥手术3个必要条件;同时能完成患者及其护理人员、医院和全科医护人员的教育,高危足筛查;能快速有效地治疗任何足溃疡或感染;能审核各个环节以确定和解决问题,并符合当地公认标准;能设计一套完善的体系,用于需要长期治疗的患者,而不是简单的对紧急事件进行处理。最新IWGDF指南指出,所有国家,最好至少有3个等级的糖尿病足治疗中心,1级,人员配置包含足病医师、全科医师和护士;2级,人员配置包含糖尿病医师(与鞋技师、矫形师或假肢师良好合作)、外科医师(普外科、整形外科、足踝科和血管外科医师)、感染科医师或临床微生物学家、足病医师和糖尿病护士;3级,具备2级水平足病中心的人员配置,但所有人员只专门从事糖尿病足领域的研究和治疗,并且能作为第3级的转诊中心收治其他医院转诊来的患者[1]。《中国2型糖尿病防治指南(2017年版)》明确指出,糖尿病足患者及时转诊或会诊有助于降低截肢率和减少医疗费用;非糖尿病足病专业的医务人员,应掌握糖尿病足需要及时转诊或会诊的指征,一旦出现以下情况,应该及时转诊至糖尿病足病专科或请相关专科医师会诊:皮肤颜色急剧变化、局部疼痛加剧并有红肿等炎症表现、新发生溃疡、原有浅表溃疡恶化并累及软组织和/或骨组织、播散性蜂窝织炎、全身感染征象、DFO等。
本共识在证据等级中等的情况下,强烈推荐建立不同等级的糖尿病足多学科团队和中心,并按照患者病情严重性及时向不同等级的多学科团队或糖尿病足中心请求会诊和/或转诊,不能延误:(1)当糖尿病患者足部出现胼骶、水疱、下肢蜂窝组织炎、足或踝畸形、嵌甲、营养不良趾甲和趾甲真菌感染时,要转诊给1、2级糖尿病足治疗中心多学科团队。(2)当出现严重开放性伤口、重症感染、缺血或坏疽症状、Charcot′s神经关节病(红、热、中足或脚踝肿胀)、新发或加重的疼痛等1种或多种情况时,必须立即转诊至富有经验的3级单科室糖尿病足治疗中心。
推荐15:良好血糖控制(避免低血糖发生),可促进DFU愈合、降低患者足溃疡感染和截肢风险(推荐程度为强,证据等级为中等)
理论依据:DFU愈合过程常受到高血糖的影响,一项观察性研究显示,HbA1c是伤口愈合率的重要临床预测因子,HbA1c水平每升高1%,伤口愈合率降低0.028 cm2/d(95%置信区间=0.003~0.054)[85];HbA1c较高的患者,溃疡愈合时间明显延长[86]。血糖还与糖尿病足患者的预后有关,有研究分析了9个关于不同血糖水平和糖尿病足愈后关系的RCT,10 897例2型糖尿病患者中,强化血糖控制(HbA1c在6%~7.5%)者截肢率低[相对危险度(RR)=0.65,95%置信区间=0.45~0.94;P=0%]、感觉阈值下降慢(平均差=?8.27,95%置信区间=?9.75~6.79)[87];高血糖还易导致糖尿病足伤口发生感染,是强化血糖控制的3.4倍[88]。但最近一篇综述认为,强化血糖控制对DFU是有利还是有害尚不能得出结论[89]。也有研究表明,低血糖同样是糖尿病足截肢的独立预测因素,与低血糖引起应激反应而导致内皮功能障碍和伤口愈合受损有关[90]。总之,本共识在证据质量中等的情况下,仍强烈推荐良好血糖控制(避免低血糖发生)以促进DFU愈合,降低其足溃疡感染和截肢风险。
推荐16:糖尿病足患者合并高血压时,个体化选择降压药物,并将血压控制目标设定为<130/80 mmHg(1 mmHg=0.133 kPa),老年或危重患者放宽至140/90 mmHg(推荐程度为强,证据等级为中等)
理论依据:高血压是糖尿病足患者最常见的并发症。一项多中心前瞻性队列研究对比了中国452例糖尿病足患者和881例糖尿病患者,结果显示,糖尿病足患者高血压发生率为58.6%,明显高于糖尿病患者的49.6%(P=0.002)[91]。另有研究显示,高血压可通过加重PAD,显著增加足溃疡及坏疽发生的风险[92]。最近的一篇回顾性队列研究表明,收缩压与糖尿病足有着密切关系,过度波动的收缩压可增加DFU的发生,同时文中还指出钙通道阻滞剂可降低DFU的发生,这可能与钙通道阻滞剂可稳定收缩压有关[93]。因此,糖尿病足患者需较好地控制血压,但控制目标目前未有定论。基于糖尿病足的整体预防,可参考糖尿病患者血压控制标准,同时制订个体化降压药物治疗方案。
糖尿病足患者的血压控制:(1)2019年的中国糖尿病足防治指南推荐参照《中国2型糖尿病防治指南(2017版)》建议实施。(2)2020年ADA针对糖尿病合并高血压患者,心血管风险较高(合并动脉粥样硬化或10年内发生动脉粥样硬化风险≥15%)的血压控制标准为<130/80 mmHg,心血管风险较低(10年内发生动脉粥样硬化风险<15%)的血压控制标准为<140/90 mmHg[94];有专家共识甚至建议年轻人、蛋白尿和/或伴高血压、≥1个动脉粥样硬化危险因素人群采取低目标,即收缩压目标<130 mmHg、舒张压目标<80 mmHg。(3)但值得注意的是,收缩压不宜低于120 mmHg,有4 733例糖尿病患者参与、平均随访4.7年的控制糖尿病患者血压的心血管风险试验结果显示,强化降压控制目标设定为120 mmHg的患者,致命和非致命主要心血管事件发生率和复合结局并不比目标设定为140 mmHg的患者好[95]。(4)由于老年、合并慢性肾病、身体虚弱以及危重患者强化降压治疗带来的不良风险可能增加[96],因此更倾向于保持相对宽泛的血压标准来提高生活质量,2020年ADA推荐该类人群血压控制目标为140/90 mmHg[51]。
因此,本共识强烈建议糖尿病足患者合并高血压时,个体化选择降压药物,并将血压控制目标设定为<130/80 mmHg,老年或危重患者放宽至140/90 mmHg。
推荐17:糖尿病足患者合并高脂血症时,采取生活方式调整,并根据年龄和有无动脉粥样硬化危险因素决定他汀类药物的使用强度和剂量(推荐程度为强,证据等级为中等)
理论依据:血脂异常是糖尿病患者易合并动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)的主要危险因素之一。糖尿病足患者常合并血脂异常,其中高甘油三酯已经被证明为糖尿病足患者截肢的一个独立危险因子[97]。一项荟萃研究纳入了超过18 000例糖尿病患者数据,平均随访期为4.3年,显示低密度脂蛋白每下降39 mg/dL(1 dL=100 mL),患者全因病死率下降9%、血管相关病死率降低13%[98]。一项多中心前瞻性队列研究显示,高密度脂蛋白与DFU的发生呈负相关[91]。另一项关于脂蛋白与糖尿病足关系的荟萃分析共纳入4项研究,结果显示,高密度脂蛋白的显著降低与糖尿病足的发生相关;DFU组与非溃疡组所有的脂蛋白,包括高密度脂蛋白、低密度脂蛋白、胆固醇以及甘油三酯比较,差异均有统计学意义(P<0.005)[99]。2007年美国心脏协会(American Heart Association,AHA)与ADA共识声明,控制个体心血管危险因素能有效预防或延缓糖尿病患者ASCVD的发生。因此,积极控制糖尿病足患者的血脂水平对其病情发展及预后有重要意义。
糖尿病足患者合并高脂血症需要综合治疗。(1)《中国糖尿病足防治指南(2019版)》推荐参照《中国2型糖尿病防治指南(2017版)》建议实施,同时也可参考ADA 2020年关于血脂异常的建议:①减少饱和脂肪、反式脂肪和胆固醇,增加n-3多不饱和脂肪酸、黏性纤维和植物固醇/甾醇摄入。②对于甘油三酯≥1.7 mmol/L以及高密度脂蛋白<1.0 mmol/L(男性)、<1.3 mmol/L(女性)的患者加强生活方式及血糖控制。③40~75岁糖尿病患者,无脑血管痉挛危险因素患者,推荐使用中等强度他汀类药物。④对于高危糖尿病足患者,特别是有ASCVD危险因素或者年龄在50~70岁的患者,推荐使用高强度他汀类药物。⑤对于所有糖尿病足合并ASCVD患者,应进行生活方式干预及高强度他汀类药物治疗[94]。(2)对于不能耐受高强度他汀类药物治疗的患者,可考虑联合应用中等强度他汀类药物与依折麦布[94]。IMPROVE-IT(improved reduction of outcomes: vytorin efficacy international trial,改善预后:Vytorin疗效国际试验)研究较好证实了这点,认为中等强度的辛伐他汀40 mg联合依折麦布10 mg,相比于单独用辛伐他汀40 mg,使主要心血管不良事件绝对风险下降约5%、RR下降14%(RR=0.86,95%置信区间=0.78~0.94)[100]。
因此,本共识强烈建议糖尿病足患者合并高脂血症时,采取生活方式调整的同时,需根据年龄和有无动脉粥样硬化危险因素决定他汀类药物的使用强度和剂量。
推荐18:糖尿病足患者合并冠心病/外周动脉粥样硬化时,建议每晚给予阿司匹林100 mg治疗;不耐受阿司匹林者,给予氯吡格雷75 mg/d替代(推荐程度为强,证据等级为中等)
理论依据:ASCVD风险<5%的患者,指年龄<50岁且不伴其他危险因素,即早发心血管病家族史、高血压、吸烟、血脂异常或蛋白尿的患者。阿司匹林能有效降低有心梗或卒中史的高危患者心血管发病率和病死率(二级预防);但是对无心血管事件史的糖尿病患者,阿司匹林的净获益争议很大。2010年ADA、AHA和美国心脏病学会基金会的一个立场声明建议,无血管疾病史但ASCVD风险较高(10年ASCVD事件风险超过10%)、出血风险不增加的糖尿病患者,包括大多数年龄≥50岁的男性和年龄≥60岁的女性,有吸烟、高血压、血脂异常、早发ASCVD家族史和蛋白尿等主要危险因素中的1种或多种的人群,应服用小剂量阿司匹林,即75~162 mg/d[101]。不耐受每晚阿司匹林100 mg治疗者,可给予氯吡格雷75 mg/d替代[102]。糖尿病足患者,尤其是合并下肢缺血的患者,常呈血液高凝状态,抗凝治疗可以有效防止血栓形成,包括应用抗血小板药物,阻止血小板聚集,预防血栓形成;应用降纤维蛋白原药物,阻止血小板聚集与黏附,改善血液流变性,抑制血栓的形成;应用扩血管药物,扩血管以降低外周血管阻力,延长移植血管、经皮血管腔内成形术和/或支架的通畅时间,并有利于干细胞分化[103]。因此,本共识强烈推荐,糖尿病足合并冠心病/外周动脉粥样硬化患者,参照10年ASCVD事件风险超过10%标准,每晚给予阿司匹林100 mg治疗;不耐受阿司匹林者,给予氯吡格雷75 mg/d替代。
推荐19:糖尿病足患者合并心功能不全时,行吸氧、镇静、扩血管和利尿等治疗,必要时立即转诊至心脏科或ICU继续治疗(推荐程度为强,证据等级为低)
理论依据:糖尿病足合并心功能不全的治疗,包括以下几个方面。(1)首先需要去除诱因、控制心血管危险因素。(2)吸氧,面罩给氧较鼻导管给氧效果好;严重者给予呼吸机呼气末正压(positive end expirtory pressure,PEEP)通气或持续气道正压(continuous Positive airway pressure,CPAP)呼吸给氧,PEEP从低水平3~5 cmH2O(1 cmH2O=0.098 kPa)开始逐渐增加至合适水平。(3)镇静,在患者极度烦躁时,可静脉用3~5 mg吗啡。(4)在有效循环血容量不足时,应补充足容量以代偿回心血量的不足,并监测中心静脉压以精准补液、防止过量。(5)应用扩血管药物。收缩血压≥100 mmHg时,可给予舌下或静脉滴注硝酸甘油,以迅速降低心脏后负荷,但有引起低血压的可能,收缩血压≤90 mmHg应停止给药。(6)静脉用利尿剂呋塞米或托拉塞米,以降低心脏前负荷;但在血压偏低患者,尤其是合并急性心肌梗死或主动脉狭窄患者慎用或不用。(7)治疗过程中,将B型钠尿肽(BNP)/N末端B型利钠肽原(N-terminal pro-brain natriuretic peptide,NT-proBNP)作为一项有效的监测指标。研究显示,NT-proBNP用于心功能不全诊断的敏感度和特异度均较高,也是一种可量化的指标,指导抗心力衰竭治疗[104];《2018中国心力衰竭诊断和治疗指南》甚至强调,在心力衰竭A阶段(前心力衰竭阶段)和B阶段(前临床心力衰竭阶段),针对危险因素和无症状性左心室收缩功能不全进行及早干预,推荐对心力衰竭高危患者进行BNP/NT-proBNP筛查及干预,可以大大预防或延缓心力衰竭的进展;但值得注意的是,在肾功能不全、房颤、高龄等情况下,NT-proBNP会升高而临床无明显心功能不全表现,密切观察人群心功能情况而无须立即行抗心力衰竭治疗,但已行血液透析人群例外,此时,NT-proBNP升高,仍提示血液透析不充分和/或心功能不全存在可能,需要积极行血液透析和/或抗心力衰竭治疗[105]。(8)其他治疗,按照《2018中国心力衰竭诊断和治疗指南》完成,必要时转诊至心脏科或ICU继续治疗。因此,本共识建议,糖尿病足患者合并心功能不全时,给予吸氧、镇静、扩血管和利尿等治疗,必要时立即转诊至心脏科或ICU继续治疗。
推荐20:按照DVT、出血、压疮和麻醉风险分层的结果,进行糖尿病足患者围手术期相应风险的预防(推荐程度为强,证据等级为中等)
理论依据:高危DVT患者是否进行血栓预防以及预防方法的选择,取决于血栓和出血平衡,且应遵循一系列以证据为基础的流程、指南等。按顺序使用抗凝剂和正确使用分级加压袜和间歇气压加压装置,同时加强术前健康宣教、指导早期锻炼、术中规范手术操作以减少内膜损伤和正确使用止血带、术后抬高患足以促进静脉回流、适度加强补液以避免血液浓缩等基础预防措施。(1)药物治疗。普通肝素、低分子量肝素、Xa因子抑制剂(如利伐沙班、磺达肝素等)、维生素K拮抗剂(华法林)、抗血小板药物(阿司匹林)等药物的作用部位不同,各有利弊,使用时需要的监测方法也不同,例如,华法林口服剂量要根据每3天监测INR来调整,直至INR在1.3~1.5之间再每周监测;排除禁忌后,很多研究推荐皮下注射安全性相对较好的主要抑制因子Xa的低分子量肝素、口服Xa因子抑制剂或非选择性环氧合抑制药阿司匹林[106]。低分子量肝素在预防复发性DVT方面优于普通肝素,至少与普通肝素治疗肺栓塞一样有效;与普通肝素相比,住院或门诊使用低分子量肝素可节省成本或具有成本效益。(2)物理预防措施。①分级加压长袜,有中等到高的研究证据显示,早期使用弹力袜能有效预防血栓形成和形成后综合征;研究显示,发生近端DVT第1个月内就开始使用定制弹力袜至少2年的患者,5年后血栓后综合征(post thrombotic syndrome,PTS)患病率明显降低(轻到中度PTS由47%降至20%,严重PTS由23%降至11%)[107];一项RCT显示,穿戴弹力袜的患者2年后PTS发生率为25%(对照组为49%,危险度=0.49,95%置信区间=0.29~0.84)、严重PTS为3%(对照组为11%)、前6个月内PTS累计发病率为21%(对照组为40%)[108]。②间歇气动加压,充气压为35~40 mmHg、速率约为10次/min,定期对小腿和/或大腿肌肉进行压缩,以模拟走路时的肌肉泵血作用,促进纤维蛋白溶解,并已被证明能降低静脉血栓栓塞的风险[109]。③静脉足泵,通过压缩足底静脉丛在静脉中产生脉动流来模拟正常行走,增加静脉流出和减少淤滞,已被证明能有效降低骨科手术后的无症状DVT的风险,但无证据表明其能降低有症状DVT的风险[110]。④相比于采用全身麻醉,采用下肢局部神经阻滞麻醉(无论是单次注射还是连续输注)的患者DVT形成明显减少,与后者交感神经阻滞引起血管扩张而下肢血流改善有关。⑤腔静脉滤器仅对预防肺栓塞有效;对患肢无法或不适宜采用上述物理措施患者,可在对侧肢体实施预防;需要特别注意的是,对于充血性心力衰竭、肺水肿、下肢DVT已形成、发生肺栓塞或血栓静脉炎、手术区域、下肢血管严重动脉硬化或狭窄等情况慎用或禁用物理预防措施。
按照出血风险分层结果,低风险者以基础预防措施为主;中、高风险者以加强出凝血功能和血红蛋白监测,必要时调整抗凝方案、甚至立即止血为主。临床具体措施包括如下几点:(1)合理使用抗栓抗凝药物。①如果要进行局部麻醉,阿司匹林不会造成风险,但氯吡格雷应在局部神经阻滞麻醉前7 d停用。②长期使用阿司匹林患者宜选择肠溶制剂,不建议餐后服用,多建议睡前服用,以降低胃肠道损伤风险。③阿司匹林和氯吡格雷两者联用双抗时,建议维持6~12个月;其中,消化道出血风险较高者,考虑使用质子泵抑制剂泮托拉唑、雷贝拉唑等。值得注意的是部分质子泵抑制剂可通过P450代谢途径竞争抑制氯吡格雷抗血小板作用,增加血栓形成风险。④低分子量肝素(如依诺肝素)与普通肝素,在血管重建术后即刻使用抗凝的安全性和有效性相同,但应尽量避免在围手术期将两者交叉使用。研究显示PCI术后患者发生大出血比例,随着从依诺肝素到普通肝素(从3.7%到7.8%)和从普通肝素到依诺肝素(从2.5%到8.6%)的交叉而增加[111]。(2)优化介入操作减少血管经路相关出血,股动脉穿刺一般选择腹股沟皮肤皱褶下方2 cm处进针,为减少贯穿股动脉所造成损伤和出血,多只穿通股动脉前壁;对于特别肥胖患者结合病情可选择逆行穿刺,因为顺行穿刺位置较深、压迫困难,可能会有盆腔内出血的风险。(3)对于下肢动脉修补、旁路或斑块切除等较大手术患者,术中应予补液和备血,以减轻低灌注、低容量、缺血等对机体的影响。一项前瞻性、随机、多中心研究表明,与术中未行液体治疗相比,术中液体治疗可以降低术后伤口感染发生率、并减少术后器官功能障碍[112];Cochrane周围血管疾病组回顾了38个RCT的数据后认为,液体类型(电解质和胶体)不影响手术预后[113];一项对危重患者和手术患者的RCT显示,无任何证据表明一种胶体溶液比另一种更有效或更安全,但需要注意的是水合乙基淀粉产品除外,因为证据表明其能导致急性肾脏损伤,风险大于收益[114]。
按照出血风险分层结果,低风险者以基础预防措施为主,中高风险者以加强出凝血功能和血红蛋白监测,必要时调整抗凝方案、甚至立即止血为主。临床具体措施包括如下几点。(1)合理使用抗栓抗凝药物。①如果要进行局部麻醉,阿司匹林不会造成风险,但氯吡格雷应在局部神经阻滞麻醉前7 d停用。②长期使用阿司匹林患者宜选择肠溶制剂,不建议餐后服用,多建议睡前服用,以降低胃肠道损伤风险。③阿司匹林和氯吡格雷两者联用时,建议维持6~12个月;其中,消化道出血风险较高者,考虑使用质子泵抑制剂泮托拉唑、雷贝拉唑等(注意,部分质子泵抑制剂可通过P450代谢途径竞争抑制氯吡格雷抗血小板作用,增加血栓形成风险)。④低分子肝素(如依诺肝素)与普通肝素,在血管重建术后即刻使用,抗凝的安全性和有效性相同,但应尽量避免在围手术期将两者交叉使用。研究显示PCI术后患者发生大出血比例,随着从依诺肝素到普通肝素(从3.7%到7.8%)和从普通肝素到依诺肝素(从2.5%到8.6%)的交叉使用而增加[111]。(2)优化介入操作减少血管经路相关出血。股动脉穿刺一般选择在腹股沟皮肤皱褶下方2 cm处进针,为减少贯穿股动脉造成的损伤和出血,多只穿通股动脉前壁;对于特别肥胖患者结合病情可选择逆行穿刺,因为顺行穿刺位置较深压迫困难,可能会有盆腔内出血风险。(3)对于下肢动脉修补、旁路或斑块切除等较大手术患者,术中应予补液和备血,以减少低灌注、低容量、缺血等对机体的影响。一项前瞻性、随机、多中心研究表明,术中液体治疗可以减少术后伤口感染发生率、并减少术后器官功能障碍[112]。Cochrane周围血管疾病组回顾了38个RCT的数据后认为,液体类型(电解质和胶体)不影响患者手术预后[113]。一项分析了包含危重患者和手术患者的RCT,结果显示无任何证据表明一种胶体溶液比另一种更有效或更安全(水合乙基淀粉产品除外,因为证据表明其能导致急性肾脏损伤,风险大于收益)[114]。
按照HAPU的风险分层结果,高风险者应积极采取多种措施预防压疮。需要关注HAPU的3个方面:护士是否使用有效的风险评估和干预检查表、HAPU风险评估的准确性如何、采用何种HAPU预防策略。临床针对糖尿病足高风险人群可采取以下措施。(1)进行营养状态筛查并制订个体化糖尿病营养治疗方案,如补充蛋白以维持正氮平衡、补液和其他能量摄入等。(2)通过体位变换来解除压力或使压力再分布,避免压疮直接受压并确保足跟不受压。(3)使用局部制剂。有研究观察了不同局部纯化网膜脂质制剂(乳膏、液体、乳剂和清洁剂)和不同局部纯化网膜脂质制剂浓度(10%~25%)预防糖尿病足患者压疮的作用[115]。(4)使用床垫,可最大限度降低HAPU高危患者脆弱皮肤部位的压力强度和缩短时间。英国某医院一项RCT研究显示,交替压力床垫和高规格泡沫床垫对高危压疮患者都有预防性作用[116]。(5)使用各种敷料。有研究观察了5层硅树脂骶骨泡沫敷料在血管外科患者中的作用,结果显示敷料组仅有1例患者发生HAPU(发生率=2%,对照组发生率>50%,P=0.0001),在进一步纠正了年龄、性别和其他并发症对研究结果的影响后得出结论,应用5层硅树脂骶骨泡沫敷料能明显降低新发HAPU的可能性[117]。
按照糖尿病足患者的麻醉风险分层结果,严格控制其血糖和选择麻醉方式。我国糖尿病足溃疡患者总截肢率约19.03%,其中大截肢和小截肢分别为2.14%和16.88%[118]。在维持稳定血流动力学并降低麻醉风险的同时,如何保证足够的麻醉和镇痛效果是一个挑战。(1)将患者血糖控制在合理范围内,若仍为高血糖则取消手术。目前虽无循证医学证据,但原则上有酮症酸中毒或糖尿病高渗性昏迷等时,不做选择性手术。(2)麻醉方式的选择。①周围神经阻滞(peripheral nerve block,PNB)麻醉为首选,其能更好地稳定血流动力学[73]和控制术后疼痛。有RCT研究对比了PNB与蛛网膜下腔阻滞(subarachnoid block,SAB)麻醉对糖尿病足患者血流动力学和疼痛的影响,SAB组发生低血压患者较多(14例与1例,P=0.001)及需要血管加压素治疗的患者也更多(6例与0例,P=0.001),PNB组患者术后无疼痛时间更长(9 h与4.54 h,P=0.05)、术后1 d疼痛评分更低(3.63分与4.69分,P=0.01)[74]。一项回顾性研究则观察了瑞芬太尼全身麻醉和腘窝坐骨神经阻滞对糖尿病足远端截肢患者术后疼痛和血流动力学稳定性的影响,结果显示腘窝坐骨神经阻滞组患者术后6 h内的哌替啶用量减少[(27±28)mg与(9±18)mg,P=0.013],GEA组患者尽管接受了较多麻黄素(P<0.001)但平均血压仍然较低(P<0.01)、术后肺炎患者明显增多(P=0.030)、需要ICU管理患者也增多(P=0.038)[119]。故本共识也推荐腘窝坐骨神经阻滞作为首选。②硬膜外阻滞麻醉并不安全,其会抑制儿茶酚胺释放而阻碍手术应激性高血糖发生,以及因患者韧带钙化、骨质增生以及椎间隙变窄等问题存在使得椎管内麻醉穿刺成功率降低、出血和神经损伤风险增加,又易出现低血压,甚至可诱发心脑血管意外[75],故本共识不作推荐。因此,本共识建议,按照静脉血栓栓塞症(venous thromboembolism,VTE)、出血、压疮和麻醉风险分层的结果,进行糖尿病足患者围手术期相应风险的预防。
近年来DPN对症治疗进展明显,但针对DPN病因、延缓甚至逆转DPN方面,仍然缺乏有效手段;一些药物虽已被研发,但相关RCT研究证据不多。
推荐21:针对病因,积极控制高血糖并保持血糖稳定是DPN治疗的基础(推荐程度为强,证据等级为高)
理论依据:对于1型糖尿病而言,大型临床研究均证实良好的血糖控制有助于减少神经性并发症,在糖尿病控制和并发症试验以及糖尿病干预和并发症流行病学研究中,经过5年"强化"治疗,1型糖尿病患者的神经病变较传统治疗明显减少(通过神经传导速度检测);该研究还对自主神经病变进行了观察,同样得出"强化"治疗对于延缓自主神经病变进展有益;即使在研究结束了13年之后,回访这些患者,仍然可以见到当年"强化"治疗的获益[120]。然而对于2型糖尿病,大型临床研究荟萃分析显示,严格的血糖控制对减少神经并发症有帮助,但缺乏统计学意义(P>0.05);一些后续分析显示强化干预血糖可以改善神经传导及VPT。这可能与2型糖尿病发病机制更为复杂有关,其需要综合代谢管理(血糖、血压、血脂、体质量等)方能改善神经病变预后。研究还证明血糖波动对DPN的发生和发展有影响[121]。在发生足溃疡之后,血糖应该如何控制?目标值多少?是否需要进行强化胰岛素治疗?这些问题尚没有一致答案。大多数指南建议空腹血糖<7.8 mmol/L,随机血糖<10 mmol/L。但这些推荐并不单独针对糖尿病足情况下的神经病变管理。值得注意的是强化干预血糖会增加体质量、增加低血糖等风险,且若短期内快速降低严重高血糖可能会诱导"治疗相关性DPN"(或称为胰岛素所致神经炎),故其风险获益比有待探讨。尤其是糖尿病足患者往往病程较长,胰岛功能较差,低血糖发生率高于普通糖尿病患者,且这些患者合并心脏自主神经病变较为普遍,故一旦发生低血糖,其通过交感系统、胰高血糖素进行调节的能力也相应下降,称为低血糖相关的自主神经功能衰竭。由此导致患者发生心脑血管事件风险显著增加,需提高警惕。鉴于以上证据,本共识强烈建议,积极控制高血糖并保持血糖稳定是DPN治疗的基础。
推荐22:针对DPN病理生理学改变、微循环病变、神经营养和修复异常等方面进行治疗,一定程度上能改善周围神经功能(推荐程度为弱,证据等级为低)
理论依据:基础和临床研究证实,氧化应激和多元醇通路中醛糖还原酶被激活是DPN重要的病理生理学改变和发病环节,理论上抗氧化剂、醛糖还原酶抑制剂应能明显改善DPN预后,但事实并非完全如此。(1)α硫辛酸,是目前循证医学证据证明具有确切疗效的抗氧化剂。Ziegler等[122]为了验证每日600 mg的α硫辛酸持续3周静脉注射对有症状DPN是否有效,2004年荟萃分析了4个随机双盲安慰剂对照研究,共涉及1 258例患者,结果显示,症状和体征总积分(total symptom score,TSS)、下肢神经病变缺陷评分(neoropathy impairment score in the lower limbs,NIS-LL)等方面,α硫辛酸治疗均优于安慰剂,但神经传导速度和神经纤维密度等客观指标是否得到改善并不明确;在α硫辛酸在糖尿病神经病变中的应用研究中,采用了α硫辛酸3周静脉滴注加随后6个月口服,观察指标为TSS、神经残疾评分(neurological disability score,NDS)、神经系统症状评分(neurological symptom score,NSS)及汉堡疼痛形容量表(hamburg pain adjective list),未得到有意义的阳性结果[123,124];同样在2006年在一项评估α硫辛酸对糖尿病患者远端对称性多神经病变治疗的研究中,观察患者口服α硫辛酸5周带来的症状变化,观察指标为TSS、神经症状改变评分(neurological symptom change score,NSCS)等,结果表明患者症状评分可改善[125]。(2)依帕司他,是目前唯一上市的醛糖还原酶抑制剂。研究显示,依帕司他每次50 mg,3次/d能改善周围神经的病理结构和电生理异常、进而改善DPN症状和某些神经电生理指标。依帕司他最重要的临床证据来自Hotta等[126]在日本进行的3年多中心醛糖还原酶抑制剂-糖尿病并发症试验,涉及了600余例患者口服依帕司他(每次50 mg,3次/d,疗程3年),对照组为常规治疗,观察采用了NCV、最短F波潜伏期、VPT等客观量化指标,结果显示,长期口服依帕司他治疗具有改善上述客观指标的效果;在该研究随后的观察中,还得出依帕司他具有改善视网膜病变和肾病的效果。但由于其他相关RCT研究较少,循证医学证据仍然不够充分,且有可能升高肝酶等原因,该药在欧洲及美国尚未获批上市。(3)乙酰左卡尼汀(ALC)是线粒体内肉碱的乙酰化衍生物,在产能过程中具有重要作用,从而对神经系统具有细胞保护、抗氧化、抗凋亡作用,并能通过减少突触的谷氨酸浓度起到止痛作用,也能促进神经创伤后再生修复、增强神经生长因子作用。一项RCT研究对333例DPN患者肌内注射ALC 1 000 mg/d、共10 d,再口服2 000 mg/d、共1年,显示ALC可改善外周神经传导速度及疼痛VAS评分[127]。2个多中心RCT,分别用ALC 500 mg 3次/d、ALC 1 000 mg 3次/d,共计治疗1 257例患者52周,患者腓肠神经纤维数量和再生神经纤维束明显增加、神经传导速度没有改善,1 000 mg 3次/d组疼患者痛还得到了明显改善[128]。国内较大规模的多中心随机双盲阳性对照研究,观察了232例DPN患者分别使用ALC 500 mg 3次/d或甲钴胺0.5 mg 3次/d、共24周的疗效,认为ALC与甲钴胺在改善症状评分及神经电生理参数方面疗效相当[129];由于ALC在国内外上市并获批用于治疗糖尿病神经病变时间较短,仍需要长期大规模RCT进行验证。
微循环病变对于糖尿病足的发生发展具有重要作用。在DPN的发生过程中,神经周围及神经内部的微循环障碍能引起神经营养动静脉之间的微循环闭塞或短路,导致神经纤维的供氧、供能减少甚至丧失。(1)前列腺素E1,可通过增加血管平滑肌细胞内的环磷酸腺苷,发挥扩血管作用,并可抑制血小板凝集与活化、降低血液黏稠度,改善微循环。一项小规模RCT显示,前列地尔10 mg/d,持续2周,可缓解DPN症状、改善感觉阈值[130]。另一项小规模RCT显示,贝前列素钠40 μg 3/d,持续8周,能改善DPN症状评分[131]。(2)胰激肽原酶,可降解激肽原、生成激肽,扩张小血管和毛细血管、激活纤溶酶原转变为纤溶酶,从而起到改善循环作用。一项病例对照研究比较了胰激肽原酶和前列腺素E1对DPN的疗效,采用密歇根神经病变筛选法、神经症状及NCV作为观察指标。研究显示,胰激肽原酶与前列腺素E1相比,同样能改善DPN症状及神经传导速度,疗效相当且更为价廉;2组疗效均优于普通对照组[132]。其余改善循环药物(西洛他唑、己酮可可碱等)临床有一定疗效,但因缺乏足够证据,本共识目前不作推荐。
神经营养与修复在糖尿病足发病和愈合过程中同样重要。目前能改善DPN营养与修复的药物目前有两大类,B族维生素(如甲钴胺)和神经生长因子。(1)甲钴胺,为内源性维生素B12,可促进轴索内输送和轴索再生及髓鞘的形成,防止轴突变性,修复被损害的神经组织。最早的一项RCT观察了50例患者,采用周围神经系统及NCV作为观察指标,口服甲钴胺每次50 mg,3次/d,连续服用4个月,结果显示患者的临床症状和神经传导明显改善[133]。另一项随机双盲双模拟的将左卡尼汀与甲钴胺进行比较的2期临床研究中,口服甲钴胺每次50 mg,3次/d共24周可以明显改善NDS、NSS评分和NCV[129]。(2)重组人神经生长因子(rhNGF),在DPN治疗中的作用仍有待于进一步研究。研究显示其对DPN症状缓解及神经传导具有改善作用[134];但另一项大规模3期RCT研究,入选了1 019例DPN患者,观察指标为NIS-LL评分、定量感觉测定、NSC、患者获益问卷(patient benefit questionnaire,PBQ)、整体症状评分、NCV、新发足部溃疡等,经过12个月的治疗,除了整体症状评分和个别PBQ结果略显rhNGF有效外,其余观察指标均差异无统计学意义(P>0.05)[135]。鉴于以上研究,本共识仅对甲钴胺治疗DNP作弱推荐,对重组人神经生长因子目前不作推荐。
最后,中医中药治疗DPN,目前有很多研究在进行中,值得期待。中医针对DPN多采用补气、滋阴、补益肝肾、活血化瘀、通络、熄风、化痰等方案,含有黄芪、三七、银杏叶等的制剂均有一定临床疗效,尤其是在改善主观症状方面。此外对于无溃疡的高危足,可以采用针刺、中药熏蒸、泡洗、艾灸等方法来改善患者症状,但要求患者在正规医疗机构进行上述治疗。
上述用药证据及推荐均未特别针对患有糖尿病足病的患者,因为往往需要长期治疗方可改善糖尿病神经病变,治疗越晚、疗程越短,其效果越差。故这些药物均推荐用于糖尿病足部畸形及溃疡的预防,在足病急性期及恢复期使用是否能改善预后,并无充分证据。由于证据等级较低,本共识仅作弱推荐,针对DPN病理生理学改变、微循环病变、神经营养和修复异常等方面进行治疗,一定程度上能改善周围神经功能。
推荐23:DPN患者疼痛时,某些抗惊厥药和抗忧郁药为一线用药,阿片类不能作为一线或二线推荐(推荐程度为强,证据等级为中等)
理论依据:DPN所致的疼痛为神经病理性疼痛,在排除血管狭窄、闭塞导致的疼痛后,可选择如下止痛药物。(1)抗惊厥药,普瑞巴林与加巴喷丁。对于糖尿病神经病理性疼痛有效且同时具有剂量依赖性(例如,一些阴性结果的研究多采用普瑞巴林150 mg/d的剂量,而得到阳性结果的研究多采用的是300~600 mg/d的剂量)。研究显示,普瑞巴林300~600 mg/d不仅可以有效地缓解疼痛,也能改善因疼痛导致的睡眠障碍,嗜睡(26%)、头晕(24%)、周围性水肿(13%)、体质量增加(11%)是普瑞巴林的常见不良反应[136]。采用加巴喷丁900~3 600 mg/d治疗糖尿病神经痛也取得了较好的疗效,与安慰剂比较能明显改善疼痛并提高生活质量及改善情绪,头晕(24%)、嗜睡(23%)与精神错乱(8%)是其主要不良反应[137]。(2)抗忧郁药物,包括度洛西汀、阿米替林、丙米嗪和西肽普兰等。一项涉及23个临床研究的荟萃分析证实了度洛西汀60 mg/d、应用6个月对于糖尿病神经病理性疼痛的疗效明显优于安慰剂;在阿米替林、度洛西汀、普瑞巴林的随机双盲头对头研究中,采用阿米替林25 mg 2次/d、应用2周,后加至25 mg(早)~50 mg(晚)继用2周,得出阿米替林在止痛方面与度洛西汀60 mg/d应用2周~60 mg 2次/d继用2周、普瑞巴林150 mg 2次/d应用2周~300 mg 2次/d继用2周无明显区别[138,139]。(3)阿片类药物(曲马多和羟考酮)。一项涉及9项临床试验的荟萃分析得出其能够有效地减轻神经病理性疼痛程度,并对疼痛激发如机械性痛觉过敏、温度性痛觉过敏均有改善作用;其中,羟考酮控释片对糖尿病性神经痛具有显著疗效;主要不良反应为恶心、便秘和困倦,发生率大于30%[140]。(4)辣椒素,外用制剂主要用于疼痛局部,全身不良反应少,适用于无法吞服口服药的患者。其中,辣椒素乳胶,为非处方药,虽然在欧洲已被批准用于治疗痛性DNP,但仅有少数研究得出其有缓解疼痛的作用。一项包含6项临床研究的荟萃分析更显示低浓度辣椒素乳胶外涂对于缓解神经病理性疼痛疗效并不十分确切[141]。较高浓度的辣椒素贴剂暂未被欧美批准用于糖尿病患者,主要不良反应为皮损、皮炎等。
目前国内外指南(美国临床内分泌协会指南、美国神经病学学会指南、欧洲神经科学协会联盟指南、英国国家卫生与临床优化研究所指南、多伦多共识以及中国2型糖尿病防治指南)多将普瑞巴林(300~600 mg/d)、加巴喷丁(900~1 800 mg/d)、度洛西汀(60~120 mg/d)、阿米替林(50~200 mg/d)列为一线药物;当第一线常规用量的药物疗效不佳,可以换用另一种一线药物,或将原有药物加量,或联合使用另一种不同作用机制的一线药物。因此,本共识建议,DPN患者疼痛时,某些抗惊厥药和抗忧郁药为一线用药,阿片类药物多在其他药物失效后使用,不作为一、二线推荐。同时本共识建议参照《中国糖尿病足防治指南(2019版)》对DPN人群进行止痛治疗。
推荐24:糖尿病足溃疡经过6周以上积极治疗,仍无明显愈合迹象,不管无创检查结果如何,可考虑直接行血管造影,必要时血管重建术(推荐程度为强,证据等级为低)
推荐25:既往行血管重建手术的糖尿病足患者,术后症状恢复或者检查结果提示合并中重度下肢缺血,不论手术时间远近,都应该重新评估当前下肢血管情况,再决定下一步治疗方案(推荐程度为强,证据等级为低)
理论依据:2019年IWGDF指南指出,当糖尿病足患者群出现以下几种情况时,要考虑行血管造影和血管重建术。(1)趾压力<30 mmHg或TcPO2<25 mmHg。(2)足溃疡4~6周经积极治疗仍未见好转,①不论床边检测结果如何;②合并微血管病变存在时,不能将其当作是导致足溃疡不愈合原因,而应考虑其他可能因素。(3)其中,踝压<50 mmHg或踝肱指数<0.5时要考虑紧急血管造影和血管重建术[1]。值得注意的是,(1)踝肱指数,在预测溃疡愈合方面几乎没有价值,却能预测截肢风险(踝肱指数<0.5和/或踝关节压力<50 mmHg,截肢风险更高);(2)血运重建术后8周缺血性糖尿病足溃疡的愈合率最高;(3)肢体出现严重缺血表现,未能及时进行血管重建术,延迟2周以上时患者截肢率升高[142]。因此,结合临床工作的实际情况,本共识建议,糖尿病足溃疡合并下肢动脉缺血的人群,创面积极处理6周以上,无明显愈合的迹象,除外其他影响伤口愈合不良的可能原因后,不管检查结果如何,均不能排除合并下肢动脉缺血的诊断,应考虑行血管造影或血管重建。
推荐26:术前应充分评估心血管危险因素、充分考虑手术获益是否大于手术风险、详细术前讨论方案,并与患者及家属沟通手术方案及注意事项(推荐程度为强,证据等级为低)
理论依据:缺血性糖尿病足合并感染的人群,需要对其进行紧急评估和治疗,而治疗不仅困难、风险也大(围手术期死亡率达5%),截肢甚至死亡风险高。有研究显示,血管重建术后1年保肢率约70%、但1年死亡率高达约40%[143]。有几个观察性研究显示,严重缺血性糖尿病足溃疡人群未行血管重建术,溃疡愈合率(通过或不通过小截肢)甚至接近50%,所以当血管重建的风险高,风险-效益比率不清楚时,在临床决策中应充分考虑到人群是否能获益,详细术前讨论方案,并与人群及家属沟通手术方案及注意事项,包括心血管相关检查,心电图、心脏超声,必要时心脏CTA或冠脉造影检查;从人群的角度来看,对于手术成功率的风险-效益比不利的人群,应避免血运重建[60,144]。因此,本共识建议,临床需要充分评估患者的心血管危险因素、充分考虑手术获益是否大于手术风险、详细术前讨论方案,并与人群及家属沟通手术方案及注意事项;如果手术风险远远大于手术获益、伤口无愈合可能性或者截肢无法避免时,不应再考虑血管重建术(股动脉或腘搏动消失,为了降低截肢平面情况除外)。
推荐27:糖尿病足溃疡合并PAD患者进行血运重建时的目标是,恢复至少1条足动脉的直接血流,最好是溃疡解剖结构内的动脉(推荐程度为强,证据等级为低)
推荐28:糖尿病足合并外周动脉病变,可采取旁路移植术和腔内治疗2种方法重建血运;目前无充分证据证明,哪一种方法更优(推荐程度为强,证据等级为中等)
理论依据:有5个高偏倚风险的回顾性研究根据血管分布区域,将足部组织分为3大块、每个都有自己的供血动脉,直接血运重建导致足溃疡区域内供血动脉血流恢复、而间接血运重建则通过邻近血管侧枝来恢复足溃疡区域内供血[145]。研究显示,满足以下任何一项,皮肤灌注压≥40 mmHg、脚趾压力≥30 mmHg,或者TcPO2≥25 mmHg,糖尿病足溃疡愈合率会提高至少25%;下肢血管重建术能使得12个月内患者的保肢率为80%~85%、溃疡愈合率>60%[146]。直接血运重建的保肢率和溃疡愈合率都更高,一项包含101例血管再通手术的研究,结果显示,单支血管再通和多支血管再通相比,12个月时溃疡愈合率、24个月时保肢率无差异,说明对于接受膝下血管内手术的患有缺血性溃疡的严重下肢缺血(critical limb ischemia,CLI)糖尿病患者,如果至少获得一条未闭血管并将血流恢复到足部局部缺血区域,预期会有更好的结果[147];另一项研究认为直接和间接血运重建术后足溃疡的治愈率显著增加(分别为69%和47%),但肢体修复效果无任何差异[148];其他研究[149]也有类似性结果。
缺血性肢体的血运重建方法,包括旁路手术和经皮血管腔内治疗。TASCⅡ指出对表现为缺血性静息痛、溃疡或坏疽的CLI人群,应该进行血运重建,但如何选择最佳的血运重建方式目前仍缺乏证据。目前仅有1项临床RCT比较了旁路移植术和经皮腔内血管成形术对CLI的疗效,研究并未得出2种治疗方式在无截肢存活、治疗费用、生活质量方面存在差异[150]。现在的趋势越来越倾向于首先腔内治疗,但是回顾性文献表明,腔内治疗后期需要再次干预治疗的概率增高,尤其是对于血管长段闭塞病变的人群。另外,主诊医师的经验和擅长的技术、各地医院的仪器设备等因素,也直接影响最后血运重建的治疗效果。临床需要根据人群疾病的特点,尤其是有无合并症、有无可供移植的体静脉,还必须根据医师的技术、当地的医疗设备和医疗水平等情况来确定下肢血管重建与否和手术方式(见图8)。

总之,本共识建议,糖尿病足溃疡合并PAD人群,可采取旁路移植术和腔内治疗2种方法进行血运重建;目标是恢复至少1条足动脉的直接血流,最好是溃疡解剖结构内的动脉。
推荐29:下肢动脉重建手术,要求由专业人员在年开展一定的血管重建病例数的糖尿病足中心内完成(建议每年>20例)(推荐程度为强,证据等级为低)
理论依据:最新IWGDF指南指出,接受血管重建术患者围手术期死亡风险增加(围手术期死亡率5%,1年死亡率40%,1年保肢率约70%)[1]。有大型研究评估了22 6501例下肢血管重建术患者(10 4491例为腔内成形术,12 2010例为开放血管旁路术),结果显示,开放血管旁路术组患者的安全指数为7.74%,明显低于腔内成形术患者的8.51%(P<0.0001);腔内成形术组患者术后出血或血肿的发生率为4.74%,使得患者死亡可能性增加到几近3倍;安全指数预测因子包括高龄、女性、黑肤色、充血性心力衰竭(比值比=1.83,95%置信区间=1.72~1.96)、糖尿病(比值比=1.20,95%置信区间=1.12~1.28)、肾功能衰竭(比值比=2.31,95%置信区间=2.14~2.50)、医院教学状况以及较大医院[151]。下肢血管重建手术治疗安全有效,可明显改善临床症状,可有效避免截肢或降低截肢平面,但目前国内只有少数医院能开展下肢血管重建手术。任何糖尿病足治疗中心都应具备PAD专业知识的人才,并能快速获得诊断和治疗所需的设施和技术(包括血管内技术和旁路手术),以确保能为患者进行血运重建手术、并在手术后得到多学科团队的综合治疗。因此,本共识建议,在符合人才、设备和技术等条件的医院大力推广下肢血管重建技术,力争要求由专业人员在年开展一定下肢血管重建病例数的糖尿病足中心内完成,建议每年>20例[参照欧洲血管外科学会2019年腹主动脉-髂动脉动脉瘤临床实践指南(clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms)[152]给出的推荐模式],本共识鼓励各中心在今后的工作中进行大样本量随机对照临床研究加以证实。总之,糖尿病足外周动脉病变的诊治建议,各单位应依据人群情况及自身条件合理选择。
推荐30:根据临床感染的严重性、细菌培养和药物敏感试验结果,以及机体肝肾功能等因素的综合判断,来确定糖尿病足感染的抗生素使用(剂型、剂量、给药方式和疗程)(推荐程度为强,证据等级为高)
理论依据:在细菌培养和药物敏感试验的基础上,窄谱、大剂量、短疗程是理想糖尿病足感染的抗菌方法;早期往往是经验性用药[153]。导致抗生素治疗失败的因素很多,包括组织取样不准确、培养结果延迟或不准确、药物过敏和多药耐药生物出现等,这些都会使抗生素选择变得复杂而多变[154]。即使是抗生素选择合适,也会有抗药性微生物出现、二重感染等问题存在。(1)任何抗生素,包括β内酰胺类、林可酰胺类、喹诺酮类和碳青霉烯类抗生素(尤其是第三代头孢菌素、克林霉素以及哌拉西林/他唑巴坦),都会导致艰难梭菌感染,尤其是65岁以上、免疫抑制者、住院患者、服用质子泵抑制剂以及以前有过艰难梭菌感染的患者[154]。(2)所有β内酰胺类、喹诺酮类和大环内酯类抗生素都与耐甲氧西林金黄色葡萄球菌(MRSA)的产生有关,有研究认为,MRSA没有表现出比非MRSA更强的毒力,但抗菌治疗的效果降低了。(3)碳青霉烯治疗导致念珠菌过度生长,并促进耐药大肠菌群的形成[155]。
抗生素使用,包括药物剂型、剂量、给药方式和疗程的选择,需要考虑多种因素,包括感染程度、前3个月抗生素使用史和是否合并DFO,感染病原微生物(厌氧菌、多药耐药菌,如MRSA、局部抗生素耐药性等)情况[1],患者本身情况(某些抗生素过敏、免疫状态受损、患者治疗意愿和依从性、肾或肝功能不全、胃肠道吸收障碍、影响肢体的外周动脉疾病、多药耐药菌感染风险或不寻常病原体感染)等。2012年IDSA指南指出,DFO时,接受清创且术后无残留组织感染的患者,抗生素疗程为2~5 d;有残留软组织感染的患者,抗生素疗程为2~4周;有残留(但可存活)骨感染的患者,应接受4~6周的抗生素治疗[156]。已有多项研究证实该指南抗生素疗程推荐的合理性,其中一项回顾性(非随机)研究调查了40例截肢术后感染的糖尿病足患者用5 d抗生素和用24 h抗生素的区别,结果得出5 d抗生素组的住院时间少(分别为22、34 d,P=0.001)[157]。另一项针对302例血管重建术后患者的研究,相比于单次抗生素使用(18%),多次抗生素使用组的伤口感染率较低(10%,P=0.04)[158]。
本共识建议,根据临床感染的严重性、细菌培养和药物敏感试验结果,以及机体肝肾功能等因素的综合判断,来确定糖尿病足感染的抗生素使用(剂型、剂量、给药方式和疗程)。(1)所有临床感染的糖尿病足伤口都需要抗菌治疗,临床未感染的伤口则不需要。(2)在细菌培养和药物敏感试验未明确前,根据感染的临床表现和血液学指标、肝肾功能等综合评估,给予经验性用药,例如,缺血足感染常定植厌氧菌,优先推荐第四代莫西沙新或第三代头孢/甲硝唑结合,同时最初就立即给予口服或静脉抗真菌治疗;在获得细菌培养和药物敏感试验结果后,根据感染已经控制的情况和药物敏感试验结果酌情调整抗生素。(3)轻度感染、营养状态良好、入院前尚未应用抗生素的人群,以金黄色葡萄球菌、停乳链球菌感染多见,青霉素类作为首选,疗程1~2周比较合适。(4)中重度感染,以变形杆菌、大肠杆菌、铜绿假单胞菌等革兰阴性杆菌感染常见,氨基糖苷类、三代头孢及碳青霉烯等首选,甚至需要对革兰阳性菌和革兰阴性菌全覆盖,等细菌培养及药物敏感试验报告出来后再调整;起初需要肠外治疗,感染控制后选择口服制剂。(5)与国际指南一致,本共识特别不推荐那些以抗感染为目的敷料。市面已有很多种这样的敷料,碘制剂(抗菌谱较广)、磺胺嘧啶银和各种含银敷料(对葡萄球菌,甚至MRSA和假单胞菌都有很好疗效);莫匹罗星(对革兰阳性菌,包括MRSA效果都不错);多黏菌素B(对铜绿假单胞菌、大肠杆菌等有作用),但无一例外,它们都缺乏大型RCT研究来支持且在抑制伤口生长的问题上有待进一步研究。
推荐31:重度感染合并脓毒症患者,建议积极处理足溃疡局部与全身相关治疗,包括重症监护,并联系有糖尿病足专科的医院(推荐程度为强,证据等级为中等)
理论依据:糖尿病足合并重度感染时,常有脓毒症发生。脓毒症是由感染引起的SIRS)可发展为严重脓毒症和脓毒性休克。脓毒症的早期诊断非常重要,是降低脓毒症所致MODS病死率的重要前提。一项包含30个临床试验的Meta分析显示,应用降钙素原诊断脓毒症的敏感度为77%(95%置信区间=72%~81%),特异度为79%(95%置信区间=74%~84%),ROC曲线下面积为0.85(95%置信区间=0.81~0.88),提示降钙素原是重症人群脓毒症早期诊断的有效指标[159]。若确诊严重脓毒症或脓毒性休克,尽应早静脉应用抗菌药物以及行液体复苏。研究显示,严重脓毒症或脓毒性休克的早期识别及早期治疗能降低脓毒症相关病死率、改善预后[160]。基于以上证据,本共识建议,糖尿病足合并脓毒症人群,应积极处理足溃疡局部与全身相关治疗,包括重症监护,并联系有糖尿病足专科的医院。
严重糖尿病足感染,除抗生素和支持治疗外,还包括彻底清创。然而,缺乏经验的外科医师往往会低估感染的程度,出现清创不充分,导致需要反复手术、住院率高和住院时间延长等问题发生。
推荐32:糖尿病足溃疡清创方法的选择要个体化(推荐程度为强,证据等级为中等)
理论依据:糖尿病足清创治疗,主要包括排出脓液和清除所有坏死和感染的组织;有不同分类方法,机械性清创和非机械性清创、锐性清创和柔性清创、选择性清创和非选择性清创等。研究显示,清创次数与患者的入院率、重复清创率、住院时间和住院成本有相关性[161]。其中,锐性清创和柔性清创是一种按照清创强度的划分方法。(1)锐性清创,是用手术刀片清理角化边缘和溃疡基底,直到出血为止,能最快且彻底地将坏死组织及碎片从创面床清除,但对医师的外科技术和解剖学知识要求高、且会使创面扩大、患者有疼痛感。(2)柔性清创,是有选择性、组织损伤小的机械和/或器械清创术[162],包括①湿-干(wet-to-dry)法,先用湿纱布覆盖创面床,待纱布变干,失活的组织黏附在纱布上随黏附物质被带走;这是标准的机械性清创技术,不能区分好组织和坏死组织,且可能会引起疼痛。②自溶性清创及酶学清创,利用伤口内自身的溶酶或某些具有蛋白水解作用的外源性酶类,将坏死或失活的组织液化、软化、去除坏死组织和纤维蛋白原覆盖物,同时又不损害邻近正常组织,从而达到清创的目的;自溶性清创常用敷料为水凝胶、水胶体或藻酸盐敷料;酶学清创常用辅料有枯草菌酶、胶原酶等。④水刀清创,通过水流、器械搔刮等方法去除伤口内的腐肉、组织碎片、异物和杂质等使创面清洁。⑤超声刀清创,该方法利用超声波的空化、乳化和止血效应,在冲洗射流中通过空化微射流和强大的压力去除创面表面和深层的细菌和真菌,能够涤荡污染伤口的异物,有效清除细菌,促进创面愈合。⑥生物清创,将丝光绿蝇的无菌蛆直接放在感染的创面上,利用蛆虫消化坏死组织和病原体特性进行清创,更适合开放性创面,大血管附近或可疑癌性创面不适合。有系统性研究回顾分析了13个干预研究(10个RCT和3个非随机研究),偏倚风险中等情况下,有3个RCT研究认为自溶清创比标准清创愈合率高(RR=1.89;95%置信区间=1.35~2.64);另外有4个RCT认为蛆虫清创能降低截肢率、但在创面愈合率方面无优势;还有1个RCT认为外科清创比常规治疗的创面愈合时间短,且超声刀和水刀都各有优势[163]。因此,本共识建议,临床应根据糖尿病足患者心肺功能等基础情况、足部组织破坏程度、创面迁延范围和路径、下肢是否合并有缺血、专业知识和物资可用性、患者耐受性和选择,以及成本效益等,来个体化选择清创方式、清创频率和清创范围。
推荐33:对于部分中度和所有重度感染性糖尿病足溃疡,尤其是合并脓肿、湿(气)性坏疽或坏死性筋膜炎时应行紧急清创手术(推荐程度为强,证据等级为中等)
理论依据:从外科医师的角度来看,区分不威胁肢体的感染和威胁肢体的感染很重要,早期积极的手术干预可减少踝关节以上截肢。一项回顾性研究显示,将112例糖尿病足感染患者分成前3 d仅用抗生素组和前3 d用抗生素加外科干预组,结果显示,前3 d仅用抗生素组的踝关节上截肢率(27.6%)明显高于前3 d用抗生素加外科干预组(13%,P<0.01)且住院时间至少多6 d,说明及早清创治疗有助于保肢成功、缩短住院时间;还有研究认为早期清创能节省医疗费用[164]。因此,本共识建议,部分中度和所有重度感染性糖尿病足创面,尤其是合并脓肿、湿(气)性坏疽或坏死性筋膜炎的足部感染,应尽早行清创术,以切开、引流通畅为目的,切忌挤压以避免感染扩散。此时需特别注意的是(1)任何抗生素都不能替代清创引流的作用,不能人为延误手术清创的时机;(2)要仔细判别干痂下的创面是否稳定,尤其是否有坏死组织,甚至脓肿的存在。可通过局部有无波动感、周围组织有无红肿、检验炎症指标有无异常、超声探查或X线检查结果等综合判断,一旦怀疑为不稳定干痂,立即切开引流、降低创面内压力。
推荐34:缺血性糖尿病足合并感染时,应遵循先切开引流和清理坏死组织(不扩创)以控制急性感染,在下肢血供恢复后再彻底清创的原则(推荐程度为强,证据等级为中等)
理论依据:糖尿病足感染时,及时和充分局限性切除或截肢等清创治疗,能降低截肢的可能性,但在下肢缺血的情况下,清创的时机、方法、范围等值得商榷。2012年IDSA指南指出,感染合并缺血的糖尿病足溃疡患者应该及时被转诊给血管外科医师,以进行血管评估和治疗。包括一项RCT研究在内的诸多文献认为,下肢缺血时,不仅抗生素疗效差,还可能存在以下几种情况:(1)不重视缺血,盲目进行不恰当的锐性清创,可能带来的微血管血栓形成,使溃疡加深加重;(2)如果缺血问题解决,而清创又不及时,则足部感染可能会加重,甚至发生脓毒血症[165];此时,需要的最佳外科治疗是联合(多专业)、多个或分阶段的手术。因此,本共识建议,糖尿病足溃疡合并肢体严重缺血时,应遵循"先切开引流和清理坏死组织(不扩创)以控制急性感染,在下肢血供恢复后再彻底清创"的处理原则。
推荐35:有骨质破坏,保守治疗无效时,根据术前影像学检查、组织病理学或细菌学结果确定手术骨切除范围;并根据足部生物力学已有的改变,选择骨性重建方法;感染导致的骨缺损,必要时可在骨切除部位用含有敏感抗生素的材料(骨水泥、生物陶瓷等)临时性填充空腔,后期再行骨性重建手术(推荐程度为强,证据等级为中等)
理论依据:骨性清创手术能通过清理糖尿病足DFO病灶、促进创面愈合,降低踝关节以上截肢的发生率,并通过相应矫形方法提供稳定的跖行足。关于糖尿病足DFO手术治疗,也有不同观点,一项针对无缺血或坏死性软组织感染的DFO前瞻性RCT认为,单纯用90 d抗生素与手术加围手术期用10 d抗生素相比,疗效无差异[166]。
前足骨质病变的处理
推荐35.1:足趾骨质破坏,建议手术切除受累的足趾组织;并考虑软组织松解术、趾间关节融合术(推荐程度为强,证据等级为低)
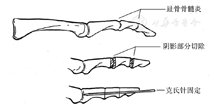
理论依据:糖尿病性运动神经病变导致足内在肌萎缩,继而出现"爪形趾"、"锤状趾"等畸形(图9)。足趾畸形分为柔软性和僵硬性两大类,前者是软组织挛缩所致、可行相关屈肌腱切断来纠正,后者是广泛软组织挛缩导致骨关节病变所致、要求切除近节趾骨头进行软组织松解来纠正。如果屈趾长肌腱切断术、关节囊松解术或屈肌腱转位术不能纠正畸形,则需要同时做部分趾骨甚至近节趾骨切除术,来重置足趾位置,减轻足底压力[167]。足趾深部溃疡或伴DFO,必须经关节面截除足趾或者部分足趾。足趾溃疡经保守治疗无效,甚至导致足趾DFO,需要截除部分或全部足趾进行治疗。不是所有的足趾截肢都一定要在跖趾关节水平,可以在彻底清除感染灶的同时允许保留足够的足趾来作为相邻足趾之间的一个缓冲部分,部分足趾截肢时可以一期闭合伤口,残端应保留足够的皮瓣蒂来覆盖骨残端,因此有时需要在坏死或者溃疡边缘做切口,在保留骨质和保留足够多皮肤软组织之间需要做出平衡,总的原则是要保证在无张力情况下闭合伤口,必要时可以牺牲部分骨质(图10)。总之,本共识建议,当足趾骨质破坏时,行手术切除受累的足趾组织;并考虑软组织松解术、趾间关节融合术。


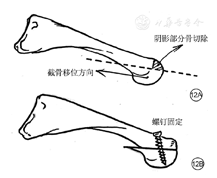
推荐35.2:第1跖趾关节破坏,建议手术切除趾骨近端基底部、第1跖骨头软骨和受累的屈肌腱和籽骨;并考虑第1跖趾关节成形术(推荐程度为强,证据等级为中等)
理论依据:糖尿病DPN引起肌腱、韧带等纤维结缔组织变性,前足结构随之改变、足底压力异常,第1趾间关节骨关节炎、第1跖趾关节骨关节炎,表现为关节活动受限、过度跖屈、内旋,负重后胼胝形成、拇外翻和压力性溃疡(拇趾底面最常见,约占所有溃疡的22%),甚至合并DFO而导致截肢等严重后果。2005年10月—2010年10月进行的1项针对糖尿病前足溃疡为主的队列前瞻性研究显示,330例合并DFO的患者(对照组1 808例无DFO)随访1年,82.1%溃疡穿透骨质或关节(对照组溃疡未穿透骨质或关节),15.8%大截肢(对照组仅为3.4%),35%足趾截肢(对照组仅为19%),2组溃疡复发率均为12.1%[168]。
第1跖趾关节(metatarsophalangeal joint,MTPJ)切除成形术或拇趾间关节切除成形术术后能恢复关节活动(图11)。MTPJ切除成形术,起源于1912年William Keller对拇外翻治疗时,后被广泛用于MTPJ处溃疡的治疗且效果明显,能使得91%溃疡愈合且随访近2年,拇趾处溃疡无复发。还有研究显示,手术前拇趾背屈平均为46°,手术后原来平均5个月未愈合的溃疡平均3.1周可愈合,随访1年观察到,之前手术愈合的患者中的22%在3~12个月内因拇趾再僵直溃疡复发,之前手术愈合的患者中的78%随访2年溃疡未复发[169]。少数情况下,拇趾顶端内侧关节增大或趾间籽骨存在导致的溃疡,通常是由足底到趾间关节,也需要切除趾骨近端基底部和第一跖骨头的软骨,受累屈肌腱和籽骨也要被切除,同时行MTPJ成形术以稳定关节和防止溃疡复发。值得注意的是,MTPJ成形术有导致关节不稳定和夏柯氏骨关节病急性发作的可能性。


因此,本共识建议,当第1跖趾关节破坏时,推荐手术切除趾骨近端基底部、第1跖骨头软骨和受累的屈肌腱和籽骨,并考虑第1跖趾关节成形术。
推荐35.3:第2~5跖骨骨感染导致骨质破坏,建议行跖骨头部分或全部切除术;足底未形成溃疡或溃疡未侵犯关节时,可考虑行跖骨头部分切除术、V形截骨术或Weil截骨术(推荐程度为强,证据等级为中等)
理论依据:糖尿病可导致足部力学结构异常、跖趾关节脱位、关节活动异常,跖骨头下的区域是糖尿病足溃疡的常见的位置。常用的手术包括:(1)单个跖骨头切除术,适用于跖骨头下方感染性溃疡或累及趾跖关节的感染性溃疡;一项报道了101例进行单个或多个跖骨头切除术病例的研究,平均随访35个月,患者手术有效率为94%,52%患者其他部位有新溃疡发生、8%患者溃疡原位复发[170];值得注意的是,因为单纯跖骨头切除,可能导致临近部位转移性溃疡的发生,故只有当整个跖骨头发生DFO、又无其他方法治疗时,才考虑采用此种手术方式。(2)跖骨头部分切除术,适用于单个跖骨头向足底突出导致局部压力增高、溃疡形成前或无感染的DFU;1953年DuVrues首先报道了跖骨髁切除术;Coughlin和Mann[171]将其改进,将跖骨头足底突出的髁部分切除,直至与跖骨纵轴平行,同时进行深部溃疡的切除与软组织清创。(3)跖骨头Weil截骨术适用于相对正常足弓和平足的DFU,能显著减轻足底溃疡处的压力,为溃疡愈合创造条件。研究发现患者Weil截骨术后足底压力比手术前平均降低52%;在平均30个月的随访中,5%患者足溃疡未愈合,74%痊愈患者足溃疡未复发,只有11%痊愈患者发生了转移性足溃疡[172]。值得注意的是,因为这种手术不能在结构上对前足进行充分减压,故不适用于高弓足所致的前足溃疡患者(图12)。(4)跖骨头V形骨切除术能矫正跖骨跖侧弯曲,显著降低前足溃疡的压力,适用于糖尿病高弓足患者未形成足底溃疡时或非感染性糖尿病足底溃疡;研究发现,经历跖骨头V形骨切除术后,仍有9%患者出现足部其他部位病变,而且4%患者原来胼胝并未好转[173],因此选择此种手术方式时需要慎重考虑适应症。总之,本共识建议,当第2~5跖骨骨感染导致骨质破坏时,推荐行跖骨头部分或者全部切除术;足底未形成溃疡或溃疡未侵犯关节时,可考虑行跖骨头部分切除术、V形截骨或Weil截骨矫形。

推荐35.4:前足广泛软组织和/或骨质破坏,或部分跖骨头切除术后出现转移性溃疡,局部治疗又失败的情况下,考虑行多跖骨头联合切除术(前足成型术)或经跖骨截肢术(推荐程度为弱,证据等级为高)
理论证据:前足手术以部分趾骨/跖骨截除并最大限度保留残端长度,减少负重面积丢失为原则。截肢水平越在肢体远端,对软组织的处理要求越高,术后护理更细致,残端裂开的可能性也增加。不切除足趾仅切除跖骨和中足骨,被称为"隐藏式"截肢,虽然生物力学无区别,但人群更易接受,且无神经瘤或患肢痛[174]。前足手术的主要方式包括:
(1)多跖骨头联合切除术又称前足成型术(MMHR)(图13),适用于前足广泛软组织破坏和/或骨质破坏,或部分跖骨头切除术后出现转移性溃疡,局部治疗又失败的患者。1993年哈佛大学Giurini等[175]报导了一组行多跖骨头切除术的患者共34例,平均观察20.9个月,结果显示61%患者一次手术后完全治愈(总治愈率高达97%)。常见的术后并发症,是截骨部位的疼痛和骨质增生,因此保持截骨后跖骨残端呈正常的生理弧线是这一手术的关键因素(截骨面必须光滑,防止形成新的足底高压区)。

(2)经跖骨截肢术(trans metatarsal amputation,TMA),包括经跖骨基底截肢术,通常被认为是一种相对于其他小跖列截肢术更为确切的截骨方法,适用于前足广泛皮肤软组织破坏、累及多处骨组织并出现DFO和/或骨坏死,或前足溃疡复发、迁延不愈的DFU患者。然而,也有研究表明,行TMA后糖尿病足患者的近端截肢率仍较高。随机效应模型估计,TMA术后患者再手术率为24.43%(95%置信区间=11.64~37.21)、再截肢率为28.37%(95%置信区间=19.56~37.19)、大截肢率为30.16%(95%置信区间=23.86~36.47);该研究作者因此对传统的用TMA代替其他小截肢(如部分第一跖列截除)的做法产生了质疑,建议手术方式的选择一定要根据患者个体因素来决定[176]。
总之,虽然证据等级较高,但手术远期作用差异较大、有不确定性,本共识对MMHR和TMA这2种手术方式在DFU中的使用作弱推荐,同时强调:(1)手术必须兼顾踝关节肌力平衡,条件许可情况下,考虑腓肠肌腱膜延长、跟腱延长术等软组织重建手术。(2)术后足溃疡愈合患者应穿定制鞋减压治疗。
中足骨质病变的处理
推荐35.5:前中足骨质及关节破坏严重,TMA无法实施或实施后无效的情况下,考虑跖跗关节离断术(Lisfranc截肢术)和跗横关节离断术(Chopart截肢术)(推荐程度为弱,证据等级为中等)
理论依据:前中足骨质及关节破坏严重,TMA无法实施或实施后无效的情况下,考虑经跗骨截肢术(transtarsal amputation,TA)。TA包括,跖跗关节离断术(Lisfranc截肢术)和跗横关节离断术(Chopart截肢术)。跖跗关节离断术适用于经跖骨截肢术失败,或前足广泛软组织缺失以至于不能行经跖骨截肢术的患者。跗横关节离断术主要用于严重中足感染,但是能够确保跟垫存活的患者。一项研究报道了74例糖尿病患者因组织丢失和/或感染经历了77次TMA手术,平均随访20个月,结果显示,32例TMA术后足溃疡仍不愈合患者又做了跗横关节离断术(22例)或跖跗关节离断术(10例),最终23例患者达到功能性步行目标;14例患者又做了其他创面修复治疗后愈合;仅6例需要行膝上截肢术,说明TA手术能挽救超过一半的TMA术后足溃疡仍然不愈合的患者,临床治疗效果明显[177]。这两种手术,优点是患者术后佩戴踝足矫形器可以穿鞋走路,缺点是即使同时做了肌腱的力量平衡手术,术后马蹄足畸形发生率仍然很高。因此,本共识建议,在保证足够足部血流灌注的情况下,对于前足组织丢失/感染的糖尿病患者,积极用TA手术来挽救足部、使其能保持术后站立甚至行走是合理的;同时建议,在TA手术关节离断的同时,考虑进行跟腱及腓肠肌延长术、胫骨前肌和腓骨短肌腱止点重建术等软组织重建术以防止术后残余足畸形。
推荐35.6:中足多个关节不稳定时,需要个体化选择单纯骨突切除术(带或不带筋膜皮瓣)、Ⅰ期关节固定术或骨切除多平面重排术等手术方式,以达到纠正足畸形、降低足高压区压力,并保持足稳定性的目的(推荐程度为弱,证据等级为中等)
理论依据:中足跖跗关节、舟楔关节和跗骨间关节不稳定,甚至足底摇椅畸形和溃疡形成(多与第1跖骨-内侧楔骨关节半脱位和脱位,造成足底骨质突出,骰关节的骰骨挤压足底有关),多见于糖尿病合并夏科氏关节病。在夏科氏关节病的结合期和重建期,进行手术矫正畸形和脱位、重建足部稳定性,能有效预防或治疗足底溃疡。手术方法有多种:(1)单纯骨突切除术,直接从足底内侧溃疡做切口或经过骨畸形的顶点(第1跖骨近端、舟骨或内侧楔骨等处)做切口的单纯骨切除术(带或不带筋膜皮瓣),同时防止新的骨突形成。一项研究报道了1组27例骨突切除术患者,9例为足侧方溃疡,18例为中足底部溃疡,总治愈率为74%;未治愈患者85%为侧方溃疡,其中55%的侧方溃疡需要再次行骨矫形手术,并使用临近软组织覆盖并填塞病灶[178]。(2)足内侧柱融合手术(图14),在关节不稳定的情况下,简单骨突切除术常会失败,融合稳定第1跖骨-内侧楔骨关节是更好的选择,具体为内侧切口足够暴露关节背侧和跖侧、切除双侧关节软骨使得第一跖侧骨切面从近侧背侧到远侧稍成角度、重建足内侧纵弓以恢复第一跖列的负重功能;(3)骨切除多平面重排术,夏科氏关节病最常见的畸形是冠状位与矢状位同时变形,需要切除变形边缘的骨,进行双平面的闭合或开放性楔形截骨手术并选择合适的内、外固定。一项前瞻性研究分析了1985—1993年间因糖尿病合并夏柯氏足中足塌陷经历外科手术重建的18例患者(21只足),重建手术包括关节塌陷的复位和融合、内固定恢复足形状和保持负重位居中,结果显示,平均随访28个月,18个足得以挽救,平均愈合时间为5个月;13个足术后无手术相关并发症;15例成功重建的患者中,13例患者的鞋合脚度和行走状态得到改善;7例患者的足溃疡在术后完全愈合;无中足溃疡复发[179]。总之,关于中足多个关节不稳定时外科重建手术的证据等级不低,但因手术难度大、对手术医师的要求极高,本共识对此类手术在糖尿病足中的使用仅作弱推荐,甚至建议必要时将患者转诊至经验丰富的骨科中心。


后足骨质病变的处理
推荐35.7:当跖跗关节/跗骨关节被严重破坏、保守治疗无效时,考虑行中足和/或中后足关节融合术(推荐程度为弱,证据等级为中等)
理论依据:糖尿病足人群的后足病变,绝大多数情况与夏科氏关节病有关,少数是由外伤因素引起,也与糖尿病患者群组织愈合能力差有关。夏科氏关节病最常见的病变部位正是后足的跖跗关节(由跖骨基底、楔形骨、骰骨以及连接骨头的韧带形成),韧带断裂伴或不伴骨折后,由于缺乏保护性痛觉,患者继续在不稳定的足上行走,导致跖跗关节进一步破坏、移位和不稳定。跖跗关节/跗骨关节被严重破坏的最初治疗,包括免负重、固定和支具;在保守治疗无效的情况下,应该考虑手术干预。(1)手术干预适应证。适应证包括慢性未愈合溃疡伴潜在后足畸形或不稳定、严重的后足不稳定以及慢性足跟溃疡伴有潜在DFO等。(2)手术方式。以中足和/或中后足关节融合术,包括距骨周围关节融合术和三关节融合术为主,必要时部分或全部跟骨切除。三关节融合术是将距舟关节、跟骰关节和距下关节固定(图15),目的是加强足稳定性和减少足畸形,适用于跗骨关节(距骨关节、跟骨关节或距下关节)严重不稳定的夏柯氏足患者。手术应避开夏柯氏足的急性期,选择慢性重塑期进行;如果是开放性溃疡,则应推迟手术至所有急性感染症状得到控制后;必要时联合跟腱延长术以减轻后期前足底压力。部分或全部跟骨切除术目的是切除感染的跟骨及坏死组织,促进创面愈合,适用于足跟溃疡合并慢性感染及DFO,局部血运良好,病变范围广且深,需要切除病变跟骨的患者。一项研究报道了50例因足跟溃疡行部分跟骨切除术的患者(39例部分切除,12例次全切除),平均随访33个月,结果显示,69%患者治愈,65%患者能下地行走,35%患者需要再次行皮瓣转移或皮肤移植覆盖创面治疗[180]。总之,关于中足和/或中后足关节融合术的证据等级中等,因手术难度大、对手术医师的要求极高,本共识对此类手术在糖尿病足中的使用仅作弱推荐,建议必要时将患者转诊至经验丰富的骨科中心。同时注意,由于这些类型的手术风险极高,在术前要采取适当的保守治疗措施,当截肢是唯一的治疗方法时可尝试该手术。

推荐35.8:当踝关节和距下关节被严重破坏、保守治疗无效时,考虑行踝关节和距下关节融合术,即距骨周围关节融合术(推荐程度为弱,证据等级为低)
理论依据:距骨周围夏科氏关节病通常会导致踝关节连枷,这种畸形可能是由于距骨体完全塌陷、内/外踝骨折或两者兼而有之。这些类型的骨折人群行走时脚的着力点在内踝或外踝上。这种内在的不稳定性将导致慢性溃疡的发展,为了保肢,行Ⅰ期踝关节和距下关节的融合是必要的,主要的手术方式详见三关节融合术。手术的最佳时间是有争议的,一项前瞻性研究观察了2007年7月—2012年12月接受手术治疗的33例不同Eichenholtz时期(一种夏科氏足分期法)夏柯氏足患者,手术类型有踝关节融合术、自体髂骨植骨和距下关节融合术,有或无距下关节融合术,用髓内钉内固定,有或无附加钢板或松质骨螺钉。结果显示,平均随访40个月(12~76个月)后,不同Eichenholtz时期进行手术的患者,后脚评分、挽救或截肢率,或并发症发生率并无显著差异[181]。总之,关于距骨周围关节融合术的证据等级弱,且因手术难度大、对手术医师要求极高,本共识对此类手术在糖尿病足中的使用仅作弱推荐,建议必要时将患者转诊至经验丰富的糖尿病足中心。
推荐35.9:足跟溃疡,需要彻底清除病变的软组织和骨质,感染导致的骨缺损可用含有敏感抗生素的材料(骨水泥、生物陶瓷等)临时性填充,后期考虑自体髂骨移植和/或皮瓣转移覆盖创面(推荐程度为强,证据等级为低)
理论依据:后足溃疡,是糖尿病患者常见的疾病,与足部感染或夏科氏关节病变有关。跟骨溃疡合并DFO时,以及夏科氏关节病引起的足踝压力性溃疡或者关节畸形、疼痛时,要避免盲目膝下截肢,而应该考虑先做跟骨部分切除术,以切除所有坏死和受感染组织、畸形骨或者骨赘,切除时注意不能留下任何感染组织或足底骨突出;后期考虑采用创面修复技术修复创面或创面修复材料覆盖创面[182]。创面骨生物学材料(BBM),包括骨传导材料,如自体骨、钙陶瓷、羟基磷灰石和胶原蛋白等,以及骨诱导材料,如血小板凝胶浓缩物、脱矿骨基质和骨形成蛋白等。BBM的应用在许樟荣教授2012年翻译的《糖尿病足和踝的外科重建手术》书中有详细阐述[183]。自体骨移植没有免疫排斥,且自体骨容易获取,长期以来一直是植骨的金标准。但自体骨移植不足之处是对供区的影响,比如供区疼痛、骨折、感染、临近血管神经及器官损伤,可以根据手术计划、供区血供、植骨需要量及植骨区结构特点,选取髂骨嵴、胫骨近端、胫骨远端、腓骨、跟骨进行移植。总之,了解各种自体骨和骨生物材料的特性,根据手术特点合理选择骨生物材料联合自体骨移植,节约自体骨、减少取骨并发症。总之,虽然关于跟骨溃疡治疗的证据等级弱,但跟骨溃疡是踝上大截肢的高危因素,需要采取有效、及时的干预性措施。本共识对分阶段选择骨生物材料联合自体骨移植手术在糖尿病足中的应用仍作强烈推荐,同时建议术后佩戴特殊足踝矫形器以降低足跟部压力。
推荐35.10:后足复杂骨畸形不能通过非手术治疗维持行走功能时,考虑外固定关节融合术,甚至踝上截肢术(推荐程度为强,证据等级为中等)
理论依据:关节外固定术用来矫正畸形和融合关节。后足畸形伴大量骨丢失,导致无法可靠地使用内固定装置。开放性溃疡和DFO的存在,也使内固定成为禁忌。在夏科氏关节病中严重受损的踝关节会导致复杂畸形,需要外固定与逆行髓内钉内固定联合使用。
外固定关节融合术。合并严重软组织感染或者严重骨缺损,无法行内固定治疗的人群,可以通过外固定装置来达到固定的目的;同时可以开放创面、开放皮瓣以及切口等便于护理;还可以通过外固定装置加压、牵拉达到促进踝关节融合的作用。对后足的骨科处理,目前尚无研究直接比较手术重建骨性结构和早期截肢治疗的效果。有研究显示了部分跟骨切除联合Ilizarov外固定器对糖尿病跟骨溃疡的疗效,23例患者中18例(78%)创面愈合、3例(13%)部分愈合、2例(9%)膝下截肢,故此手术方案能有效降低糖尿病足溃疡伴跟骨DFO患者的截肢可能[184]。
踝上截肢术。早期截肢对一些人群而言,是最有利的治疗选择:(1)踝部或者后足骨质严重破坏。(2)广泛的DFO。(3)合并多种基础疾病、行走功能困难。(4)依从性差的人群。经踝关节的Syme截肢术,保留残肢较长,并能部分负重,但是由于小腿假肢技术的不断进步,Syme截肢术已经没有优势且副作用大。对糖尿病足人群来说,更适合做相应改良的Pirogoff截肢术(在影像增强器的控制下,用2个6.5 mm空心螺钉将跟骨固定到胫骨或膝下)。一项前瞻性研究显示,187例截肢患者都有DPN,其中171例有PAD、74例踝下截肢愈合、88例踝上截肢愈合、25例未愈合;进一步研究表明,踝上截肢与患者年龄大、住在护理院等机构、步行困难、脑血管疾病、充血性心力衰竭和低血红蛋白水平等有关;同时踝下截肢与30岁前确诊糖尿病和糖尿病病程有关[185]。患者是否需要踝上截肢,还应考虑更多的因素,并得到整个临床证据的支持,包括坏死性肢体感染危及生命、足部广泛骨质破坏,以及下肢缺血而血供无法重建、疼痛难以忍受、家庭经济状况难以坚持长期非手术治疗而截肢要求强烈等。强调的是,踝上截肢与否,应更多地根据生物学,而不是患者年龄。截肢平面的选择,应该根据组织坏死或血管闭塞平面,以及患者年龄、性别、职业、生活习惯等因素,并结合切口处TcPO2结果、血管影像学检查结果等综合判断。研究显示,组织TcPO2不同截肢后的创面愈合情况也不同,<20 mmHg预示截肢残端无法愈合,需要下肢血管重建术来改善血流;>40 mmHg预示着截肢残端可以愈合;介于20~40 mmHg,愈合/不愈合可能都存在,可能需要下肢血管重建术[186]。总之,关于后足复杂骨畸形手术方法研究的证据等级中等,本共识对外固定关节融合术,甚至踝上截肢术在糖尿病足中的应用作强烈推荐。综述以上关于糖尿病足骨质病变治疗的内容,本共识认为,需要临床医师对糖尿病足人群的病情充分评估,明确诊断人群的骨质病变,为人群制订个体化的治疗方案,并在合适的时机进行的处理。
糖尿病足创面准备,是针对不同原因和状态的糖尿病足创面进行评估,采取措施营造一个无感染、无过多渗出、血供良好的创面床,从而刺激内源性创面修复的进程,为后期创面修复提供足够的准备。
推荐36:每1~4周评估与测量糖尿病足溃疡大小和进展情况,并按照TIME原则进行创面准备(推荐程度为强,证据等级为低)
理论依据:创面床准备的"TIME原则",是Falanga在2000年及Schultz等在2003年提出,包括组织处理、炎症和感染控制、湿度平衡、创缘处理4个方面,并于2003年初以表格的形式发表在《Wound Repair and Regeneration》杂志,其后得到了众多创面处理专家的认可,并多次在相关学术会议上讨论与推广[187,188]。一项研究通过检索相关文献498篇,证实TIME原则是一个有价值的创面治疗指导工具[189]。仇铁英等2013年分析了TIME原则在创面床准备中的应用研究现状,总结出"TIME原则"使创面治疗流程化、科学化和规范化,是目前创面治疗努力和研究的方向[190]。但如果创面超过60天未愈合,应该用"TIME,H"原则,即特殊创面处理原则,除"TIME"外,要对不愈合因素(Healing has not been achieved,H),即导致创面不能在计划时间内愈合的因素进行评估和处理[191]。此外,糖尿病足溃疡多呈动态变化趋势,研究显示,溃疡面积1周内缩小10%~15%或4周内缩小超过50%,其再感染和截肢的可能性明显降低,说明单位时间内溃疡面积缩小的百分比对疗效有早期预测价值[192]。虽然没有研究评估TIME原则的益处和创面检查间隔的实用性,但是可通过每隔1或4周测量创面大小,记录愈合进展,并按照TIME原则,指导临床医师调整治疗方案。健康的创缘,较为模糊且不均匀,上皮在创面床上展开,呈现粉红色;不健康的创缘,可能会有感染、水肿或者肥厚,表面出现深红色、易碎的肉芽组织,边缘组织弹性差,需要再次联合运用清创术、抗生素,并保持湿度平衡,以促进创面愈合。因此,本共识建议,每1~4周评估与测量DFU大小和进展情况,并按照TIME原则进行创面准备。
推荐37:根据年龄、心肺功能等基础情况,以及创面(大小、深度、位置和血供)准备程度等,来选择相应的软组织修复技术并做充分的术前准备(推荐程度为强,证据等级为低)
理论依据:软组织修复技术由简单到复杂依次为,Ⅰ期缝合、Ⅱ期缝合、负压创面治疗、皮肤移植、真皮基质移植、局部皮瓣、远处皮瓣移植、组织扩张,最后是局部筋膜皮瓣或肌筋膜皮瓣、岛状皮瓣或游离组织移植[193]。糖尿病足创面修复技术选择时,应按照以上顺序阶梯式进行,争取以简单的方法解决复杂的问题,同时兼顾以下基本原则。(1)评估骨骼结构、稳定性和相关骨损伤的治疗,同时评估是否有骨折、负重与否等。(2)全面评估患者是否适合足部重建和康复,尤其是下肢血液供应、感染程度和保护性感觉可能的恢复程度。(3)适当创面床准备,包括清创、控制感染。(4)考虑足部的解剖部位特点,例如,踝和足背用薄而柔韧的软组织覆盖,足底用厚纤维结缔组织固定在足底部的骨骼和韧带上以抵抗高应变力[194]。本共识推荐的选择方案为:(1)对于肉芽组织生长良好、较浅表、面积大,且不在关节活动部分的创面,可选择创伤较小的植皮术。(2)对于肉芽组织生长良好、较深(血管、神经、肌腱和/或骨等组织裸露)的创面,即使面积不太大,根据人群条件也要考虑选择皮瓣转移术或游离皮瓣修复(图16,图17,图18)。





任何软组织修复手术,都需要详细的术前准备,包括以下几点。(1)患者一般情况、皮瓣和移植物血供、创伤技术和尽可能减少创面等,还应考虑患者依从性、血管状况和骨性突起等特点。(2)皮瓣设计,多年来的基础是血液供应从深到浅的概念,皮瓣底部的供血决定了皮瓣移植的成功与否,而不是长宽比[195]。研究显示,局部足底皮瓣可设计成包括神经和血管的皮瓣,而无须筋膜下剥离[196]。
皮瓣的切口线与松弛张力皮肤线(relaxed skin tension lines,RSTL)平行,可以使得皮肤的横向力最小(图19)。然而,如果同时进行骨手术,可以不考虑RSTL;最终好的皮瓣是可在一个方向上移动,无侧向或旋转。导致皮瓣移植失败的因素是多方面的,主要是感染,尤其是金黄色葡萄球菌、假单胞菌和β溶血性链球菌感染。皮瓣移植的并发症也很多,包括感染、机械剪切力增加、血供不足、浆膜瘤和血肿形成等。


注:图中腿部线条均为松弛张力皮肤线
因此,本共识建议,根据糖尿病足人群的年龄、心肺功能等基础情况,以及创基(大小、深度、位置和血供)准备程度等,来选择相应的软组织修复技术并做充分的术前准备)。
推荐38:合理使用敷料产品,保持创面床湿润、控制渗出以避免创面周围完整皮肤浸润,并营造促上皮生长环境(推荐程度为强,证据等级为低)
理论依据:人们起初认为干燥的创面有利于避免细菌的繁殖,但有研究表明,在湿润环境下创面愈合速度比暴露在空气中快40%,与温暖湿润的环境更有利于上皮的移行有关[197]。保持均衡的创面湿度能促进创面愈合,研究显示,创面过于湿润,创缘和周围皮肤会浸渍,渗液中的蛋白水解酶及基质金属酶升高、细胞外基质蛋白和生长因子遭破坏,新生纤维细胞衰老或凋亡,不利于创面的愈合;创面过于干燥,会出现疼痛或者瘙痒感,并减慢创缘表皮细胞爬行、限制表皮再生[198]。
临床传统敷料有纱布、绷带、棉垫等,制作工艺简单、价格低廉,在临床应用广泛;不足是易粘连创面(换药产生二次损伤)、易浸透。高级敷料主要包括湿性敷料、活性成分敷料(血小板凝胶、细胞生长因子及干细胞)、皮肤替代产品和胶原类敷料等[199]。目前临床上较为常用的保湿敷料有水胶体、水凝胶、藻酸盐、泡沫敷料等。保湿敷料的作用机制包括以下几点:(1)为创面提供较为潮湿的环境,坏死组织可被渗出液水合而释放组织细胞自身的纤维蛋白溶酶以及其他蛋白溶解酶,水解坏死组织,达到清创效果。(2)在创面局部的微环境形成低氧张力,这种低氧环境能明显促进创面Fb增生、刺激巨噬细胞释放生长因子以及加速新生血管形成,使创面愈合时间缩短。(3)保护创面,隔绝外界环境中的微生物,降低感染率。临床根据创面渗液量,选择相应的湿性敷料,例如,干燥创面用水胶体、水凝胶;少量渗液创面用半透明敷料、亲水性纤维敷料;中等渗液创面用藻酸钙敷料、泡沫敷料;大量渗液创面用藻酸盐敷料、泡沫敷料等。一项研究在1993年—2017年进行的RCT研究,探讨多种敷料治疗2 159例DFU患者的效果,得出以下结论:羊膜优于藻酸盐敷料、普通创面敷料、泡沫敷料、水胶体以及含碘纱布敷料;水凝胶敷料优于普通创面敷料;羊膜和水凝胶敷料能最有力促进DFU愈合,是DFU的首选[200]。虽然证据等级较低但本共识仍强烈建议,合理使用敷料产品,保持创面床湿润、控制渗出以避免创面周围完整皮肤浸润,并营造促上皮生长环境。
回顾性研究表明,4周的时间足以评估简单的神经性足溃疡患者的愈合趋势[28]。标准化治疗至少4周后,DFU仍无改善(面积缩小>50%)时,应重新评估创面和前期治疗方案,同时考虑辅助治疗[28]。
推荐39:在创面血供充足、感染组织已彻底被清除的情况下,可选择负压治疗辅助进行创基准备(推荐程度为强,证据等级为低)
理论依据:早在1947年就有人认为,只要术后存在血液、胆汁和分泌物积聚,就可使用负压创面疗法(negative pressure wound therapy,NPWT)。1952年NPWT被引入临床,将术后并发症发生率降至最低,缩短住院时间。Hinman和Hinman[201]1963年发表于Natrue杂志的1篇文章显示,封闭创面比裸露创面更容易闭合。NPWT在糖尿病足创面中的作用机制是多方面的。(1)持续或间歇负压使渗出物及时被吸走,有效促进创面引流。(2)有效保持创面清洁并抑制细菌生长。(3)持续负压可刺激创面肉芽组织的生长,促进创面愈合。(4)部分病例还可通过冲洗液对创面机械冲洗,联合NPWT,可使创面保湿,防止渗液堵引流管,加速坏死组织溶脱。1项包括4个低到中等质量RCT的分析报告显示,NPWT能促进肉芽增生、提高创面愈合率,其中有研究认为创面愈合能增加20%(优势比=2.0%,95%置信区间=-1.0~4.0),能截肢率降低约7.9%;比普通辅料的效果好(证据等级较弱)[202]。关于人群满意度和体验的研究,也无任何不良反应的报道。一项研究分析了7个RCT(324例)和10个非RCT(278例),其中2个RCT和4个非随机对照实验证明,NPWT能促进创面愈合率提高和缩短创面愈合时间[203]。临床需要注意以下事项:(1)避免压力设置过高,防止因覆盖不当或压力过大导致的局部组织压迫缺血。(2)避免创面未清理干净就盲目安装装置。因此,强烈需要进行更大规模的试验,以评估不同的糖尿病患者、采纳不同的临床目标和参数时,NPWT治疗的作用和不良反应。本共识对NPWT在糖尿病足中的使用作强推荐。
推荐40:糖尿病足溃疡仍无改善(面积缩小<50%),可选择高压氧、细胞生长因子和生物工程皮肤替代物等治疗(推荐程度为弱,证据等级为中等)
理论根据:高压氧治疗(hyperbaric oxygen therapy,HBOT)应用于糖尿病足创面的研究很多,多数认为其不仅能改善创面炎症和微循环状况,还能促进创面愈合并降低截肢风险[204],与高压氧的以下作用有关。(1)增加组织氧合,有利于经常规临床治疗无效的创面愈合。(2)增加氧分压,有助于满足愈合过程所需的能量,并降低感染发生率。(3)氧增加导致产生具有拟激素活性的活性物质,作用于调节炎症介质、抗氧化剂和生长因子合成的信号传导途径,促进创面愈合。一项回顾性的RCT数据,也无法确认HBOT对溃疡愈合有任何显著的益处,也无法确定小截肢是否需要用HBOT[205]。搜索了Medline、EMBASE、CINAHL、PubMed、Wiley′s Cochrane Library和Biosis数据库,得到与HBOT相关的12个研究/531例DFU患者,其中有6个是RCT研究,结果显示,205例患者使用HBOT治疗6周时DFU的愈合率明显高于对照组,但远期(随访1年)作用并不明显,且大截肢率也无差异(相对危险度=2.3,95%置信区间=1.19-4.62)[206]。总之,到目前为止,所有关于HBOT研究的证据等级只是低到中等,本共识对HBOT在糖尿病足中的使用作弱推荐。
目前应用于临床并制成创面生物制剂的外源性细胞因子有,FGF、EGF、内皮生长因子、血小板源生长因子(PDGF)、TGF等。PDGF贝卡普勒明(becaplermin)凝胶,是美国食品药品监督管理局迄今为止唯一批准用于治疗DFU的药物,不少临床研究显示其能提高糖尿病足溃疡的愈合率。一项历时20周的临床研究显示,PDGF组患者DFU愈合率是48%,而对对照组患者只有25%[207]。另一项研究结果表明,经过6周治疗,PDGF组患者DFU愈合率是50%,对照组患者为35%,提示PDGF能提高溃疡愈合率;PDGF组DFU痊愈时间约为86 d,而安慰剂组为127 d,提示PDGF能缩短溃疡愈合时间[208]。自体富血小板血浆(PRPG),是近年来慢性创面治疗领域的又一个热点,开始将其用于糖尿病足创面研究并取得良好疗效,目前认为主要的是PRPG中富含白细胞和生长因子等共同发挥作用[209]。白细胞有抗感染和免疫调节作用,还能影响多种生长因子的释放及血管内皮生长因子的产生,而血管内皮生长因子对促进血管再生有重要的作用。PRPG中的纤维蛋白产生纤维结合素,具有黏附特性,能促进创面愈合;其中的血小板破裂,在创面或溃疡表面覆盖一层上述高浓度的生长因子,以及血小板本身及血小板活化释放一些抗菌活性肽,能抵抗微生物以防止创面感染;一项研究对自体PRPG治疗糖尿病慢性皮肤溃疡的15个RCT(共829例患者)进行荟萃分析,与标准治疗或常规治疗相比,PRPG显著提高溃疡愈合率(相对危险度=1.39,95%置信区间=1.29~1.50、缩短愈合时间(平均差=-9.18,95%置信区间=-11.3~7.05、降低感染发生率(相对危险度=0.34,95%置信区间=0.15~0.77)[210]。总之,到目前为止,所有关于细胞因子的治疗研究的证据等级只是低到中等,本共识对HBOT在糖尿病足中的使用作弱推荐。
生物工程皮肤替代物可用产品分为表皮、真皮或复合移植3大类。单个产品根据细胞材料的来源、递送方法和辅助基质(如Fb或基质蛋白)的存在而不同。目前组织工程领域已经开发出可用于糖尿病创面修复的人工皮,可将体细胞整合到生物工程支架中用于治疗;但过去十多年,一些小型临床试验提示这种作用的临床效益仅为中等[211]。相比之下,对于皮肤创伤,主要的研究集中在表皮前发生细胞、间充质基质/干细胞、脂肪组织源性干细胞和诱导多能干细胞的应用上,有些虽然尚处于早期阶段,但应用前景广阔。
(1)干细胞移植(SCT)具有自我更新和分化为其他细胞的能力,可分为成人干细胞、祖细胞、胚胎干细胞和诱导多能干细胞。与体细胞不同,这些细胞具有很高增殖潜力,可以进行遗传操作,但作用机制尚未完全阐明,包括:①分化为专门的细胞,如真皮和表皮的皮肤细胞。②通过分泌营养因子(如新血管生成的可溶介质)起旁分泌或自分泌作用。③免疫调节因子等。自体SCT的干细胞来源于自体骨髓、外周血或改良骨髓,不存在免疫排斥和伦理问题,在国内已得到一定程度的普及并取得良好效果;异体SCT的干细胞来源于脐血、间充质和胚胎干细胞,这两者在临床也已有尝试。有研究者搜索了包括《PubMed》《Embase》《Web of Science》和《Cochrane》数据库,从中筛选出6项RCT进行荟萃分析,测量的终点是DFU愈合情况,结果显示SCT能明显促进DFU愈合(平均差=0.52;95%置信区间=0.38~0.65),且溃疡大小、患者年龄不影响治疗效果[212]。2011年欧洲药品管理局发表了题为《干细胞药品产品的反思论文》,提出干细胞产品要按国际标准生产和临床试验,这些标准包括良好实验室规范、良好生产规范和良好临床规范。总之,细胞治疗有一定的疗效,但鉴于首先要保证人群的安全性,我国目前尚不能将其作为糖尿病下肢病变治疗的常规手段。本共识也不推荐将细胞治疗作为临床常规治疗方法。
(2)ECM产品(extracellular matrix products,ECMP)治疗。创面愈合是一个动态过程,细胞、生长因子和ECM相互作用,受损组织结构得以恢复。有些慢性创面,尤其DFU,炎症细胞降低ECM、生长因子和创面愈合所需细胞有关。目前,除上述细胞治疗外,ECMP也得到研究和开发,这些产品能提供细胞、生长因子和其他关键元素,作为支架,促进创面床的Fb、角蛋白细胞形成,以及不同的生长因子分泌增加,有利于创面的上皮化和血运重建[213]。一项双盲RCT,比较了3种不同的治疗方法,分别是最标准治疗(SOC)、SOC加Dermagraft®(有活细胞成分的生物工程ECM)、和SOC加Oasis®(无活细胞成分的生物工程ECM),结果显示3种方法在创面愈合方面作用相似[214]。同种异体脱细胞真皮能用于DFU的治疗,因为该类产品是将同种异体皮肤经过特殊处理,去除皮肤组织内的细胞以及抗原成分、而保留ECM的生物材料,具有无毒性、无刺激性、无免疫原性的特点,适用于大片组织缺损患者。注意,为保证修复成功,要求创面有较好血供,并彻底切除坏死组织,彻底止血。到目前为止,所有关于ECMP研究的证据等级只是低到中等,本共识对ECMP在糖尿病足中的使用仅作弱推荐。
(3)胶原敷料在临床应用已超过50年,包括可溶性胶原注射、液体质量构的固体结构和脱细胞胶原基质等,按敷料类型又分为单层型胶原支架海绵、复合型胶原支架海绵和模型胶原类材料等。近年关于胶原敷料在组织工程支架构建中的作用研究很多,认为其具有天然的止血性,良好的促细胞生长、趋化性能;生物相容性较低的免疫原性及可控的生物降解等性能等优点[215],对于深度创面主要作为支架材料使用,对于浅度创面主要作为覆盖物使用。一项单臂、开放式、多中心临床研究观察了由烟草植物纯化的纤维重组人I型胶原蛋白配制而成的新的可流动基质凝胶在创面治疗中的作用,20例患者平均年龄63岁,神经性溃疡、外伤后溃疡、术后溃疡、静脉溃疡分别占45%、35%、10%和10%,经过4周重组人I型胶原蛋白治疗,创面面积平均下降95%,超过70%的创面关闭,且无明显不良反应[216]。目前所有关于胶原敷料研究的证据等级只是低到中等,本共识对胶原辅料在糖尿病足中使用仅作弱推荐。
推荐41:不可拆卸式全接触式石膏是DFU的一线治疗方法(推荐程度为强,证据等级为高)
理论依据:全接触式石膏(total contact cast,TCC)是一种不可移动或拆卸式的减压装置,主要由玻璃纤维复合材料制成、成型良好,可与整个足底、小腿保持紧密接触,能起到保护创面或易患部位、让下肢和脚一起分担重力、防止踝关节旋转和减少行走、降低剪切力的作用,从而达到减轻易受累部位压力、预防或促进溃疡愈合的目的。自1930年代TCC问世于印度并用于Hansen′s病治疗以来已经得到大量改进,如足底跖骨区域增加硅泡沫、足底溃疡下的额外衬垫(创面隔离TCC)、TCC内放置6 mm慢回弹聚氨酯和6 mm软聚氨酯(缓冲改良TCC),以及溃疡、骨突(内踝和外踝)和下肢前侧面的毡垫等。TCC的作用机制主要体现在3个方面:(1)石膏材料能增加足底与地面的接触面积,研究显示,与矮帮鞋相比,TCC组能增加足底与地面的接触面积,使得足底压力负荷能再分配。(2)将1/3压力转移到下肢石膏管或后足,分散足底压力。(3)限制踝关节运动[217]。
尽管有证据表明,TCC提供了最好的减压效果,但临床应用并不广泛。一项研究观察到,在接受调查的895个中心只有1.7%的中心使用了TCC,其中半数以上的中心甚至没有将TCC视为治疗非感染性DFU的一线减压方法[218]。从美国伤口登记数据库中获得的18个门诊中心的数据表明,只有6%患者群接受了TCC治疗[219]。一项有代表意义的前瞻性临床研究观察了欧洲10个国家、14个中心1 232例初发DFU患者,起初77%患者未能进行有效的足底减压治疗(41%患者已减压治疗,但其中只有一半是正确的),随后78%的患者接受减压治疗,含神经性前足或中足足底溃疡(139例患者),仅18%使用了TCC(25例患者)、17%使用了替代石膏(24例患者),绝大多数都使用了临时鞋具,且国家之间甚至同一个国家不同中心之间TCC等使用率有明显不同[220]。在多变量模式下,男性(OR=0.356;95%置信区间=0.15-0.84)、溃疡大小(P=0.038)和工作状态(P=0.001)是TCC等使用的独立预测因素[220]。TCC应用少的原因有很多,需要培训的医师或技师且操作很耗时,还可能有皮肤刺激等;此外,TCC使用的禁忌证包括:(1)活动性深部组织感染、DFO或坏疽存在。(2)下肢持续肿胀或过度渗出。(3)严重下肢缺血(踝肱指数≥0.4)。(4)共济失调。(5)失明或严重肥胖患者。(6)导致或加剧趾甲变形、缺血、真菌感染、皮炎。(7)幽闭恐惧症等。
总之,到目前为止,所有关于TCC研究的证据等级较高,因此本共识对TCC在糖尿病患者足底溃疡中的使用作强烈推荐。
推荐42:当TCC或其他不可拆卸助行器使用条件与患者条件相矛盾或不耐受时,足底溃疡患者可考虑使用全长RCW(推荐程度为强,证据等级为中等)
理论依据:全长RCW能使得足底压力分布均衡并限制了足部和踝关节运动,还便于伤口敷料定期更换,同时允许患者进行日常活动,适用于TCC使用禁忌或不能耐受的患者。Aircast diabetic RCW(aircast,summit,NJ)、Aircast Pneumatic Walker(XP diabetic walker)、Stabil-D cast Walker(Podartis,Montebelluna,Treviso,Italy)和DH Offloading Walker™(Össur®,USA)这几种RCW类型常用。RCW在神经性DFU治疗中的有效性已经得到证实,可有效降低足底压力,例如,研究显示,使用可移动石膏步行靴(一种RCW)的患者,前足峰值压力、压力-时间积分、最大力和力-时间积分明显比赤脚行走的患者低,达到与使用TCC类似的效果(但溃疡愈合率不如后者);且中足峰值压力降低甚至比使用TCC更有效(分别为77%、63%,P=0.036)[221]。RCW能达到与TCC相似的足溃疡愈合率,其中DH Offloading Walker?减压步行器对拇指底面溃疡的治疗效果甚至比TCC还要好[222]。也有研究认为某些RCW(例如Stabil-D cast walker)使用与TCC使用相比,在溃疡愈合率和愈合时间等方面无差异[223]。但也有研究认为RCW促进DFU愈合的作用不如TCC,例如,一项前瞻研究就认为,与TCC使用相比,RCW使用时足溃疡愈合率低(分别为89.5 %、61.4%,P=0.026;OR=5.4;95%置信区间=1.1-26.1)、愈合时间长(P=0.033)[224]。
改良的RCW,是一种用黏性绷带或石膏绷带包裹RCW,使其变为不可拆卸RCW,能发挥类似TCC的效果并避免其不足,故又称速成TCC(ITCC)。针对神经性DFU疗效,研究显示,ITCC组足溃疡愈合率84%,明显高于RCW组58.3%(P=0.04);ITCC组足溃疡愈合时间较RCW组更快[分别为(41.6±18.7 ) d、(58.0±15.2) d,P=0.02][225];用玻璃纤维材料单条包裹RCW的ITCC组与传统的TCC组在愈合速度、平均愈合时间和并发症方面无明显差异[226]。相关荟萃分析显示,TCC和ITCC在DFU愈合方面无差异[227]。以上结果表明,改良RCW的减压效果与常规TCC相当、远优于常规RCW,且ITCC更便宜和简便。值得关注的是,患者依从性对TCC、RCW的减压效果差别起着重要作用。研究表明,使用不可拆卸TCC者的平均每日步数,比使用RCW者少22%[224];进一步研究观察到,RCW使用的患者全天只有1/3时间会佩戴支具、每日步行数明显比TCC使用的患者多[228]。这些关于TCC研究的证据等级均较高,因此,本共识建议,当TCC或其他不可拆卸助行器使用条件与患者条件相矛盾或不耐受时,足底溃疡患者可考虑使用全长RCW。
推荐43:如果患者不适合或不能耐受RCW,建议使用治疗鞋或半鞋(后跟或前足减压鞋)(推荐程度为强,证据等级为中等)
理论依据:很少有证据表明减压鞋(半鞋或治疗鞋)在足底溃疡治疗方面有着充分减压的作用。治疗鞋,是个性化订制的鞋,有独特的摇椅外底,从生物力学角度来看,这种摇椅底部特征能减少动态情况下跖趾关节背屈,从而降低跖骨头处的压力负荷。半鞋,是围手术期常用的减轻足底压力的器具,它有两种设计,一种是从足跟部拆除部分鞋底(Heel wedge®),另一种是从前足近跖骨头处拆除部分鞋底(Ortho Wedge®)。
治疗鞋,可降低糖尿病患者的前足底压力,一项基于实验室步态分析的研究甚至认为,治疗鞋在降低足底压力方面的效果是TCC和RCW的9倍;鞋内压力分析显示治疗鞋在预防足溃疡复发方面的效果明显(P=0.045)且优于普通鞋类(RR=0.34;95%置信区间0.15-0.79),但由于样本量小、研究方法和结果异质性,故证据质量较低[222]。治疗鞋在溃疡愈合方面的作用不及TCC,一项研究比较了一种具有摇椅底和8 mm厚塑料软弹性鞋垫的特制鞋(治疗鞋组),与一种具有可变刚度玻璃纤维材料制成的不可拆卸式纤维玻璃石膏(石膏组)两者之间的作用,结果显示,石膏组DFU面积下降更迅速(P=0.000 4),30 d时愈合率为50%(治疗鞋组仅为20.8%)[229]。
半鞋,比传统伤口治疗有更高的促足溃疡愈合率。研究显示,穿半鞋伤口治疗组患者DFU的愈合时间为70 d,明显短于单纯伤口治疗组患者DFU的愈合时间(118 d);同样,与对照组(41%)相比,半鞋组(4%)的住院率较低[230]。其后进行的比较研究表明,前足底第1跖趾关节处的半鞋,减压效果不及TCC和RCW[231]。也有研究认为,传统的或标准的治疗鞋虽然可降低足底压力44%~64%,但对足溃疡愈合却无明显优越性。一项非对照研究结果表明,踝高度的石膏鞋、半鞋和前足减压鞋能使DFU在较短的时间内愈合,愈合率为70%~96%,平均愈合时间为34~79 d[232]。
总体来说,减压鞋,耗时且技术上难以制造,又因易于拆卸大大降低了其减压效果,与其他更易获得的减压方式相比有明显的不足。2000年,有研究人员研发了一种RCW和治疗鞋的交叉品种,被称为"MABAL"的鞋。MABAL鞋的设计旨在提供比传统治疗鞋跟大的足部接触面积。一项回顾性研究证实了该鞋的有效性,23例DFU患者使用MABAL鞋后,足溃疡愈合率为91%(23例溃疡中有效的为21例)、平均愈合时间为34 d(7~75 d),因此作者认为"MABAL"鞋的效果与TCC相似,但其制造和应用需要专业技术知识[233]。
因此,所有关于治疗鞋或半鞋(后跟或前足减压鞋)研究的证据等级中等,本共识对不适合或不能耐受RCW的患者,使用治疗鞋或半鞋(后跟或前足减压鞋)仍然作强烈推荐。
IWGDF明确指出,糖尿病足的预防有5个关键的要素:(1)识别有风险的脚。(2)定期检查有风险的脚。(3)对患者、家属和医疗保健提供者的教育。(4)日常穿合适的鞋。(5)治疗溃疡前兆病变。本共识也针对以上5个方面提出了指导性推荐意见。
推荐44:根据足病危险因素,对糖尿病患者进行足病风险分层(推荐程度为强,证据等级为中等)
理论依据:糖尿病患者足病危险因素与DPN和PAD有关。DPN作为最常见的危险因素,研究显示DPN可使得足溃疡风险增加9~32倍,与骨突出、关节活动受限、关节畸形、胼胝、组织性能改变、有过足部手术史、神经性骨关节病变有关[12];同时,不适当鞋袜、赤足行走、跌倒和意外事故、鞋内异物和活动量大等外在因素的存在加大了溃疡风险[234]。PAD通常是无症状的,常见于年龄超过50岁(尤其是超过65岁)、糖尿病、高血压、高脂血症、家族性PAD病史、吸烟史、糖尿病足病史、曾经血管检查结果异常、有血管介入或搭桥手术史、动脉粥样硬化病史等患者,表现为长距离行走功能降低(大约1/3无症状患者,每周只能走不到6个街区)、伤口愈合潜力受损、感染和截肢风险增加。一项中国的流行病学研究显示,78.8%糖尿病患者有DPN、48%的患者有PAD,足溃疡中神经缺血性溃疡占53.1%、单纯神经性和单纯缺血性溃疡分别占21.2%和23%[118]。
根据足病危险因素对糖尿病患者进行足病风险分层,有不同的分类方法。ADA于2008年开发了一种综合足部检查和风险的评估工具,在该评估中,足溃疡风险分为0~3类,复发性足溃疡风险逐步提高。苏格兰糖尿病足小组与苏格兰健康信息-糖尿病合作组,将糖尿病足风险分层和试验系统(也称为"红绿灯"系统)概念化,在该系统中,足溃疡风险分为低、中、高,分别用绿色、黄色和红色进行颜色编码,并在一项涉及3 500多例患者的研究中得到了证实,高风险组患者足部溃疡风险增加了83倍,而低风险组患者在随访2.4年后保持无溃疡的概率为99.7%;"活跃"风险类别高于"高风险"类别,属于目前溃疡、传播感染、危重肢体缺血的体征和症状,或突然出现发红、肿胀、足部温度升高(有或无疼痛)的患者[235]。对"红绿灯"足部风险分层进行了修订,将肾脏疾病作为风险因素之一,并将""缓解期"组纳入高风险类别。德克萨斯大学分级系统(UT分级系统),将糖尿病患者足部危险因素为6个等级,其中1~3级为足溃疡危险因素、4~6级为截肢危险因素。IWGDF将糖尿病足危险因素分为3个等级,1级为有DNP、无PAD、无足畸形或关节活动受限,2级为有DNP和足畸形或关节活动受限和/或PAD,3级为有足溃疡或截肢或夏科足病史。总之,本共识建议,根据足病危险因素,对糖尿病患者进行足病风险分层。
推荐45:按照足病风险分层结果,至少每年1次对糖尿病患者进行足部神经、血管等状况的全面评估(推荐程度为强,证据等级为低)
理论依据:按照风险分层结果,对糖尿病患者进行足部检查和评估。糖尿病患者的足部评估,应由足病医师、医师或其他接受过糖尿病足部护理培训的医疗专业人员完成。虽然证据质量较低,但是IWGDF仍强烈推荐具有高危因素糖尿病足患者每年进行足部检查并寻找神经和动脉病变的表现症状,具体为(1)无DNP、PAD、足畸形或关节活动受限时,每年检查1次。(2)风险等级1级,每年检查2次。(3)风险等级2级时,每年检查2~4次。(4)风险等级3级时,每年检查4~12次[143]。筛查应该由训练有素的医疗专业人员进行。筛查方法和证据见周围神经病变和周围动脉病变章节。所有关于根据足病危险因素对糖尿病患者群进行足病风险分层研究的证据等级高,因此本共识强烈推荐;而按照风险分层结果,至少每年1次对糖尿病患者进行足部全面评估证据等级低到中等,但此工作对早发现、早干预的预防工作很重要,本共识也做强烈推荐。
推荐46:糖尿病足健康教育,能有效预防糖尿病足的发生(推荐程度为强,证据等级为中等)
理论依据:糖尿病患者教育在临床实践中得到了广泛的提倡和实施。我们推荐,由糖尿病专科教育护士牵头,组建由医师、营养师、康复师以及支具工程师等构成的团队,对患者及其家属进行适当的足部护理教育。教育内容包括:(1)足部护理和鞋类建议,例如保持良好的足部卫生习惯,在干燥区域使用润肤霜、正确修剪趾甲、在家穿柔软减震拖鞋并避免赤脚等。(2)溃疡护理原则指导,强调休息、穿鞋、定期敷料和经常观察感染症状的重要性,并让糖尿病患者和家属学会辨别肿胀、疼痛、变色和皮肤破裂这4个危险征象。在临床实践中,教育经常与其他预防性干预措施相结合,旨在直接改善患者的健康状况。例如,无明显感觉神经病征象或周围血管状况的患者,建议定期进行趾甲修剪和胼胝切除;由于自主神经病变使得汗腺缺失神经支配,常导致糖尿病患者足部无汗或干燥,易形成裂口,建议患者在这些干燥的部位涂抹润肤乳霜。教育对糖尿病足预防和治疗作用的研究绝大部分缺乏对照,且无偏倚性分析。例如,一项观察到,坚持90~120 min足部护理教育的患者溃疡发生率(3.1%)明显低于不坚持该计划的患者(31.6%,P<0.001)[236];另一项更大的非对照研究显示,教育后,每周坚持至少5 d足部护理患者的溃疡发生率降低了5%,而不坚持足部护理患者的溃疡发生率为26%(P<0.000 1)[237];一项RCT研究评估了患者教育的效果,显示在长达12个月的患者教育期(每天1次,每次60 min),与标准护理相比,在预防溃疡方面无显著差异[238];高危足患者教育后随访1年效果明显,截肢相对危险0.33(95%置信区间=0.15~0.76)、溃疡相对危险0.31(95%置信区间=0.14-0.66)[239],但该研究偏倚风险大,可能教育作用被高估。总之,虽然尚无证据证明教育能够直接降低DFU发病率和截肢率,本共识仍强烈推荐临床应该重视糖尿病足的健康教育作用和实施。
推荐47:足部无结构性畸形或周围神经病变的低风险患者,可以穿普通鞋、不必要使用治疗鞋(推荐程度为强,证据等级为低)
推荐48:对于有足溃疡史、大或小截肢史、Charcot神经性关节病足畸形等高危或极高危患者,建议使用有减压矫形作用的治疗鞋具以预防足溃疡及溃疡复发(推荐程度为强,证据等级为中等)
理论依据:IWGDF指南指出,使用治疗鞋具能使有足溃疡史、部分截趾/截肢史、足畸形,甚至夏柯关节病等高危患者足部溃疡发生相对风险降低达70.2%,并建议使用订制治疗鞋具来预防DFU发生;相反,低风险患者,不建议使用此类鞋,常规鞋子即可,但要对其合适穿鞋提供指导。足底压力测量对高压点识别和减压鞋改良具有重要作用。较多前瞻性研究证实(1)糖尿病患者光脚走路导致足底机械性压力明显增加,是溃疡发生独立的危险因素[25]。(2)减压鞋、鞋垫或订制其他可调节矫形器,能有效缓解前足底压力,例如,Ulbrecht等[240]利用足底压力峰值设计了订制矫形器具,且证明这种器具能明显降低足底跖趾头处溃疡的复发率(P=0.003)。
关于鞋具在预防溃疡复发方面的效果,有不同的结果。几项RCT报告已经显示治疗鞋使用能降低糖尿病患者足溃疡相对风险,例如一项研究在1年、3年和5年的随访中观察到,穿治疗鞋的患者足溃疡复发的发生率明显低于标准治疗的患者[241];但另一项研究报道,2年时间内订制治疗鞋、预制治疗鞋和普通鞋3组之间溃疡复发率无显著差异[48]。很多研究认为订制鞋垫的使用能有效预防DFU发生或复发,例如Ulbrecht等的研究就支持了该观点(分别为订制鞋垫组复发率为9.1%、对照组为25.0%,P=0.007)[240];Cox回归模型中鞋垫治疗和足部并发症史是显著影响因素,使用普通鞋垫导致溃疡复发风险是使用订制鞋垫患者的3.5倍(RR=3.47;95%置信区间=0.96-12.67)[242]。合适的鞋子应该有宽而深的鞋头、柔软的皮革材料,以最大限度地减少压力和适应足趾变形。需要注意的是,许多情况下,患者对鞋具的依从性很低,特别是在家中,很多患者甚至都未意识到应该使用治疗鞋具;对于另一些患者来说,他们可能在使用或拆卸鞋具时遇到很多困难,感觉太热或太重,或者有一些文化或宗教原因;同时因为订制鞋具比普通鞋具更昂贵,定期去医师办公室更换创面敷料也需要费用,因此成本也是一个大问题。总之,在证据等级低到中等的情况下,本共识建议,低风险患者群可以穿普通鞋、不必要使用治疗鞋,而高危或极高危患者建议使用有减压矫形作用的治疗鞋具以预防足溃疡及其复发。
推荐49:针对所有糖尿病患者,积极消除足底胼胝、鸡眼、嵌甲、脚气、水疱、皲裂等足溃疡前兆,有助于预防足溃疡(推荐程度为强,证据等级为中等)
理论依据:研究观察到,近一半糖尿病患者有足趾畸形,如拇趾外展、长第二跖骨等,常会导致足趾远端异常压力区形成,胼胝可能每天能增加足底18 600 kg的压力[243]。足部高压区,与不合适鞋具摩擦后局部皮肤增厚,老茧和鸡眼等足溃疡前兆征象形成,一定程度上可以保护足部免除压力或摩擦可能造成的开放性伤口,但很厚很硬时反会压迫足局部、引起疼痛、皮下出血、甚至更深的伤口或溃疡。嵌甲、脚气、水疱和皲裂也是临床常见的足溃疡前兆,临床有足溃疡危险的患者应该受到保护,免受异常机械力的影响。尽管最佳削除频率仍不清楚,但用手术刀将胼胝和鸡眼清除能有效预防足溃疡的做法已得到共识。手术削除能有效降低足底压力约30%,且修剪频率应该根据鞋内足底动态压力的变化来确定,不应该根据胼胝或老茧的质量来定[244]。研究认为,手术刀削除胼胝能使足底压力峰值降低26%~58%(P<0.001)、持续时间逐步缩短150 ms(P<0.05)[245]。另一项前瞻性研究显示,对于降低足底压力而言,单用支具能降低30%;仅手术削除能降低29%;而支具联合手术削除治疗能达到59%[246]。趾甲内生、真菌感染或水疱的患者应及时就医,包括部分趾甲拔除、局部抗真菌药物使用和水疱引流;不推荐用药膏或药水,因为后者的活性成分多是酸,容易腐蚀周围皮肤影响伤口愈合、甚至有些会造成伤口;最后,对患者进行局部感染症状的教育,一旦发现感染,立即去医院治疗。总之,即使在证据等级中等的情况下,本共识仍强烈建议,针对所有糖尿病患者,应积极消除足底胼胝、鸡眼、嵌甲、脚气、水疱、皲裂等足溃疡前兆,预防足溃疡。
推荐50:外科手术减压治疗,是DFU防治的有效手段(推荐程度为弱,证据等级为中等)
理论依据:DFU发病率高,且复发率4个月内能达40%、3年内更是高达60%,且这种溃疡的新发和复发多与足部骨性突出引起的局部高压有关[5]。手术治疗骨性突出能有效预防DFU的发生和复发,既往很多回顾性研究已经能证明。一项半交叉RCT,将100例神经性糖尿病前足溃疡患者群按照2:3比例随机分为手术治疗组和非手术治疗组,手术组有经皮屈肌肌腱切开术、微创浮动跖骨截骨术或Keller关节成形术等方式,正是对手术治疗的有效性进行了有力证明[247]。但鉴于目前这方面的RCT证据并不多,2019年IWGDF最新指南仍然未对手术预防DFU的有效性和安全性做出明确声明,因此,本共识仅作弱推荐。
目前常用于糖尿病足预防的手术方式有以下几种,有些理论证据比较充分、有些则不足。
是一种通过在跟腱上进行小切口切开来完成的手术,目的是延长跟腱,使患者能够平足行走、膝盖不弯曲或减轻慢性疼痛。一项RCT研究将患者群随机分为31例跟腱延长术组、33例TCC保守治疗组,两组溃疡愈合率无差异、溃疡复发率差异明显(随访7个月,分别为15%、59%,P=0.001;随访2年,分别为38%、81%,P=0.002),且手术组前足底压力峰值降低明显(P<0.0002),结论提示跟腱延长术能降低足溃疡复发风险(7个月内降低75%、2年内降低52%),尤其适用于踝关节背屈受限(≤5°)的糖尿病前足神经性足底溃疡治疗[248](图20)。


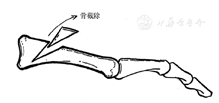
一项随访13个月的研究,观察了20例经历背屈跖骨截骨术(22次)的慢性或复发性前足神经性溃疡患者群,手术包括冲洗、清创、通过足背入路进行基底闭合楔形跖骨截骨术,术后40 d时95%溃疡完全愈合且无一例复发,说明背屈跖骨截骨术是顽固性神经性前足溃疡治疗的一种可靠方法。但手术并发症多(15例,68%):急性夏柯足(32%)、深部伤口感染(14%)、相邻跖骨头下转移性病变(9%)等[249](图21)。

诸多研究已显示PFT是一种安全有效的手术方法,其中一项RCT检索了42篇文章,其中有5个研究符合要求,共计163例患者接受了250次屈肌肌腱切开术,溃疡治愈率高(2个月为92%~100%)、复发率低(术后随访22个月为0~18%)、感染或新畸形的发生率较低。作者认为有4级证据表明屈肌肌腱切开术有助于溃疡愈合和防止溃疡再复发[250];但不能忽视的是,关于PFT防治糖尿病足趾溃疡研究的设计大多存在不足,例如,缺乏对照组、非随机设计以及干预后随访期报告不一致等,使得结果的有效性受到影响(图22)。


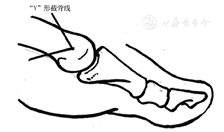
治疗跖骨头1~5下的压力性溃疡(图23、图24)。一项小样本的RCT研究对比了DMMO手术治疗(切除前足溃疡下的骨片段并手术关闭创面)与传统治疗在神经性溃疡中的作用,结果显示手术治疗能明显提高溃疡治愈率和缩短愈合时间、降低感染并发症,6个月随访溃疡复发率也低(分别为8/24、3/22,P<0.01)。尽管6个月的随访期可能太短,无法长期评估真正的结果,但值得注意的是,手术治疗的创面处无一例溃疡复发;作者认为骨切除术有可能导致新的压力点形成甚至发生继发性溃疡,但即使如此,新的溃疡发生率也要低于保守治疗溃疡的复发风险[251]。还有1项研究针对30例有前足底溃疡(35处溃疡,Texas分类多为B3型)的患者,做DMDO手术后,愈合时间为4~17(7.9 ± 4.0)周、美国矫形足踝协会评分从55.3分提高到81.4分(P<0.001)、随访18~71个月(平均25.3个月),无溃疡复发[252]。因此,无论病变的严重程度如何,微创DMMO/DMDO是一种通过降低跖骨头下足底高压促进前足底DFU愈合的安全有效方法,能有效改善其功能和结构,减少并发症。

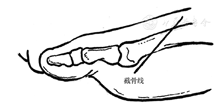

改良之处在于对趾骨的截骨量由1/2~ 1/3改为1/4,既能达到治疗效果又能避免截骨过多造成拇趾缩短、无力和稳定性差。一项回顾性研究观察了改良Keller手术治疗11例患者13个拇趾底面溃疡的效果,术后6个月内溃疡全部愈合,随访1年8个足溃疡无复发、5个有转移性溃疡[253]。因此,尽管有局限性,改良Keller切除成形术仍然是糖尿病足拇趾底面溃疡的有效治疗方法。
总之,尽管证据等级不足,但鉴于跟腱延长术、跖趾关节成形术等手术方式已经在临床应用且取得了一定疗效,本共识推荐,外科手术减压治疗是DFU防治的有效手段,但一定要根据患者具体情况,严格把握适应证和防止手术并发症。
本共识特别指出,在糖尿病足预防过程中,要结合足病风险分层、定期检查、教育、合理鞋具使用和溃疡前兆病变治疗这5个要素进行综合性足部护理;同时,要因地制宜地去为患者提供足部减压材料,例如鞋垫、各种垫片,甚至在患者足底高压区将对应区域鞋垫挖空等。
本临床实践专家共识围绕糖尿病足评估、诊断、治疗和预防几个部分展开,着重于临床的可操作性;强调采取多学科合作下的综合治疗措施,内科治疗贯穿整个围手术期的始终;而外科手术的时机和方式,是糖尿病足治疗的关键,也是有效预防足溃疡的手段。无法回避的是,本共识仍存在一定的局限性,很多问题未能回答,糖尿病及足病患者群体个体差异又大,希望业内同行提供意见和建议,共同促进糖尿病足诊治处理的规范化。本共识全部推荐条款汇总
推荐1:针对所有糖尿病足患者群,进行全面医学评估,尤其是心脑肾等重要脏器功能及其危险因素,以及下肢病变情况的评估(推荐程度为强,证据等级为低)
推荐2:DFI是基于局部或全身炎症症状和体征的临床诊断(推荐程度为强,证据等级为中等)
推荐2.1:若临床检查模棱两可或无法解释,考虑将炎症血清生物标志物,如CRP、红细胞沉降率(ESR)、PCT等作为辅助诊断,用于DFI诊断(推荐程度为强,证据等级为低)
推荐2.2:几乎所有临床感染的溃疡,都要收集其组织标本进行培养以确定致病菌(推荐程度为强,证据等级为中等)
推荐3:存在深或大溃疡、骨突出部位溃疡或慢性不愈合溃疡等征象时,应高度怀疑骨髓炎可能,需要进一步做骨探针、X线片和核磁共振等检查(推荐程度为强,证据等级为中等)
推荐3.1:在所有DFI患者群中,建议进行足部X线平片(plain film radiography,PFR)检查,以确定骨异常(畸形,破坏)、软组织气体和异物(推荐程度为强,证据等级为中等)
推荐3.2:对怀疑有软组织脓肿或DFO诊断尚不确定时,推荐使用磁共振成像(MRI)作为评估手段(推荐程度为强,证据等级为低);对怀疑DFO而又不能行MRI检查者,建议骨扫描结合白细胞或抗粒细胞扫描(推荐程度为弱,证据等级为低)
推荐3.3:骨活检及骨组织细菌培养是DFO诊断金指标(推荐程度为强,证据等级为高)
推荐4:DFI严重程度,建议使用IWGDF/IDSA的相关标准(推荐程度为强,证据等级为中等);脓毒症诊断标准,建议采用中华危重症医学分会的相关指南(推荐程度为强,证据等级为中等)
推荐5:所有糖尿病患者(即使无足溃疡存在),至少每年通过病史采集和足脉搏触诊检查外周动脉;年龄>50岁、既往有DFU史、心脑血管粥样硬化史、下肢血管检查异常、血管介入或搭桥手术史等任何一种情况时,至少每1~3个月检查1次(推荐程度为强,证据等级为低)
推荐6:踝肱指数是目前评价PAD的首选检查项目,结合趾肱指数(toe branchial index,TBI)、足背或胫后动脉的多普勒波形、经皮氧分压(percutaneous oxygen partial pressure,TcPO2)等能提高下肢缺血诊断的准确率(推荐程度为强,证据等级为中等)
推荐7:在无创检查提示存在缺血且临床考虑行下肢血管重建术治疗的情况下,需要根据病情适当选择进一步的检查(推荐程度为强,证据等级为中等)
推荐8:使用包括10 g单丝压力觉和其他测试(振动觉、针刺痛觉和冷/热温度感觉、腱反射)评估DPN (推荐程度为强,证据等级为中等)
推荐9:DPN的诊断标准大致参照《中国2型糖尿病防治指南》和美国糖尿病学会(ADA)立场声明(推荐程度为弱,证据等级为中等)
推荐10:对全面评估后的糖尿病足人群,按照一定的诊断依据和诊断流程进行诊断和鉴别诊断(推荐程度为强,证据等级为低)
推荐11:当糖尿病患者的足溃疡出现在不常分布部位、不典型外观或对常规治疗反应不佳时,需要进行鉴别诊断(推荐程度为强,证据等级为中等)
推荐12:糖尿病足的分类和分级方法很多,各有利弊;TEXAS伤口分类系统兼顾病因和病变程度并已得到验证,建议用于临床(推荐程度为强,证据等级为中等)
推荐13:建议手术前评估糖尿病足患者的深静脉血栓(DVT)、出血、压疮和麻醉风险,以提高其手术安全性(推荐程度为强,证据等级为中等)
推荐14:成立多学科的保肢团队,成员包括内分泌科医师、足踝外科医师、血管外科医师、感染科医师等;必要时,及时向上级糖尿病足治疗中心请求会诊和/或转诊,有助于降低糖尿病足患者的截肢率和病死率(推荐程度为强,证据等级为低)
推荐15:良好血糖控制(避免低血糖发生),可促进DFU愈合、降低患者足溃疡感染和截肢风险(推荐程度为强,证据等级为中等)
推荐16:糖尿病足患者合并高血压时,个体化选择降压药物,并将血压控制目标设定为<130/80 mmHg(1 mmHg=0.133 kPa),老年或危重患者放宽至140/90 mmHg(推荐程度为强,证据等级为中等)
推荐17:糖尿病足患者合并高脂血症时,采取生活方式调整,并根据年龄和有无动脉粥样硬化危险因素决定他汀类药物的使用强度和剂量(推荐程度为强,证据等级为中等)
推荐18:糖尿病足患者合并冠心病/外周动脉粥样硬化时,建议每晚给予阿司匹林100 mg治疗;不耐受阿司匹林者,给予氯吡格雷75 mg/d替代(推荐程度为强,证据等级为中等)
推荐19:糖尿病足患者合并心功能不全时,行吸氧、镇静、扩血管和利尿等治疗,必要时立即转诊至心脏科或ICU继续治疗(推荐程度为强,证据等级为低)
推荐20:按照DVT、出血、压疮和麻醉风险分层的结果,进行糖尿病足患者围手术期相应风险的预防(推荐程度为强,证据等级为中等)
推荐21:针对病因,积极控制高血糖并保持血糖稳定是DPN治疗的基础(推荐程度为强,证据等级为高)
推荐22:针对DPN病理生理学改变、微循环病变、神经营养和修复异常等方面进行治疗,一定程度上能改善周围神经功能(推荐程度为弱,证据等级为低)
推荐23:DPN患者疼痛时,某些抗惊厥药和抗忧郁药为一线用药,阿片类不能作为一线或二线推荐(推荐程度为强,证据等级为中等)
推荐24:糖尿病足溃疡经过6周以上积极治疗,仍无明显愈合迹象,不管无创检查结果如何,可考虑直接行血管造影,必要时血管重建术(推荐程度为强,证据等级为低)
推荐25:既往行血管重建手术的糖尿病足患者,术后症状恢复或者检查结果提示合并中重度下肢缺血,不论手术时间远近,都应该重新评估当前下肢血管情况,再决定下一步治疗方案(推荐程度为强,证据等级为低)
推荐26:术前应充分评估心血管危险因素、充分考虑手术获益是否大于手术风险、详细术前讨论方案,并与患者及家属沟通手术方案及注意事项(推荐程度为强,证据等级为低)
推荐27:糖尿病足溃疡合并PAD患者进行血运重建时的目标是,恢复至少1条足动脉的直接血流,最好是溃疡解剖结构内的动脉(推荐程度为强,证据等级为低)
推荐28:糖尿病足合并外周动脉病变,可采取旁路移植术和腔内治疗2种方法重建血运;目前无充分证据证明,哪一种方法更优(推荐程度为强,证据等级为中等)
推荐29:下肢动脉重建手术,要求由专业人员在年开展一定的血管重建病例数的糖尿病足中心内完成(建议每年>20例)(推荐程度为强,证据等级为低)
推荐30:根据临床感染的严重性、细菌培养和药物敏感试验结果,以及机体肝肾功能等因素的综合判断,来确定糖尿病足感染的抗生素使用(剂型、剂量、给药方式和疗程)(推荐程度为强,证据等级为高)
推荐31:重度感染合并脓毒症患者,建议积极处理足溃疡局部与全身相关治疗,包括重症监护,并联系有糖尿病足专科的医院(推荐程度为强,证据等级为中等)
推荐32:糖尿病足溃疡清创方法的选择要个体化(推荐程度为强,证据等级为中等)
推荐33:对于部分中度和所有重度感染性糖尿病足溃疡,尤其是合并脓肿、湿(气)性坏疽或坏死性筋膜炎时应行紧急清创手术(推荐程度为强,证据等级为中等)
推荐34:缺血性糖尿病足合并感染时,应遵循先切开引流和清理坏死组织(不扩创)以控制急性感染,在下肢血供恢复后再彻底清创的原则(推荐程度为强,证据等级为中等)
推荐35:有骨质破坏,保守治疗无效时,根据术前影像学检查、组织病理学或细菌学结果确定手术骨切除范围;并根据足部生物力学已有的改变,选择骨性重建方法;感染导致的骨缺损,必要时可在骨切除部位用含有敏感抗生素的材料(骨水泥、生物陶瓷等)临时性填充空腔,后期再行骨性重建手术(推荐程度为强,证据等级为中等)
推荐35.1:足趾骨质破坏,建议手术切除受累的足趾组织;并考虑软组织松解术、趾间关节融合术(推荐程度为强,证据等级为低)
推荐35.2:第1跖趾关节破坏,建议手术切除趾骨近端基底部、第1跖骨头软骨和受累的屈肌腱和籽骨;并考虑第1跖趾关节成形术(推荐程度为强,证据等级为中等)
推荐35.3:第2~5跖骨骨感染导致骨质破坏,建议行跖骨头部分或全部切除术;足底未形成溃疡或溃疡未侵犯关节时,可考虑行跖骨头部分切除术、V形截骨术或Weil截骨术(推荐程度为强,证据等级为中等)
推荐35.4:前足广泛软组织和/或骨质破坏,或部分跖骨头切除术后出现转移性溃疡,局部治疗又失败的情况下,考虑行多跖骨头联合切除术(前足成型术)或经跖骨截肢术(推荐程度为弱,证据等级为高)
推荐35.5:前中足骨质及关节破坏严重,TMA无法实施或实施后无效的情况下,考虑跖跗关节离断术(Lisfranc截肢术)和跗横关节离断术(Chopart截肢术)(推荐程度为弱,证据等级为中等)
推荐35.6:中足多个关节不稳定时,需要个体化选择单纯骨突切除术(带或不带筋膜皮瓣)、Ⅰ期关节固定术或骨切除多平面重排术等手术方式,以达到纠正足畸形、降低足高压区压力,并保持足稳定性的目的(推荐程度为弱,证据等级为中等)
推荐35.7:当跖跗关节/跗骨关节被严重破坏、保守治疗无效时,考虑行中足和/或中后足关节融合术(推荐程度为弱,证据等级为中等)
推荐35.8:当踝关节和距下关节被严重破坏、保守治疗无效时,考虑行踝关节和距下关节融合术,即距骨周围关节融合术(推荐程度为弱,证据等级为低)
推荐35.9:足跟溃疡,需要彻底清除病变的软组织和骨质,感染导致的骨缺损可用含有敏感抗生素的材料(骨水泥、生物陶瓷等)临时性填充,后期考虑自体髂骨移植和/或皮瓣转移覆盖创面(推荐程度为强,证据等级为低)
推荐35.10:后足复杂骨畸形不能通过非手术治疗维持行走功能时,考虑外固定关节融合术,甚至踝上截肢术(推荐程度为强,证据等级为中等)
推荐36:每1~4周评估与测量糖尿病足溃疡大小和进展情况,并按照TIME原则进行创面准备(推荐程度为强,证据等级为低)
推荐37:根据年龄、心肺功能等基础情况,以及创面(大小、深度、位置和血供)准备程度等,来选择相应的软组织修复技术并做充分的术前准备(推荐程度为强,证据等级为低)
推荐38:合理使用敷料产品,保持创面床湿润、控制渗出以避免创面周围完整皮肤浸润,并营造促上皮生长环境(推荐程度为强,证据等级为低)
推荐39:在创面血供充足、感染组织已彻底被清除的情况下,可选择负压治疗辅助进行创基准备(推荐程度为强,证据等级为低)
推荐40:糖尿病足溃疡仍无改善(面积缩小<50%),可选择高压氧、细胞生长因子和生物工程皮肤替代物等治疗(推荐程度为弱,证据等级为中等)
推荐41:不可拆卸式全接触式石膏是DFU的一线治疗方法(推荐程度为强,证据等级为高)
推荐42:当TCC或其他不可拆卸助行器使用条件与患者条件相矛盾或不耐受时,足底溃疡患者可考虑使用全长RCW(推荐程度为强,证据等级为中等)
推荐43:如果患者不适合或不能耐受RCW,建议使用治疗鞋或半鞋(后跟或前足减压鞋) (推荐程度为强,证据等级为中等)
推荐44:根据足病危险因素,对糖尿病患者进行足病风险分层(推荐程度为强,证据等级为中等)
推荐45:按照足病风险分层结果,至少每年1次对糖尿病患者进行足部神经、血管等状况的全面评估(推荐程度为强,证据等级为低)
推荐46:糖尿病足健康教育,能有效预防糖尿病足的发生(推荐程度为强,证据等级为中等)
推荐47:足部无结构性畸形或周围神经病变的低风险患者,可以穿普通鞋、不必要使用治疗鞋(推荐程度为强,证据等级为低)
推荐48:对于有足溃疡史、大或小截肢史、Charcot神经性关节病足畸形等高危或极高危患者,建议使用有减压矫形作用的治疗鞋具以预防足溃疡及溃疡复发(推荐程度为强,证据等级为中等)
推荐49:针对所有糖尿病患者,积极消除足底胼胝、鸡眼、嵌甲、脚气、水疱、皲裂等足溃疡前兆,有助于预防足溃疡(推荐程度为强,证据等级为中等)
推荐50:外科手术减压治疗,是DFU防治的有效手段(推荐程度为弱,证据等级为中等)
顾问:付小兵(解放军总医院第四医学中心)、冉兴无(四川大学华西医院)、许樟荣(战略支援部队特色医学中心)、刘超(江苏省中西医结合医院)、薛耀明(南方医科大学南方医院)、汤正义(上海交通大学医学院附属瑞金医院)、包俊敏(海军军医大学附属长海医院)
组长:胡寅(江苏省医学会)
专家组成员(单位名称以拼音排序、姓名以姓氏笔画排序):东部战区空军医院王爱萍、李一卉、陆萌、陈约东、陈金安,江南大学附属医院(无锡市第三人民医院)吕国忠、储国平,江苏省人民医院马向华、张浩、蒋琳,江苏省医学会冯玮,江苏省中西医结合医院郑仁东,南京鼓楼医院朱大龙、王炜,南京市第一医院杨蓊勃、桂鉴超、蒋逸秋,苏州大学第二附属医院胡吉,苏州大学附属第一医院成兴波,新加坡国立大学Johnson Boey,徐州市中心医院耿厚法,中国疾病预防控制中心王文绢
执笔:王爱萍(东部战区空军医院)、吕国忠[江南大学附属医院(无锡市第三人民医院)]、成兴波(苏州大学附属第一医院)、马向华(江苏省人民医院)、冯玮(江苏省医学会)
利益冲突 所有编写组成员均声明不存在利益冲突,无商业组织向本共识编写组支付费用



























