
初步探讨改性纳米生物玻璃水凝胶的制备以及它的理化、生物学特性。
(1)取400 mL氢氧化钙饱和溶液,加入纳米二氧化硅悬液67 mL,制备纳米生物玻璃悬液,观察其悬浮稳定性。(2)制备终质量分数为10%明胶、1%海藻酸钠的水凝胶,设为对照组;在对照组水凝胶基础上加入实验(1)制备的纳米生物玻璃悬液,制备终质量分数为0.5%生物玻璃、10%明胶、1%海藻酸钠的水凝胶,设为实验组。观察2组水凝胶在4、25 ℃的成胶情况并记录成胶时间及在37 ℃的熔解情况并记录熔胶时间。另取2组水凝胶,4 ℃冷浴后用25 g/L的氯化钙溶液交联,用杨氏模量测定仪测量压缩模量。另取2组水凝胶,同前交联后于-20 ℃冻干,测量相关体积并计算孔隙率。样本数均为3。(3)取12只24 h龄C57BL/6J小鼠乳鼠,分离培养成纤维细胞(Fb),倒置显微镜下观察其形态,并培养第3代Fb,用于后续实验。取Fb,制备细胞浓度为1×105个/mL的单细胞悬液,按随机数字表法(下同)分为实验组和对照组,分别加入实验(2)制备的实验组和对照组液态水凝胶,培养12、24、48 h,每组各取3孔,采用细胞计数试剂盒8法检测细胞存活率。(4)取第3代Fb,制备细胞浓度为(3.0~4.5)×107个/mL的单细胞悬液,分为实验组和对照组,每组1管,加入绿色荧光探针DIO染色,分别加入实验(2)中制备的实验组和对照组液态水凝胶9 mL,同前交联后制备载细胞水凝胶。培养3 d,激光共聚焦显微镜下观察细胞在凝胶中的存活情况;同前制备载细胞水凝胶块但不加绿色荧光探针DIO,培养7 d,在扫描电子显微镜下观察细胞在水凝胶中的黏附及伸展情况。(5)取6周龄雌性BALB/c-nu裸鼠12只,分为实验组和对照组,每组6只,在背部制作直径为1 cm的圆形全层皮肤缺损创面,伤后即刻,分别放入1块实验(4)制备的实验组和对照组载细胞水凝胶块。伤后7、14 d,每组取3只裸鼠,收集创面及创周组织,苏木精-伊红染色,观察创面愈合情况。对数据行独立样本t检验。
(1)纳米生物玻璃粒子可在水中均匀分散,具有良好的悬浮稳定性。(2)2组水凝胶在37 ℃下均呈熔融状态,均未见粒子析出。实验组和对照组水凝胶在37 ℃下的熔胶时间分别为5、10 min,在25 ℃下成胶时间分别为30、180 min,在4 ℃下成胶时间分别为5、10 min。实验组水凝胶压缩模量为(53±6)kPa,明显高于对照组的(23±6)kPa(t=6.364,P<0.01)。实验组水凝胶孔隙率为(86.1±2.1)%,与对照组的(88.2±4.4)%相近(t=1.210,P>0.05)。(3)细胞呈长梭形,细胞核所占比例较大,符合Fb形态学特征。培养12、24、48 h,实验组细胞存活率为(84±4)%、(89±4)%、(130±10)%,与对照组的(89±5)%、(90±4)%和(130±11)%相近(t=1.534、0.611、0.148,P>0.05)。(4)培养3 d,2组细胞在水凝胶中形态完整,未见细胞核裂解、消失,细胞质保持完好,并且实验组细胞荧光强度明显强于对照组。培养7 d,实验组和对照组细胞在水凝胶中黏附、伸展,且实验组细胞在水凝胶中黏附数明显多于对照组。(5)伤后7 d,对照组、实验组裸鼠创面面积均缩小,且实验组减小更明显,2组裸鼠创面及创周均可见大量炎症细胞分布。伤后14 d,对照组裸鼠创面面积大于实验组,且创面及创周炎症细胞明显多于实验组。
纳米生物玻璃水凝胶具有良好的理化、生物学特性和载细胞潜能,同时还具有促创面愈合能力,在临床应用方面有着较好的潜力。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
各种原因引起的难愈性创面的治疗是常见且亟待解决的临床难题,传统治疗手段主要包括保守换药、敷料应用和手术治疗,治疗原理是依靠自身的再生修复能力。近年来,随着组织工程技术的发展,采用载细胞水凝胶可促进难愈性创面的愈合[1,2,3]。载细胞水凝胶可以将生物材料、种子细胞以及再生微环境融为一体,使组织工程皮肤有望应用于临床[4,5]。常见制备载细胞水凝胶的材料有明胶、海藻酸钠、壳聚糖、透明质酸等,这些材料的共同特点是具有出色的生物降解性和生物相容性,细胞附着率高以及免疫原性低[6,7,8,9]。在前期研究中,笔者课题组构建了明胶-海藻酸钠载细胞生物水凝胶,该水凝胶不仅具有良好的生物相容性,还能提高细胞的迁移、增殖和分化能力[10,11,12]。然而在实际应用中,该水凝胶因为硬度低、质地软,难以应用于动物创面模型。改性纳米生物玻璃是由纳米二氧化硅粒子经钙离子表面修饰得到的一种生物材料,最初主要用于骨科修复研究,之后逐渐延伸至牙科修复及代替材料研究中[13,14,15,16]。本研究创新性地将改性纳米生物玻璃粒子与笔者课题组前期制备的明胶-海藻酸钠水凝胶结合,以期改善明胶-海藻酸钠水凝胶的理化特性及生物学特性,并在此基础上加入Fb,构建载细胞生物玻璃-明胶-海藻酸钠水凝胶,进而初步探讨其理化特性及生物学特性。
本次研究中涉及动物实验的操作均符合北京市及国家伦理委员会相关规定及要求。
健康无特殊病原体级6周龄雌性BALB/c-nu裸鼠(体质量15~20 g)12只及健康无特殊病原体级24 h龄C57BL/6J小鼠乳鼠12只(体质量1.2~1.5 g)由斯贝福(北京)生物技术有限公司提供,许可证号:SCXK(京)2016-0002。DMEM完全培养基购自美国Gibco公司,青霉素/链霉素、Ⅰ型胶原酶、胰蛋白酶、HE染色液、戊巴比妥钠购自北京索莱宝科技有限公司,纳米二氧化硅粒子悬液、A型明胶、海藻酸钠(分子量198)购自美国Sigma公司,细胞计数试剂盒8(CCK-8)试剂、绿色荧光探针DIO染色剂购自上海碧云天生物技术有限公司,氢氧化钙、氯化钙固体粉末购自北京化工厂。DMi8型倒置显微镜、TCS SP2型激光共聚焦显微镜购自德国Leica公司,S4800型扫描电子显微镜购自日本Hitachi公司,M5567型杨氏模量测定仪购自美国Instron公司,MS7-H550-S型恒温磁力搅拌器购自北京大龙生物科技有限公司,DT5-6B型低速离心机购自北京时代北利离心机有限公司,LGJ-2型冻干机购自北京松源华兴生物技术有限公司,Multiscan MK3型酶标仪购自赛默飞世尔科技(中国)有限公司。
将1.65 g氢氧化钙固体粉末置于烧杯中,加入1 000 mL去离子水,置于恒温磁力搅拌器中,室温搅拌至少12 h后,以离心半径10 cm(离心半径下同),5 500 r/min,室温下离心10 min,取上清液,得到氢氧化钙饱和溶液。取400 mL氢氧化钙饱和溶液于烧杯中,加入纳米二氧化硅悬液(0.5 g纳米二氧化硅粒子加入100 mL去离子水制备而成)67 mL,置于恒温磁力搅拌器,室温下搅拌72 h。10 000 r/min室温下离心10 min,弃去上清液。取沉淀,加入与沉淀体积相同的去离子水,超声振荡洗涤后,同前再次离心、洗涤3次,最后1次离心结束后加入与沉淀体积相同的去离子水,室温搅拌2 h得到纳米生物玻璃悬液,观察生物玻璃粒子在水中的悬浮稳定性。
将明胶、海藻酸钠粉末分别称质量后,加入去离子水,密封烧杯,40 ℃水浴熔解30 min,待明胶、海藻酸钠粉末全部熔解后,用恒温磁力搅拌器在40 ℃下搅拌2 h,制备终质量分数为10%明胶、1%海藻酸钠的明胶-海藻酸钠水凝胶,设为对照组。同前在明胶、海藻酸钠粉末中加入去离子水,待明胶、海藻酸钠全部熔解后,加入纳米生物玻璃悬液,制备终质量分数为0.5%生物玻璃、10%明胶、1%海藻酸钠的生物玻璃-明胶-海藻酸钠水凝胶,设为实验组。2组水凝胶制备完成后于37 ℃静置,如无粒子析出,则水凝胶制备成功。水凝胶制备成功后进行巴氏消毒,即将水凝胶置于70 ℃水浴30 min、4 ℃冷浴5 min,重复3次。消毒完成后放室温平衡1 h,用封口膜密封后4 ℃保存。
称取2.5 g氯化钙固体粉末,置于烧杯中,加入100 mL去离子水,用恒温磁力搅拌器搅拌30 min,使氯化钙充分熔解,得到25 g/L的氯化钙溶液,转移至耐高温玻璃瓶中,高压锅高温消毒灭菌后密封,4 ℃保存。
取2组水凝胶,37 ℃水浴熔解后,置于10 mL注射器中,每组各3管,每管各10 mL,分别于4、25 ℃静置2 h,其间每5分钟观察1次成胶状态,并记录成胶时间;于37 ℃静置2 h,同前观察熔解情况,并记录熔胶时间。
于温度25 ℃、空气湿度30%的实验室进行测量。取2组水凝胶,经37 ℃水浴熔解后,置于10 mL注射器中,每组各3管,每管各10 mL,4 ℃冷浴2 h,待液态水凝胶完全凝固后得到固态凝胶支架,将凝胶支架从注射器取出后,用25 g/L的氯化钙溶液交联12~16 h,弃掉交联剂,用杨氏模量测定仪测量2组水凝胶压缩模量。
取2组水凝胶,经37 ℃水浴熔解后,置于5 mL注射器中,每组各3管,每管各3 mL,4 ℃冷浴2 h后,加入25 g/L氯化钙溶液10 mL交联过夜,弃去交联剂,得到固态凝胶支架,将固态凝胶支架于-20 ℃过夜冻干后得到冻干凝胶。向试管内加入10 mL无水乙醇,记录体积V1;将冻干凝胶放入无水乙醇中,4 ℃放置48~72 h,待冻干凝胶全部吸液沉底后记录试管内总体积V2;将吸液后的凝胶取出,记录试管内的液体体积V3,计算凝胶孔隙率。凝胶孔隙率=(V1-V3)÷(V2-V1)×100%[17]。
取12只小鼠乳鼠,在体积分数75%乙醇中浸泡消毒10 min后,放至含100 g/L青霉素/链霉素的PBS中浸泡10 min,剪去四肢及尾巴,在背部近尾部剪一切口,沿躯干背部正中线剪至头部,钝性分离躯干皮肤。表皮向上、真皮向下,使小鼠皮肤漂浮于2.5 g/L胰蛋白酶溶液中,4 ℃过夜。取3倍胰蛋白酶体积的DMEM完全培养基中和胰蛋白酶,用眼科手术器械将真皮和表皮分离,收集真皮。取真皮组织,用30 g/L Ⅰ型胶原酶消化,过孔径40 μm细胞筛,室温下以1 800 r/min离心15 min,弃上清液,加入DMEM完全培养基重新悬浮。将每张皮制备的细胞接种至1个培养皿中,置于37 ℃、二氧化碳体积分数为5%的无菌细胞培养箱(细胞培养条件下同)中培养,制备原代Fb[18]。取原代Fb,于100倍倒置显微镜下观察细胞形态,24 h后细胞长至80%~90%融合时传代。取第3代细胞,用于后续生物学实验。
取Fb,弃去培养基,用PBS轻轻清洗2遍后,加入胰蛋白酶消化1 min,加入3倍胰蛋白酶体积的DMEM完全培养基中和后,吹打分散,以1 500 r/min离心4 min,弃去上清液,向细胞沉淀中加入适量DMEM完全培养基,用移液器吹打、重新悬浮,制备细胞浓度为1×105个/mL的单细胞悬液。取单细胞悬液,接种至96孔板中,按随机数字表法(分组方法下同)分为实验组、对照组,每孔100 μL,另设置3个空白对照孔,加入DMEM完全培养基100 μL,置于细胞培养箱中培养。待细胞完全贴壁后,更换新的培养基。实验组和对照组细胞中分别加入10 μL经37 ℃水浴熔解的1.3.1中实验组和对照组水凝胶,于细胞培养箱中培养。培养12、24、48 h(每组每个时间点3孔),弃去水凝胶,更换新的培养基加入10 μL CCK-8溶液后,于细胞培养箱中培养1 h。酶标仪测定450 nm处的吸光度值,按试剂说明书中的计算公式计算细胞存活率。
取Fb,同1.6制备细胞浓度为(3.0~4.5)×107个/mL的单细胞悬液。取单细胞悬液于试管中,分为实验组和对照组,每组1管,每管1 mL,分别加入9 mL经37 ℃水浴熔解的1.3.1实验组和对照组液态水凝胶并混匀。采用移液器吸取2组混合液,每组各1 mL,在直径为60 mm的培养皿中形成一直径10 mm的圆形,于4 ℃无菌冷却10 min后取出,加入25 g/L氯化钙溶液5 mL交联10 min后弃去交联剂,采用DMEM完全培养基清洗2遍后得到载细胞水凝胶块。
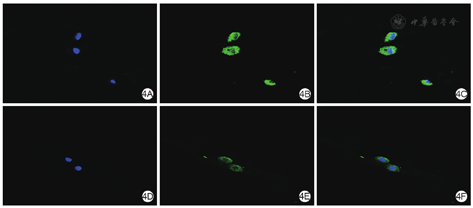
取2组单细胞悬液,分别加入1 μL无菌绿色荧光探针DIO染液,用移液器吹打均匀,分别加入9 mL经37 ℃水浴熔解的1.3.1实验组和对照组水凝胶并充分混匀。同1.7.1制备载细胞水凝胶并交联,加入DMEM完全培养基8 mL,在细胞培养箱中培养3 d。而后取出凝胶块,用40 g/L多聚甲醛溶液固定,进行冰冻切片(厚6 μm),行4′,6-二脒基-2-苯基吲哚染色,于200倍激光共聚焦显微镜下观察2组细胞在凝胶中的存活情况。
同1.7.1制备2组载细胞水凝胶块并交联,在细胞培养箱中培养7 d,用40 g/L多聚甲醛溶液固定,分别用体积分数20%、40%、60%、80%、100%乙醇脱水后晾干,在扫描电子显微镜下观察2组细胞在水凝胶中的黏附及伸展情况。
取裸鼠12只,称体质量后按50 mg/kg腹腔注射20 g/L戊巴比妥钠麻醉,待完全麻醉后,使用高压灭菌后的手术器械将每只裸鼠背部剪开一条1 cm长的矢状切口,以切口中点为中心,制备直径1 cm的圆形全层皮肤缺损创面。按随机数字表法分为实验组和对照组,每组各6只。伤后即刻,实验组和对照组裸鼠创面分别放入1块1.7.1中制备的实验组和对照组载细胞水凝胶块,并使其与创面完全贴合,并用吻合器吻合切口。伤后7、14 d,每组各处死3只裸鼠,收集背部创面及距创缘0.5 cm内的组织,用40 g/L多聚甲醛固定。常规脱水、透明、浸蜡、石蜡包埋,超薄切片机切片(厚度<7 μm),脱蜡入水,HE染色,脱水透明,晾干封片,于200倍倒置显微镜下观察创面愈合情况。
采用SPSS 19.0统计软件进行分析,计量资料数据均符合正态分布,以 ±s表示,组间两两比较行独立样本t检验。P<0.05为差异有统计学意义。
±s表示,组间两两比较行独立样本t检验。P<0.05为差异有统计学意义。
无活性二氧化硅纳米粒子经氢氧化钙溶液表面改性后得到有活性生物玻璃粒子,两者均可在水中均匀分散,具有良好的悬浮稳定性。无活性生物玻璃悬液呈透明色,有活性生物玻璃悬液呈乳白色。见图1。


实验组与对照组水凝胶在37 ℃下均呈熔融状态,均未见粒子析出(图2);实验组和对照组水凝胶在该温度下的熔胶时间分别为5、10 min。实验组和对照组水凝胶在25 ℃下成胶时间分别为30、180 min,在4 ℃下成胶时间分别为5、10 min。


实验组水凝胶压缩模量为(53±6)kPa,明显高于对照组的(23±6)kPa(t=6.364,P<0.01)。
实验组水凝胶孔隙率为(86.1±2.1)%,低于对照组的(88.2±4.4)%,但差异无统计学意义(t=1.210,P>0.05)。
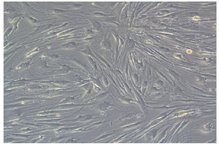
细胞大小、形态较均一,呈长梭形,细胞核所占比例较大,符合Fb形态学特征。见图3。

培养12、24、48 h,实验组细胞存活率为(84±4)%、(89±4)%、(130±10)%,与对照组的(89±5)%、(90±4)%和(130±11)%相近(t=1.534、0.611、0.148,P>0.05)。
培养3 d,2组细胞在水凝胶中形态完整,未见细胞核裂解、消失,细胞质保持完好,并且实验组细胞荧光强度明显强于对照组。见图4。

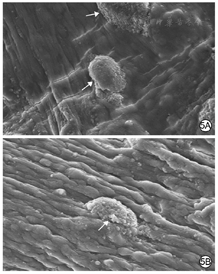
培养7 d,实验组和对照组细胞均可在水凝胶中黏附、伸展,实验组细胞在水凝胶中黏附数明显多于对照组。见图5。

注:白色箭头示成纤维细胞
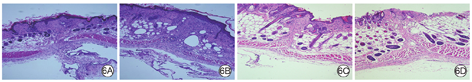
伤后7 d,对照组、实验组裸鼠背部创面面积均缩小,以实验组更明显,2组裸鼠创面及创周均可见大量炎症细胞分布。伤后14 d,2组裸鼠创面已基本愈合,对照组裸鼠创面面积大于实验组,且对照组创面及创周炎症细胞数明显多于实验组。见图6。

皮肤是人体表面积最大的器官,也是机体最大的一道天然保护屏障,其位于体表,对维持人体内环境的稳态和机体的正常生理功能具有十分重要的作用。范围小、深度浅的皮肤缺损可以靠机体的自愈能力进行无痕或瘢痕修复,而大范围、程度较深的皮肤缺损则不能自愈,常造成延迟愈合或愈合不全,且短时间内可引起机体功能严重紊乱[19]。皮肤严重缺损不仅可引起机体短时间的体液失衡,其漫长的愈合过程还经常引起机体不同程度的感染,进而再次引起体液失衡,造成机体脏器的损伤、衰竭[20,21]。因此,如何修复此类自愈能力不足的创面成为临床工作中的一大难点,可促进创面愈合的体内或体外生物代替材料是治疗此类难愈性创面的有效手段[22,23,24]。随着组织工程技术的日新月异,三维生物打印技术和载细胞水凝胶正逐渐成为研究人员关注的重点。理想的体外创面敷料应具备可黏附创面、硬度适中、透气透水的理化特性,同时还具有能形成保水层,维持内环境稳态等基本特征;此外,还应具备方便携带、使用的特性[25,26]。而水凝胶因其能同时满足以上要求,目前正成为生物材料研发领域的热点[27,28]。
本课题组前期构建了明胶-海藻酸钠水凝胶,并将此凝胶与骨髓间充质干细胞混合制备成为载细胞明胶-海藻酸钠水凝胶,结合生物三维打印技术,该水凝胶不仅能提高干细胞活性、促进干细胞的增殖[4],还能促进干细胞的分化;不仅可以体外应用,还可以运用于体内[12],在组织再生重建领域具有临床应用潜能。然而明胶、海藻酸钠构建的水凝胶在满足皮肤的理化特性要求上仍有欠缺,即机械硬度较低。为进一步提高这种载细胞水凝胶的力学强度和临床应用潜能,本课题组着手进一步改进明胶-海藻酸钠水凝胶。生物活性玻璃以其优良的理化特性及生物相容性被广泛应用于组织再生研究[29,30,31,32]。
在本研究中,笔者课题组将明胶-海藻酸钠水凝胶和改性纳米生物玻璃粒子相结合,制备出生物玻璃-明胶-海藻酸钠水凝胶。结果显示,改性后纳米生物玻璃粒子在水中可以均匀分散,保持良好的悬浮稳定性,加入明胶-海藻酸钠水凝胶后经过物理搅拌,三者可充分混合,未出现沉淀析出等现象,进一步说明纳米生物玻璃粒子不论是在水中还是在水凝胶中均能保持良好的分散性。
载细胞操作是先将水凝胶放高温下熔解成液态,而适合细胞生存的温度通常是37 ℃,而后转移至实验室室温(25 ℃)环境下将细胞与其混合,最后放4 ℃冷却,待水凝胶完全凝固后加入交联剂交联,因此水凝胶制备完成后要在37、4、25 ℃下测量其热稳定性。结果表明,在37 ℃下含生物玻璃粒子的实验组水凝胶熔胶速度明显快于对照组,在4 ℃下实验组水凝胶成胶速度快于对照组,说明实验组水凝胶可以满足快速熔解、快速成胶的要求,热稳定性相对更好,缩短了制备载细胞水凝胶操作的时间,降低了载细胞操作对细胞的损害。水凝胶熔胶、成胶时间缩短,细胞暴露时间相应缩短,实验操作引起的细胞损害得以降低。杨氏模量测量结果表明,生物玻璃-明胶-海藻酸钠水凝胶较明胶-海藻酸钠水凝胶硬度更高,与皮肤机械硬度更接近,有望成为组织工程皮肤的备选,这可能是严重皮肤缺损患者的福音。孔隙率测量结果显示,含生物玻璃的实验组水凝胶拥有丰富的孔隙,与对照组水凝胶孔隙率无明显差异,说明生物玻璃在提高水凝胶硬度的同时并未改变水凝胶的孔隙结构,水凝胶仍有充足的空间容许细胞黏附、伸展,初步证明其具有载细胞能力。
Fb是机体创伤修复最重要的细胞,因其具有增殖能力强以及免疫原性低的优点[33,34,35],被用来作本实验的工具细胞。生物材料的发明和应用都需经过生物相容性测试,即检测材料与细胞是否能共同生存,或者检测材料是否会引起机体剧烈的排斥反应。如生物材料不影响细胞的存活或产生剧烈排斥反应,则表明材料具有良好的生物相容性。本次细胞增殖/毒性实验结果显示,培养12~48 h,Fb在生物玻璃-明胶-海藻酸钠水凝胶中存活率逐渐升高,与明胶-海藻酸钠水凝胶中细胞存活率升高趋势相近,且2组细胞培养各时间点存活率无明显差异,说明生物玻璃-明胶-海藻酸钠水凝胶对细胞毒性较小,具有良好的生物相容性。
在检测了生物玻璃-明胶-海藻酸钠水凝胶的部分理化特性和生物学特性后,笔者课题组将Fb加入水凝胶中,制备载细胞生物玻璃-明胶-海藻酸钠水凝胶。培养3 d,Fb在生物玻璃-明胶-海藻酸钠水凝胶中存活,细胞形态良好、结构完整,与在明胶-海藻酸钠水凝胶中的存活情况无明显差异,同时载细胞生物玻璃-明胶-海藻酸钠水凝胶中细胞荧光强度强于明胶-海藻酸钠水凝胶,表明生物玻璃-明胶-海藻酸钠水凝胶可能更有利于细胞存活。培养7 d,2种载细胞水凝胶支架中均有细胞存在,说明细胞完全适应凝胶环境,能在水凝胶支架中伸展与黏附。动物实验结果显示,实验组裸鼠创面愈合更快,表明生物玻璃或可促进创面愈合。
综上所述,本研究制备的改性纳米生物玻璃粒子具有良好的悬浮稳定性,与明胶-海藻酸钠水凝胶结合形成的生物玻璃-明胶-海藻酸钠水凝胶富含孔隙,可为细胞提供充分的黏附、伸展空间,且该水凝胶机械硬度接近正常皮肤。Fb与生物玻璃水凝胶共培养后,未出现大面积凋亡或生长受抑,初步表明生物玻璃具有细胞无毒或低毒特性。Fb可在生物玻璃-明胶-海藻酸钠水凝胶支架中存活、黏附、伸展,进一步证明生物玻璃水凝胶具有良好的生物相容性。动物实验结果则表明,生物玻璃水凝胶具有促进创面愈合的作用。以上结果表明,生物玻璃-明胶-海藻酸钠水凝胶有潜力成为组织工程中的一类新型复合材料。
需要说明的是,本研究为新型生物材料的初步研究,仍有许多不足和改进之处。首先,本次纳米生物玻璃水凝胶的理化特性探索仅仅在孔隙率、压缩模量层面上,生物材料能够应用于临床还需要更深入的探索。另外,该水凝胶的应用主要是为了与生物三维打印技术相结合,以期制备理化特性和生物学性能优良的生物墨水,因此后期应该结合生物三维打印技术探讨其在组织工程的应用潜力。最后,本次研究仅进行了简单的体内外实验,对其促进组织再生和创面愈合的研究还需要进一步深入。
所有作者均声明不存在利益冲突



























