
探讨乳酸乳球菌温敏水凝胶对糖尿病小鼠全层皮肤缺损创面愈合的影响及其机制。
(1)按照菌与培养基体积比为1∶100用M17GS液体培养基培养约5×108集落形成单位/mL乳酸乳球菌(浓度下同),分别于培养0(即刻)、2、4、6、8、10、12 h用酶标仪观测其生长情况。另取该菌菌落同前处理并于相同时间点收集培养基分离细菌培养上清液,用台式pH计测定pH值,并用L-乳酸检测分析试剂盒测定培养0(即刻)、2、4、8、12 h的L-乳酸浓度(样本数为3)。(2)将泊洛沙姆温敏聚合物与M17GS液体培养基按照质量与体积比为0.2 g∶1 mL充分混匀,制备单纯温敏水凝胶。按照菌与水凝胶体积比1∶100在单纯温敏水凝胶中加入乳酸乳球菌,充分混匀后制备乳酸乳球菌温敏水凝胶,分别在4、37 ℃孵育以及成胶后再4 ℃孵育观察其形态;通过流变仪测定乳酸乳球菌温敏水凝胶在10~40 ℃的储能模量与损耗模量,同时观察成胶温度;将乳酸乳球菌温敏水凝胶冷冻干燥后,通过扫描电子显微镜观察其表面及其中乳酸乳球菌的形态结构。(3)将小鼠巨噬细胞系Raw264.7细胞用终质量浓度分别为100、10 ng/mL内毒素/脂多糖与γ干扰素培养24 h刺激M1型极化,将细胞分为空白对照组(不做其他处理)、乳酸乳球菌温敏水凝胶组和乳酸组。乳酸乳球菌温敏水凝胶组细胞加入1 mL乳酸乳球菌温敏水凝胶,乳酸组细胞加入终物质的量浓度为30 mmol/L乳酸,37 ℃培养24 h后,通过实时荧光定量反转录PCR(RT-PCR)法检测M2型巨噬细胞标志物精氨酸酶1、CD206的mRNA表达量(样本数为3),采用免疫荧光法检测精氨酸酶1和CD206的蛋白定位与表达。(4)取15只8~10周龄雌性BALB/c小鼠,通过链脲佐菌素联合高糖高脂饲料的方法诱导为糖尿病小鼠模型后,在每只小鼠背部制作直径6 mm全层皮肤缺损创面,采用随机数字表法将小鼠分为空白对照组(不做其他处理)、单纯温敏水凝胶组和乳酸乳球菌温敏水凝胶组,每组5只。水凝胶处理2组小鼠伤后即刻分别滴加200 μL相应水凝胶至创面,每天更换水凝胶。水凝胶处理2组小鼠处理0(即刻)、3、6、9、12 d后,观察创面愈合情况,测量创面面积;处理12 d后,取创面组织,行苏木精-伊红染色观察肉芽组织厚度,采用免疫荧光法观测CD206、M1型巨噬细胞标志物诱导型一氧化氮合酶(iNOS)阳性细胞。空白对照组小鼠于前述相同时间点进行相应观测。(5)取9只8~10周龄雌性BALB/c小鼠同实验(4)方法诱导糖尿病小鼠模型后,采用随机数字表法分为正常皮肤组(不做其他处理)、单纯创面组、乳酸乳球菌温敏水凝胶组,每组3只。单纯创面组与乳酸乳球菌温敏水凝胶组小鼠按照实验(4)方法制成全层皮肤缺损创面,前一组小鼠伤后不做其他处理,后一组小鼠伤后即刻滴加200 μL乳酸乳球菌温敏水凝胶至创面。水凝胶处理组小鼠处理1 d后,取创面组织,通过实时荧光定量RT-PCR法检测白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)和核因子κB mRNA表达量;眼球取血后,通过全自动血细胞分析仪检测外周血白细胞计数、淋巴细胞计数和单核细胞计数,通过L-乳酸检测分析试剂盒测定血清L-乳酸浓度。于前述相同时间点,取正常皮肤组小鼠相应部位正常皮肤组织、单纯创面组小鼠创面组织及2组小鼠血液进行相应检测。对数据行单因素方差分析、重复测量方差分析、Tukey和Dunnett检验。
(1)乳酸乳球菌于培养约6 h生长达到平台期。乳酸乳球菌培养上清液中,pH值逐渐降低,至培养8 h下降至最低值4.9左右;L-乳酸浓度逐渐升高,至培养8 h达到最高值约70 mmol/L。(2)乳酸乳球菌温敏水凝胶在4 ℃为液体溶胶态,在37 ℃为固体凝胶态,成胶后于4 ℃孵育后再次变为液体溶胶态;成胶温度约为25 ℃,成胶后储能模量约为3 000 Pa、损耗模量约为1 000 Pa。扫描电子显微镜下可见,乳酸乳球菌温敏水凝胶为疏松三维多孔结构,乳酸乳球菌为椭球形并被包裹在水凝胶内部。(3)培养24 h,与空白对照组比较,乳酸乳球菌温敏水凝胶组、乳酸组巨噬细胞中精氨酸酶1表达量显著升高(q=11.620、15.250,P<0.01)、CD206 mRNA表达量显著升高(q=16.770、19.030,P<0.01),定位于细胞膜的CD206蛋白和定位于细胞质的精氨酸酶1蛋白表达明显升高;乳酸组巨噬细胞中精氨酸酶1、CD206 mRNA表达量与乳酸乳球菌温敏水凝胶组相近(q=3.629、2.259,P>0.05)。(4)处理3~12 d后,与空白对照组和单纯温敏水凝胶组比较,乳酸乳球菌温敏水凝胶组小鼠创面愈合速度更快,创面面积明显缩小,创缘炎症减轻。乳酸乳球菌温敏水凝胶组小鼠处理3、6、9、12 d后创面面积[(25.8±5.9)、(21.2±4.6)、(16.0±2.4)、(8.4±2.4)mm2]较空白对照组[(31.8±5.3)、(28.0±3.4)、(22.6±3.7)、(17.0±1.0)mm2]显著缩小(q=3.506、3.973、3.856、5.025,P<0.05或P<0.01),处理3、6 d后创面面积较单纯温敏水凝胶组显著缩小(q=3.739、3.739,P<0.05)。处理12 d后,与空白对照组和单纯温敏水凝胶组比较,乳酸乳球菌温敏水凝胶组小鼠创面肉芽组织更厚,创面组织中iNOS阳性细胞明显减少且CD206阳性细胞明显增多。(5)处理1 d后,单纯创面组小鼠创面组织中IL-1β、TNF-α和核因子κB mRNA表达量显著高于正常皮肤组小鼠正常皮肤组织(q=9.253、4.819、6.020,P<0.01),与乳酸乳球菌温敏水凝胶组相近(q=2.850、2.735、2.556,P>0.05);单纯创面组小鼠外周血白细胞计数、淋巴细胞计数与单核细胞计数显著高于正常皮肤组(q=3.523、5.373、5.279,P<0.05或P<0.01),与乳酸乳球菌温敏水凝胶组相近(q=0.621、1.240、1.293,P>0.05);3组小鼠血清L-乳酸浓度均保持在正常范围内且组间总体比较差异无统计学意义(F=4.095,P>0.05)。
乳酸乳球菌温敏水凝胶在糖尿病全层皮肤缺损小鼠创面局部使用安全,能够通过原位生产投递乳酸,促进巨噬细胞从M1型向M2型极化,重塑创面愈合微环境,促进创面的高效愈合。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
巨噬细胞主导着皮肤组织损伤后局部免疫反应,大量的组织驻留和募集的巨噬细胞参与了创面愈合的各个阶段[1,2,3]。巨噬细胞通过连续的表型转化对微环境信号进行动态响应,同时分泌各种趋化因子、蛋白酶、生长因子和ECM组分等,协调着组织修复的进展并决定其预后[4,5]。现有研究表明,巨噬细胞从具有促炎特性的M1表型向具有抗炎和组织修复功能的M2表型极化来协调复杂的创面愈合过程[6,7,8]。然而,在以糖尿病创面为代表的各种难愈性创面中,巨噬细胞正常功能受损,表现为促炎M1型巨噬细胞的积累和表型转换的障碍,从而形成了持续炎症、高蛋白水解、过度的氧化应激的恶劣创面环境[9,10,11],加剧了组织损伤,延缓了创面愈合[12]。近年来研究显示,乳酸作为一种巨噬细胞"表型转化开关",通过表观遗传学修饰,促进M1型巨噬细胞中M2型相关基因的激活,诱导了巨噬细胞的M2型极化[13]。有鉴于此,本研究设计构建负载益生菌乳酸乳球菌的温敏水凝胶,探讨其对糖尿病创面愈合的影响及作用机制。
本研究经陆军军医大学动物实验伦理委员会审批通过,批号:amuwec20201397。
40只健康无特殊病原体级8~10周龄体质量20~25 g雄性BALB/c小鼠购自陆军军医大学实验动物中心,许可证号:SCXK(军)2017-0024。食品安全级乳酸乳球菌乳脂亚种NZ9000菌株由陆军军医大学微生物学教研室保存,M17干粉购自英国Oxoid公司,泊洛沙姆(Poloxamer 407)温敏聚合物、乳酸和链脲佐菌素(STZ)、LPS购自美国Sigma公司,Raw264.7小鼠巨噬细胞株购自美国ATCC公司,DMEM高糖培养基、胎牛血清、PBS均购自美国HyClone公司,L-乳酸检测分析试剂盒购自美国Cayman公司,Transwell透明板购自美国Corning公司,高糖高脂饲料购自美国Research Diet公司,兔抗小鼠CD206多克隆抗体、兔抗小鼠诱导型一氧化氮合酶(iNOS)多克隆抗体购自美国Abcam公司,兔抗小鼠精氨酸酶1多克隆抗体购自美国eBioscience公司,γ干扰素购自美国Peprotech公司,纤维组织RNA提取试剂盒购自德国Qiagen公司,TRIzol RNA提取试剂、Alexa Fluor 594标记的山羊抗兔IgG抗体购自美国Thermo Fisher公司,Alexa Fluor 488标记的山羊抗兔IgG抗体购自美国CST公司,实时荧光定量RT-PCR引物由北京六合华大基因公司设计、合成,去基因组DNA逆转录试剂盒、TB Green定量PCR酶购自日本Takara公司,4′,6-二脒基-2-苯基吲哚(DAPI)、山羊血清购自上海碧云天生物技术有限公司,无菌透明手术敷贴购自美国3M公司。M2e型多波长酶标仪购自美国Molecular Devices公司,S20型台式pH计购自瑞士Mettler-Toledo公司,FEI Inspect-f型扫描电子显微镜购自荷兰Philips公司,HR-1型流变仪购自美国TA Instrument公司,LSM780型激光扫描共聚焦显微镜购自德国Zeiss公司,CFX Connect型实时荧光定量PCR仪购自美国Bio-Rad公司,LH 750型全自动血细胞分析仪购自美国贝克曼库尔特公司,BX53F型荧光显微镜购自日本奥林巴斯公司。
从-80 ℃冰箱取甘油法冻存的乳酸乳球菌,在M17GS固体培养基(按照100 mL纯水中加入3.725 g M17干粉、0.5 g葡萄糖、0.5 g乳糖、0.55 g蔗糖、1.5 g琼脂粉的比例配制)中按三线法划线复苏。30 ℃培养24 h长出单菌落,挑取单菌落至M17GS液体培养基培养过夜。按照菌与培养基体积比为1∶100接种过夜培养的约5×108 CFU/mL乳酸乳球菌(菌与培养基体积比及菌浓度下同)至含100 μL M17GS液体培养基的96孔板中,取1孔分别于培养0(即刻)、2、4、6、8、10、12 h,通过酶标仪测定其在600 nm处吸光度值,以定量液体培养基中细菌密度并拟合其生长曲线。将过夜培养的乳酸乳球菌接种至含20 mL M17GS液体培养基锥形瓶中,分别于培养0(即刻)、2、4、6、8、10、12 h收集2 mL培养基,37 ℃下10 000×g离心3 min分离菌体与上清液,通过台式pH计测定细菌培养上清液中pH值;选取培养0(即刻)、2、4、8、12 h检测pH值后细菌培养上清液,按照L-乳酸检测分析试剂盒操作说明书测定L-乳酸浓度(重复3次)。
将泊洛沙姆温敏聚合物与M17GS液体培养基按照质量与体积比为0.2 g∶1 mL混合,冰上搅拌至聚合物充分溶解,制备单纯温敏水凝胶。随后按照菌与单纯温敏水凝胶体积比为1∶100加入过夜培养的乳酸乳球菌,充分混匀后制备乳酸乳球菌温敏水凝胶(配制好后4 ℃下保存备用),分别在4、37 ℃孵育1 min以及成胶后再4 ℃孵育1 min,拍照记录水凝胶形态。通过流变仪,以频率10 rad/s、剪切应变2%,在温度斜坡模式下,测定乳酸乳球菌温敏水凝胶在10~40 ℃的储能模量与损耗模量,同时观察成胶温度。将乳酸乳球菌温敏水凝胶冷冻干燥后,于200、5 000倍扫描电子显微镜下观察其表面及其中乳酸乳球菌的形态结构。
取小鼠巨噬细胞系Raw264.7细胞,按照每孔1×106个接种至6孔Transwell板下室,用含体积分数10%胎牛血清的DMEM高糖培养基培养,待细胞贴壁后加入终质量浓度分别为100、10 ng/mL的LPS与γ干扰素刺激其M1型极化,24 h后更换新鲜培养基,将细胞分为空白对照组、乳酸乳球菌温敏水凝胶组和乳酸组。空白对照组细胞不做其他处理,乳酸乳球菌温敏水凝胶组上层小室加入1 mL乳酸乳球菌温敏水凝胶,乳酸组培养基中加入终物质的量浓度为30 mmol/L的乳酸,37 ℃培养24 h,进行以下检测。
采用实时荧光定量RT-PCR法检测。取各组细胞,每组取3孔,去除培养基后加入1 mL TRIzol,按照操作说明提取细胞总RNA,常规测定RNA浓度与纯度,按照20 μL反转录体系合成互补DNA,采用实时荧光定量PCR仪检测精氨酸酶1、CD206的mRNA表达,引物序列及产物大小见表1。PCR条件:95 ℃预变性2 min;95 ℃变性10 s,52 ℃退火10 s,72 ℃延伸20 s,共40个循环。以核糖体蛋白L13A(RPL13A)为内参照,基于Δ循环阈值(Ct)的2-ΔΔCt方法对精氨酸酶1、CD206的mRNA相对表达情况进行定量,以空白对照组结果为1,其余2组与空白对照组比值为相应蛋白mRNA表达量的相对值。

实时荧光定量反转录PCR检测小鼠巨噬细胞M2型巨噬细胞表面标志物mRNA表达的引物序列及产物大小
实时荧光定量反转录PCR检测小鼠巨噬细胞M2型巨噬细胞表面标志物mRNA表达的引物序列及产物大小
| 引物名称 | 引物序列(5′→3′) | 产物大小(bp) |
|---|---|---|
| 核糖体蛋白L13A | 上游:GAGGTCGGGTGGAAGTACCA | 71 |
| 下游:TGCATCTTGGCCTTTTCCTT | ||
| CD206 | 上游:TGATTACGAGCAGTGGAAGC | 126 |
| 下游:GTTCACCGTAAGCCCAATTT | ||
| 精氨酸酶1 | 上游:GCAGAGGTCCAGAAGAATGG | 123 |
| 下游:AGCATCCACCCAAATGACAC |
采用免疫荧光法观测。取各组细胞,每组1孔,40 g/L多聚甲醛室温固定10 min,用含体积分数10%山羊血清的PBS封闭1 h。分别加入兔抗小鼠精氨酸酶1多克隆一抗、兔抗小鼠CD206多克隆一抗(稀释比均为1∶1 000),4 ℃下孵育过夜。分别加入Alexa Fluor 488标记的山羊抗兔IgG二抗以及Alexa Fluor 594标记的山羊抗兔IgG二抗(稀释比均为1∶1 000),室温孵育1 h。经DAPI共染后,600倍激光扫描共聚焦显微镜下观察精氨酸酶1和CD206蛋白定位和表达(以荧光强度表示),精氨酸酶1阳性染色为绿色,CD206阳性染色为红色。
取25只BALB/c小鼠,通过STZ联合高糖高脂饲料的方法诱导糖尿病小鼠模型[14],即小鼠禁食12 h后,按照50 mg/kg剂量连续5 d腹腔注射溶于pH值为4.2~4.5的柠檬酸盐缓冲液的10 g/L STZ,整个实验期间给予高糖高脂饲料自由进食。通过罗氏血糖仪连续监测尾静脉血中血糖浓度,血糖浓度高于16 mmol/L并稳定2周的15只小鼠被纳入研究。糖尿病小鼠经10 g/L戊巴比妥钠以50 mg/kg腹腔注射麻醉后,用刮毛器和脱毛膏去除背部毛发,暴露皮肤,使用直径6 mm的皮肤打孔器制作全层皮肤缺损创面模型,采用随机数字表法将小鼠分为空白对照组、单纯温敏水凝胶组和乳酸乳球菌温敏水凝胶组,每组5只。空白对照组小鼠不做其他处理;水凝胶处理2组小鼠伤后即刻创面分别滴加200 μL相应水凝胶,约20 s水凝胶成胶后,所有创面均用无菌透明敷贴覆盖,防止水凝胶脱落以及创面收缩,每天更换水凝胶。
水凝胶处理2组小鼠处理0(即刻)、3、6、9、12 d后,用数码相机记录创面愈合情况,通过ImageJ 1.52a图像分析软件(美国国立卫生研究院)计算创面面积。空白对照组小鼠于相同时间点进行相应观测。
水凝胶处理2组处理12 d后,同1.5.1麻醉小鼠,取适量创面组织经40 g/L多聚甲醛固定,石蜡包埋,以5 μm厚度切片,行HE染色,40倍光学显微镜下观察肉芽组织厚度。空白对照组小鼠于相同时间点进行相应观察。
采用免疫荧光法观测。水凝胶处理2组处理12 d后,取1.5.3制备的未染色切片经脱蜡处理后,在98 ℃柠檬酸盐缓冲液中进行抗原修复10 min,以含体积分数10%山羊血清的PBS封闭非特异性结合位点约2 h,分别加入兔抗小鼠CD206多克隆一抗、兔抗小鼠iNOS多克隆一抗(稀释比均为1∶1 000),4 ℃孵育过夜。分别加入Alexa Fluor 594标记的山羊抗兔IgG二抗、Alexa Fluor 488标记的山羊抗兔IgG二抗(稀释比均为1∶1 000),室温孵育1 h。经DAPI共染后,200倍荧光显微镜下观察iNOS和CD206蛋白表达阳性的细胞数量,iNOS阳性染色为绿色,CD206阳性染色为红色。空白对照组小鼠于相同时间点进行相应观测。
取15只BALB/c小鼠同1.5.1方法诱导糖尿病小鼠模型,最终9只小鼠建模成功,按随机数字表法分为正常皮肤组、单纯创面组、乳酸乳球菌温敏水凝胶组,每组3只。正常皮肤组小鼠不做其他处理;单纯创面组与乳酸乳球菌温敏水凝胶组小鼠按照1.5.1方法制成全层皮肤缺损创面,前一组小鼠伤后不做其他处理,后一组小鼠伤后即刻滴加200 μL乳酸乳球菌温敏水凝胶至创面。
水凝胶处理组小鼠处理1 d后,同1.5.1麻醉,取创面组织,使用纤维组织RNA提取试剂盒,按照说明书方案从100 mg创面组织中提取总RNA。同1.4.2采用实时荧光定量RT-PCR法检测炎症因子IL-1β、TNF-α和核因子κB mRNA表达,引物序列及产物大小见表2。于相同时间点取正常皮肤组小鼠相应部位正常皮肤组织、单纯创面组创面组织进行相应检测。

实时荧光定量反转录PCR检测糖尿病小鼠全层皮肤缺损创面组织炎症因子mRNA表达的引物序列及产物大小
实时荧光定量反转录PCR检测糖尿病小鼠全层皮肤缺损创面组织炎症因子mRNA表达的引物序列及产物大小
| 引物名称 | 引物序列(5′→3′) | 产物大小(bp) |
|---|---|---|
| 白细胞介素1β | 上游:GCAACTGTTCCTGAACTCAACT | 89 |
| 下游:ATCTTTTGGGGTCCGTCAACT | ||
| 肿瘤坏死因子α | 上游:GCCACCACGCTCTTCTGTCT | 102 |
| 下游:GGTCTGGGCCATAGAACTGATG | ||
| 核因子κB | 上游:TCTCTATGACCTGGACGACTCTT | 128 |
| 下游:GCTCATACGGTTTCCCATTTAGT |
1.6.2取材结束后,对3组小鼠进行眼球取血,取血后脱颈处死小鼠。取1 mL血通过全自动血细胞分析仪检测血液样本中白细胞计数、淋巴细胞计数和单核细胞计数;取100 μL血,离心分离血细胞和血清,通过L-乳酸检测分析试剂盒测定血清L-乳酸浓度。
采用SPSS 18.0统计软件进行数据分析,计量资料数据均符合正态分布,以 ±s表示,单一时间点指标组间总体比较采用单因素方差分析,多组多个时间点组间总体比较采用重复测量方差分析,组间两两比较进行Tukey或Dunnett检验并对P值进行校正,P<0.05为差异有统计学意义。
±s表示,单一时间点指标组间总体比较采用单因素方差分析,多组多个时间点组间总体比较采用重复测量方差分析,组间两两比较进行Tukey或Dunnett检验并对P值进行校正,P<0.05为差异有统计学意义。
乳酸乳球菌于培养约6 h生长达到平台期。随着培养时间的延长,乳酸乳球菌培养上清液中pH值逐渐降低,于培养8 h下降至最低值,培养8~12 h的pH值保持在4.9左右。见图1。随着培养时间的延长,乳酸乳球菌培养上清液中L-乳酸浓度逐渐升高,于培养8 h达到最高值,约70 mmol/L,见图2。
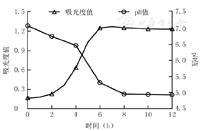

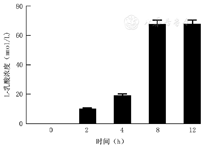
 ±s)
±s)
 ±s)
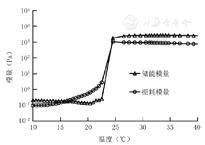
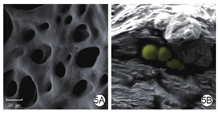
±s)乳酸乳球菌温敏水凝胶在4 ℃为液体溶胶态,在37 ℃为固体凝胶态,成胶后于4 ℃孵育后再次变为液体溶胶态,表现出良好的逆向温敏性能(图3)。25 ℃以下时,乳酸乳球菌温敏水凝胶储能模量与损耗模量较低;25 ℃时,乳酸乳球菌温敏水凝胶储能模量与损耗模量迅速增加,从溶胶状态立即变为凝胶状态,成胶后储能模量约为3 000 Pa,损耗模量约为1 000 Pa(图4)。扫描电子显微镜下可见,乳酸乳球菌温敏水凝胶大体形貌为胶束纵横交叉形成的疏松三维多孔结构,并将乳酸乳球菌包裹其中,在水凝胶横断面可见乳酸乳球菌为直径约1 μm的椭球形(图5)。




培养24 h,与空白对照组比较,乳酸组巨噬细胞中精氨酸酶1 mRNA表达量上调约65倍、CD206 mRNA表达量上调约8倍(P<0.01),乳酸乳球菌温敏水凝胶组巨噬细胞中精氨酸酶1 mRNA表达量上调约50倍、CD206 mRNA表达量上调约7倍(P<0.01);乳酸组小鼠巨噬细胞中精氨酸酶1、CD206 mRNA表达量与乳酸乳球菌温敏水凝胶组相近(P>0.05)。见表3。
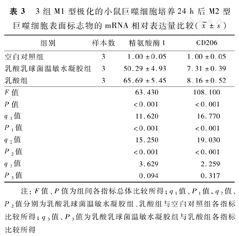
3组M1型极化的小鼠巨噬细胞培养24 h后M2型巨噬细胞表面标志物的mRNA相对表达量比较( ±s)
±s)
3组M1型极化的小鼠巨噬细胞培养24 h后M2型巨噬细胞表面标志物的mRNA相对表达量比较( ±s)
±s)
| 组别 | 样本数 | 精氨酸酶1 | CD206 |
|---|---|---|---|
| 空白对照组 | 3 | 1.00±0.05 | 1.00±0.05 |
| 乳酸乳球菌温敏水凝胶组 | 3 | 50.29±4.93 | 7.31±0.39 |
| 乳酸组 | 3 | 65.69±5.45 | 8.16±0.52 |
| F值 | 63.430 | 108.100 | |
| P值 | <0.001 | <0.001 | |
| q1值 | 11.620 | 16.770 | |
| P1值 | <0.001 | <0.001 | |
| q2值 | 15.250 | 19.030 | |
| P2值 | <0.001 | <0.001 | |
| q3值 | 3.629 | 2.259 | |
| P3值 | 0.094 | 0.317 |
注:F值、P值为组间各指标总体比较所得;q1值、P1值,q2值、P2值分别为乳酸乳球菌温敏水凝胶组、乳酸组与空白对照组各指标比较所得;q3值、P3值为乳酸乳球菌温敏水凝胶组与乳酸组各指标比较所得
培养24 h,与空白对照组比较,乳酸乳球菌温敏水凝胶组和乳酸组巨噬细胞定位于细胞质的精氨酸酶1蛋白和定位于细胞膜的CD206蛋白表达明显升高,见图6。
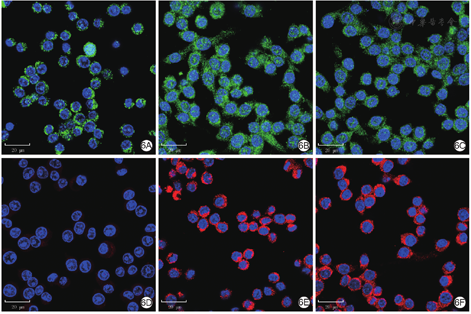

注:精氨酸酶1阳性染色为绿色,CD206阳性染色为红色,细胞核阳性染色为蓝色
处理3~12 d后,单纯温敏水凝胶组与空白对照组小鼠创面大体情况相似,与该2组比较,乳酸乳球菌温敏水凝胶组小鼠创面愈合速度更快,创面面积明显缩小,创缘组织炎症红肿情况减轻。见图7。
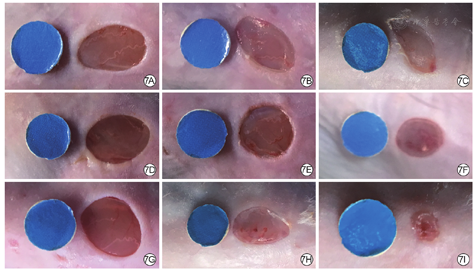

注:蓝色圆形卡片为参照物,直径6 mm
处理0 d,3组小鼠创面面积相近(P>0.05)。处理3、6、9、12 d后,与空白对照组比较,单纯温敏水凝胶组小鼠创面面积无明显变化(P>0.05),乳酸乳球菌温敏水凝胶组小鼠创面面积显著缩小(P<0.05或P<0.01)。与单纯温敏水凝胶组比较,乳酸乳球菌温敏水凝胶组小鼠处理3、6 d创面面积显著缩小(P<0.05)。见表4。
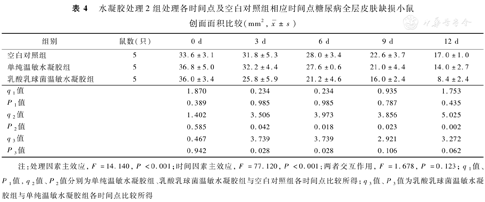
水凝胶处理2组处理各时间点及空白对照组相应时间点糖尿病全层皮肤缺损小鼠创面面积比较(mm2, ±s)
±s)
水凝胶处理2组处理各时间点及空白对照组相应时间点糖尿病全层皮肤缺损小鼠创面面积比较(mm2, ±s)
±s)
| 组别 | 鼠数(只) | 0 d | 3 d | 6 d | 9 d | 12 d |
|---|---|---|---|---|---|---|
| 空白对照组 | 5 | 33.6±3.1 | 31.8±5.3 | 28.0±3.4 | 22.6±3.7 | 17.0±1.0 |
| 单纯温敏水凝胶组 | 5 | 36.8±5.0 | 32.2±4.4 | 27.6±0.6 | 21.0±4.4 | 14.0±2.7 |
| 乳酸乳球菌温敏水凝胶组 | 5 | 36.0±3.4 | 25.8±5.9 | 21.2±4.6 | 16.0±2.4 | 8.4±2.4 |
| q1值 | 1.870 | 0.234 | 0.234 | 0.935 | 1.753 | |
| P1值 | 0.389 | 0.985 | 0.985 | 0.787 | 0.435 | |
| q2值 | 1.402 | 3.506 | 3.973 | 3.856 | 5.025 | |
| P2值 | 0.585 | 0.042 | 0.018 | 0.023 | 0.002 | |
| q3值 | 0.467 | 3.739 | 3.739 | 2.921 | 3.272 | |
| P3值 | 0.942 | 0.028 | 0.028 | 0.106 | 0.062 |
注:处理因素主效应,F=14.140,P<0.001;时间因素主效应,F=77.120,P<0.001;两者交互作用,F=1.678,P=0.123;q1值、P1值,q2值、P2值分别为单纯温敏水凝胶组、乳酸乳球菌温敏水凝胶组与空白对照组各时间点比较所得;q3值、P3值为乳酸乳球菌温敏水凝胶组与单纯温敏水凝胶组各时间点比较所得
处理12 d后,与空白对照组和单纯温敏水凝胶组比较,乳酸乳球菌温敏水凝胶组小鼠创面肉芽组织更厚,见图8。
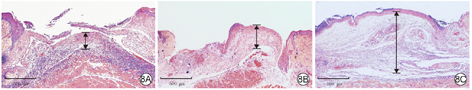

注:黑色双向箭头示肉芽组织厚度
处理12 d后,与空白对照组和单纯温敏水凝胶组比较,乳酸乳球菌温敏水凝胶组小鼠创面组织中iNOS阳性细胞明显减少,CD206阳性细胞明显增多,见图9。
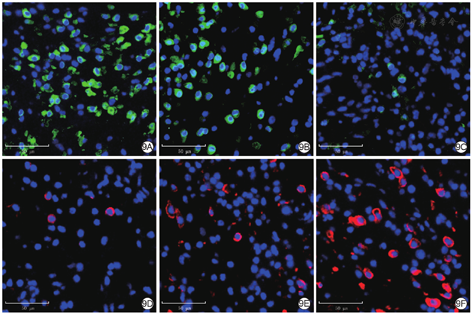

注:诱导型一氧化氮合酶(iNOS)阳性染色为绿色,CD206阳性染色为红色,细胞核阳性染色为蓝色
处理1 d后,与正常皮肤组小鼠正常皮肤组织比较,单纯创面组小鼠创面组织中IL-1β、TNF-α和核因子κB的mRNA表达量显著增加(P<0.01)。与单纯创面组比较,乳酸乳球菌温敏水凝胶组小鼠创面组织中IL-1β、TNF-α和核因子κB的mRNA表达量无明显变化(P>0.05)。见表5。
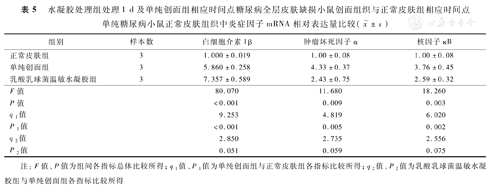
水凝胶处理组处理1 d及单纯创面组相应时间点糖尿病全层皮肤缺损小鼠创面组织与正常皮肤组相应时间点单纯糖尿病小鼠正常皮肤组织中炎症因子mRNA相对表达量比较( ±s)
±s)
水凝胶处理组处理1 d及单纯创面组相应时间点糖尿病全层皮肤缺损小鼠创面组织与正常皮肤组相应时间点单纯糖尿病小鼠正常皮肤组织中炎症因子mRNA相对表达量比较( ±s)
±s)
| 组别 | 样本数 | 白细胞介素1β | 肿瘤坏死因子α | 核因子κB |
|---|---|---|---|---|
| 正常皮肤组 | 3 | 1.000±0.019 | 1.00±0.08 | 1.00±0.08 |
| 单纯创面组 | 3 | 5.860±0.258 | 4.33±0.37 | 3.76±0.45 |
| 乳酸乳球菌温敏水凝胶组 | 3 | 7.357±0.589 | 2.43±0.75 | 2.59±0.32 |
| F值 | 80.070 | 11.680 | 18.260 | |
| P值 | <0.001 | 0.009 | 0.003 | |
| q1值 | 9.253 | 4.819 | 6.020 | |
| P1值 | <0.001 | 0.005 | 0.002 | |
| q2值 | 2.850 | 2.735 | 2.556 | |
| P2值 | 0.051 | 0.059 | 0.075 |
注:F值、P值为组间各指标总体比较所得;q1值、P1值为单纯创面组与正常皮肤组各指标比较所得;q2值、P2值为乳酸乳球菌温敏水凝胶组与单纯创面组各指标比较所得
处理1 d后,与正常皮肤组比较,单纯创面组小鼠外周血白细胞计数、淋巴细胞计数与单核细胞计数均显著升高(P<0.05或P<0.01);与单纯创面组比较,乳酸乳球菌温敏水凝胶组小鼠外周血白细胞计数、淋巴细胞计数与单核细胞计数无明显变化(P>0.05),见表6。处理1 d后,正常皮肤组、单纯创面组、乳酸乳球菌温敏水凝胶组小鼠血清L-乳酸浓度分别为(3.07±0.32)、(2.52±0.16)、(2.53±0.13)mmol/L,均保持在正常范围内且组间总体比较,差异无统计学意义(F=4.095,P=0.076)。
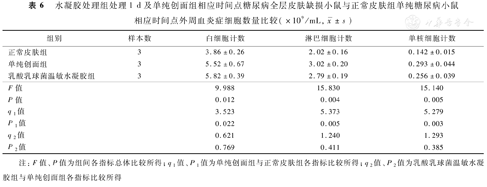
水凝胶处理组处理1 d及单纯创面组相应时间点糖尿病全层皮肤缺损小鼠与正常皮肤组单纯糖尿病小鼠相应时间点外周血炎症细胞数量比较(×109/mL,  ±s)
±s)
水凝胶处理组处理1 d及单纯创面组相应时间点糖尿病全层皮肤缺损小鼠与正常皮肤组单纯糖尿病小鼠相应时间点外周血炎症细胞数量比较(×109/mL,  ±s)
±s)
| 组别 | 样本数 | 白细胞计数 | 淋巴细胞计数 | 单核细胞计数 |
|---|---|---|---|---|
| 正常皮肤组 | 3 | 3.86±0.26 | 2.02±0.16 | 0.142±0.015 |
| 单纯创面组 | 3 | 5.52±0.67 | 3.02±0.20 | 0.293±0.044 |
| 乳酸乳球菌温敏水凝胶组 | 3 | 5.82±0.39 | 2.79±0.19 | 0.256±0.039 |
| F值 | 9.988 | 15.830 | 15.140 | |
| P值 | 0.012 | 0.004 | 0.005 | |
| q1值 | 3.523 | 5.373 | 5.279 | |
| P1值 | 0.022 | 0.005 | 0.003 | |
| q2值 | 0.621 | 1.240 | 1.293 | |
| P2值 | 0.769 | 0.411 | 0.385 |
注:F值、P值为组间各指标总体比较所得;q1值、P1值为单纯创面组与正常皮肤组各指标比较所得;q2值、P2值为乳酸乳球菌温敏水凝胶组与单纯创面组各指标比较所得
在现代社会,以糖尿病创面为代表的难愈性创面已经成为世界范围内的医学难题并带来极大的医疗和社会负担[15,16]。目前的临床治疗包括清创、抗生素应用、血糖控制、皮肤移植等主要以防止创面扩张和感染为主,虽然这些标准治疗方法可以控制症状,但是其促进难愈性创面组织再生修复的效果十分有限[17,18,19],其中主要原因是局部恶劣的创面微环境严重限制了组织的再生能力[20]。以巨噬细胞为主的各种免疫细胞构成了创面微环境网络,巨噬细胞通过其动态可塑的表型分化,组织协调着创面愈合的进程。M1型巨噬细胞产生促炎介质如TNF-α、IL-1、IL-6,蛋白酶如基质金属蛋白酶、丝氨酸蛋白酶和活性氧,其主要功能为上调炎症与对抗病原体,但其过度累积常常加剧组织损伤[21,22]。而M2型巨噬细胞的功能更多与组织再生修复相联系,其主要通过释放IL-4、IL-10和IL-13等抗炎细胞因子参与炎症的下调,同时分泌包括胰岛素样生长因子Ⅰ、VEGF、EGF和TGF等促进细胞增殖、肉芽组织形成和血管生成[23]。因此,促进难愈性创面中过度积累的M1型巨噬细胞向M2型巨噬细胞的转化有利于改善创面愈合微环境,减少组织损伤,恢复再生潜能,有效促进愈合。
笔者团队选用了一种食品级对人体安全的益生菌乳酸乳球菌[24],首先在体外培养的条件下考察了乳酸乳球菌产生乳酸的能力,通过拟合生长曲线、测定细菌培养上清液中pH值的变化和对其中乳酸浓度进行定量,证实了乳酸乳球菌生长速度较快且具有强大的产生乳酸的能力。既往研究显示,乳酸乳球菌中优化和高富集的碳代谢通路,使其能够高效利用碳源通过关键酶乳酸脱氢酶,将糖代谢过程中产生累积的丙酮酸催化产生乳酸。
基于益生菌的治疗方法近年来在代谢性疾病、感染和癌症治疗领域显示出巨大潜力[25,26,27,28,29]。但是在局部使用活菌的治疗方法受到缺乏其生长的空间和环境的限制,使得活菌在局部生物活性较低且很快被机体所清除,导致产生和投递生物效应分子的时间较短、作用效果有限[30,31]。随着新型水凝胶生物材料领域的发展,一系列细菌支持性生物聚合物载体解决了这些问题[32,33,34]。泊洛沙姆是一种美国食品和药物管理局(FDA)批准的具有良好生物相容性的水凝胶多聚物材料,其良好的温敏性能有利于实现乳酸乳球菌的负载和局部使用[35,36]。笔者团队在体外制备并通过温度转换、流变仪、扫描电子显微镜等表征了乳酸乳球菌温敏水凝胶材料学特征,证实了其具有良好的逆向温敏性能和负载能力,解决了乳酸乳球菌原位使用的时间和空间难题。
体外细胞实验中,笔者团队利用小鼠巨噬细胞系Raw264.7细胞,通过实时荧光定量RT-PCR和免疫荧光实验证明,相比于空白对照,乳酸乳球菌温敏水凝胶能够促进M1型极化的巨噬细胞中M2型巨噬细胞相关因子的激活,并和乳酸的刺激作用效果一致,证明了温敏水凝胶中的乳酸乳球菌通过持续产生投递乳酸有效促进巨噬细胞M2型极化。
接下来,笔者团队通过在体实验考察乳酸乳球菌温敏水凝胶对于糖尿病小鼠创面愈合的影响。大体观察及HE染色显示,与空白对照组和单纯温敏水凝胶组比较,乳酸乳球菌温敏水凝胶组小鼠创面愈合速度更快,且创面组织再生情况更佳。通过对创面巨噬细胞免疫荧光分型染色观察到,空白对照组、单纯温敏水凝胶组小鼠创面组织表现出更多促炎型M1型巨噬细胞的浸润,而乳酸乳球菌温敏水凝组胶小鼠创面组织促炎型M1型巨噬细胞显著减少且抗炎促修复M2型巨噬细胞显著增加,与体外细胞实验结果一致。以上结果显示,乳酸乳球菌温敏水凝胶通过调控巨噬细胞表型有效改善创面愈合微环境,促进糖尿病创面的组织再生。
尽管乳酸乳球菌是一种低免疫原性的FDA批准的对人体安全的益生菌,局部使用活细菌材料用于创面治疗仍需要考虑其内在的安全性[37,38]。炎症反应是机体应对外来刺激和病原体的首要反应[39,40],笔者团队通过对局部炎症因子表达情况的检测来考察局部炎症的情况,结果显示,相比于正常皮肤组正常皮肤组织,单纯创面组小鼠创面组织中局部炎症水平显著提高,提示创伤作为一种非生物致炎因素,显著提高了皮肤局部的炎症基线水平。而相比于单纯创面,乳酸乳球菌温敏水凝胶处理后并没有加剧创面炎症反应,说明了其局部使用的安全性。笔者团队接下来通过检测外周血炎症细胞数量的变化,证实了乳酸乳球菌温敏水凝胶不会引起系统性全身炎症反应。在此基础上,笔者团队通过测定各组小鼠的外周血乳酸水平,了解到局部使用乳酸乳球菌温敏水凝胶不会对机体全身酸碱平衡产生影响。
综上所述,本研究利用对人体安全无害的益生菌乳酸乳球菌和具有良好生物相容性的温敏水凝胶材料泊洛沙姆,设计并且构建了负载乳酸乳球菌的外用水凝胶敷料,通过使乳酸乳球菌在温敏水凝胶中原位生长并高效产生投递乳酸,持续作用于糖尿病全层皮肤缺损小鼠创面局部,有效促进了M1型巨噬细胞向M2型巨噬细胞转化,重塑了创面愈合微环境,有利于组织再生潜能的恢复,进而促进创面的高质量修复。
所有作者均声明不存在利益冲突



























